超声对燕麦蛋白氧化聚集体结构及特性的影响
2020-06-18郭亚男李顺秀李明月王中江江连洲
徐 悦,郭亚男,李顺秀,马 军,李明月,王中江,江连洲,刘 军,*
(1.东北农业大学食品学院,黑龙江哈尔滨 150030;2.山东禹王生态食业有限公司,山东禹城 251200)
燕麦被称为“第三主粮”,是一种产量丰富、营养价值极高的全价食品,具有平稳血糖、降低血压血脂等功效。2002年,燕麦作为美国《时代》杂志评选的“全球十大健康食品”中唯一上榜的谷类食品位列第五,其中含量丰富的燕麦蛋白已成为近几年的研究热点[1]。燕麦蛋白是一种由四种单纯蛋白(清蛋白、球蛋白、醇溶蛋白和谷蛋白)组成的优质谷物蛋白,在燕麦中含量高达15%左右,是小麦粉、大米的1.6~2.3倍[2]。燕麦蛋白的氨基酸组成接近FAO/WHO推荐的营养模式,人体利用率高,而且含有一般谷物中缺少的赖氨酸和精氨酸。有研究表明,赖氨酸对幼儿骨骼生长和大脑发育非常有益,色氨酸具有改善睡眠和防止头发脱落等作用[3]。燕麦蛋白具有良好的营养特性和功能特性,可广泛应用于食品行业中。但燕麦中含有丰富的脂肪,其含量高达10.57%,这导致燕麦蛋白极易被氧化。燕麦蛋白氧化变性,其构象发生变化,分子内部基团暴露后重组形成寡聚体,在疏水性和静电引力的作用下进一步形成大分子量聚集体,导致溶解度和界面活性降低,进而导致燕麦蛋白功能特性的下降[4]。
目前,通过物理手段对氧化蛋白聚集体进行调控的研究比较广泛,如超声波处理[5]、脉冲电场处理[6]和高压均质处理[7]等,通过改变蛋白质聚集体的空间结构来改善蛋白质的功能特性。但高压均质处理技术因耗能较大、处理量小,无法进行工业化生产;脉冲电场处理技术对环境如pH、温度等要求较高,操作难度大。而超声作为一种非热物理加工技术,由于其绿色高效、操作简单,更加适合在食品工业中应用[8]。研究发现,超声空化作用产生的剪切力可以破坏维持蛋白结构的作用力,如氢键、范德华力和疏水性等,进而改变蛋白质粒径分布范围[9],提高蛋白质表面的疏水性[9-10],改善蛋白质的溶解度和乳化性[11-12]以及改变蛋白质分子的聚集程度[13]等。而蛋白的氧化过程通常发生在加工之前,因此将超声直接作用于已氧化的蛋白聚集体,以达到解聚和提高蛋白功能特性的目的,具有重要的研究意义。偶氮二异丁脒盐酸盐(AAPH)分解产生的过氧自由基是脂质过氧化反应中最主要的自由基中间体[14],这种中间体会对蛋白质结构和性质产生重要影响,且采用此试剂构建的氧化聚集模型重现性和稳定性较好,因此常将AAPH作为构建氧化蛋白模型的氧化诱导剂。
本研究以燕麦蛋白为研究对象,采用AAPH构建过氧自由基-燕麦蛋白氧化体系,模拟工厂储藏过程中实际产生的氧化蛋白聚集体,将氧化蛋白聚集体分别进行不同超声功率(0、100、200、300、400、500、600 W)的超声处理,探究超声处理对蛋白结构特性(粒径、PDI、浊度、电位、二级结构、官能团、疏水性)和功能特性(溶解度、乳化性和乳化稳定性)的影响,进而研究超声对氧化蛋白结构的改变与功能特性变化的关系,以期在分子水平上探究燕麦蛋白发生结构性氧化修饰的机理,为燕麦蛋白产品的开发以及储藏提供理论依据。
1 材料与方法
1.1 材料与仪器
燕麦蛋白 纯度85%,西安皓源生物技术有限公司;二硝基苯肼 天津博迪化工股份有限公司;三氯乙酸 天津市致远化学试剂有限公司;叠氮化钠(NaN3) 山东浩中化工有限公司;乙酸乙酯 天津市光复精细化工研究所;β-巯基乙醇 Geniview公司;过硫酸铵 Geniview公司;偶氮二异丁脒盐酸盐(AAPH) 美国Sigma公司;2-硝基苯甲酸(DTNB)、乙二胺四乙酸(EDTA)、EDTA钠盐 天津市博迪化工有限公司;1,1-二苯基-2-三硝基苯肼 上海浩洋生物科技有限公司;邻苯二甲醛(OPA) 广州奈姆塔贸易有限公司;8-苯胺萘磺-1-酸盐(ANS) 上海将来实业股份有限公司;尿素(Urea)试剂 武汉博士康生物工程有限公司;Tris-Gly缓冲液(pH8.0) 北京强欣博瑞生物技术有限公司;山歌玉米油 山东山歌食品有限公司;十二烷基硫酸钠(SDS) 索莱宝生物科技有限公司。
Biosafer 650-92超声波细胞破碎仪 赛飞有限公司;HH-6数显水浴锅 山东爱博科技贸易有限公司;LW-1600 FC紫外可见分光光度计 上海菁华科技仪器有限公司;Zetasizer Nano ZSP 马尔文仪器公司;F-4500荧光分光光度计 日本HITACHI公司;MAGNA-IR 560傅立叶变换红外光谱 美国尼高力公司;Ultra-Turrax T 25高速分散器 德国IKA公司;ALPHA 1-4 LSC型冷冻干燥机 德国Christ公司;PHSJ-4A型实验室pH计 中国上海雷磁公司;DK-98-1型电热恒温水浴锅 天津市泰斯特仪器有限公司;XW-80 A旋涡混合器 上海青浦沪西仪器厂。
1.2 实验方法
1.2.1 可溶性超声燕麦蛋白的氧化聚集体的制备 根据王丹丹等[15]的方法并修改,将燕麦蛋白溶于0.01 mol/L pH7.4(含NaN30.5 mg/mL)的磷酸盐缓冲溶液配制成10 mg/mL的燕麦蛋白溶液,加入AAPH于燕麦蛋白溶液中使AAPH浓度为1 mmol/L,在避光37 ℃恒温条件下氧化处理24 h后,加入14000 kDa透析袋中,于4 ℃透析72 h,每6 h换一次去离子水,透析后的液体100 mL在冰浴条件下放置于超声波细胞破碎仪中,液面浸没变幅杆3 cm,在超声功率(0、100、200、300、400、500、600 W)条件下超声5 min,工作时间和间歇时间均为5 s,以循环冷热水控制超声温度,将超声处理后的溶液转移至4 ℃离心机中二次离心处理,离心条件为9000 r/min,20 min,留存上清液倒入板中经过24 h冷冻干燥后即可得到7种可溶性超声燕麦蛋白聚集体,包含原可溶性燕麦蛋白在内共得到8种样品分别命名为SOAP、SOOAP、U-100 W-SOOAP、U-200 W-SOOAP、U-300 W-SOOAP、U-400 W-SOOAP、U-500 W-SOOAP、U-600 W-SOOAP。
1.2.2 浊度的测定 参照李云[16]的方法,并稍作修改。将样品溶于去离子水中配制成所需的浓度,在室温下磁力搅拌60 min。分光光度计在600 nm下测定其吸光度。以去离子水作空白,测定其吸光度值A,浊度计算公式为
式(1)
式中:A表示稀释乳液在600 nm处的吸光度;V表示稀释倍数;I表示光程差0.01 m。
1.2.3 粒径分布的测定 将样品配成0.05 g/mL的溶液,搅拌均匀后,缓慢加入测量池中,当遮光度达到8%左右时即停止加样,使用Zetasizer Nano ZS测量其粒径值和PDI值。
1.2.4 电位分析 参照Crudden等[17]的测定方法,并稍作修改。采用Zetasizer Nano ZSP对蛋白溶液的Zeta电位进行测定。将蛋白样品分散到50 mmol/L、pH7.0的磷酸盐缓冲液中,配成质量分数为0.2%的蛋白溶液,上样体积为1 mL,测定温度为25 ℃。
1.2.5 红外光谱分析 参照袁德保[18]的方法,并稍作修改。将冻干样品置于干燥器内充分干燥,称取1 mg样品于100 mg溴化钾中混匀,在玛瑙研埚中研磨并用压片器压片,于红外光谱仪中测定吸收光谱。测量条件:波数范围为4000~400 cm-1的,分辨率4 cm-1,波数精度0.01 cm-1,扫描次数64次,温度25 ℃。
1.2.6 表面疏水性测定 参照Kato等[19]的方法,并稍作修改。用0.1 mol/L的中性磷酸盐缓冲溶液稀释,10000 r/min高速离心处理0.5 h除去沉淀物,以Lowery法分析测试上清液中蛋白浓度,通过磷酸盐缓冲液的逐步稀释,调控蛋白溶液浓度于0.05~0.4 mg/mL,取40 μL浓度为8 mmol/L的ANS溶液滴加至不同浓度的蛋白溶液4 mL,经振荡混匀后静置3 min,在荧光分光光度计下进行荧光强度测试,测试条件为激发波长设置为λex=390 nm,发射波长设置为λem=468 nm,扫描夹缝设置为5 nm,扫描速度设置为10 nm/s。将荧光强度与蛋白浓度作线性图,以初始段的斜率值计为样品的表面疏水性大小。
1.2.7 游离氨基含量测定 参照周麟依等[20]的方法,并稍作修改。400 mg OPA试剂充分溶解于1 mL甲醇溶液中,而后依次向溶液中加入预先配制的浓度为200 g/L SDS溶液2.5 mL及浓度为0.1 mol/L的硼酸溶液25 mL,继而转移至通风橱内加入100 μL的β-巯基乙醇,最后将溶液用蒸馏水定容至50 mL,制备成OPA溶液用于后续检测分析,量取OPA试剂4 mL与200 μL氧化米糠蛋白样品充分混匀后进行35 ℃水浴处理2 min,以蒸馏水空白组为对照在340 nm处测定吸光值。
1.2.8 蛋白游离巯基和二硫键含量的测定 参照Ellman等[21]的方法,并稍作修改。称取400 mg的DTNB,加入Tris-Gly缓冲液定容至100 mL,配成Ellman试剂。分别称取2 mg蛋白样品溶解于2 mL的TrisGly缓冲液(pH8.0)和0.02 mL的Ellman试剂。测定时溶液振荡快速混合后在25 ℃下保温反应15 min,用分光光度计测定其在412 nm处的吸光度,以不加Ellman试剂为空白,以13600 L/(mol·cm)消光系数计算游离巯基含量。将样品蛋白用磷酸盐缓冲液配成0.5 mL质量浓度为5 mg/mL的蛋白质溶液,置于10 mL塑料离心管中,加入2.5 mL含8 mol/L尿素的Tris-甘氨酸(10.4 g Tris 6.9 g甘氨酸,每升加1.2 g EDTA,pH8.0),每隔1.5 min加入20 μL DTNB(0.004 g DTNB用Tris-甘氨酸溶解定容至1 mL,避光),反应25 min,立即在412 nm处测吸光度。对照组不加蛋白质溶液,其他处理方法相同,以13600 L/(mol·cm)消光系数计算总巯基含量。根据标准曲线(y=0.0502x-0.0009,R2=0.9994)计算出蛋白质质量浓度ρ。使用摩尔消光系数13600 L/(mol·cm),根据公式计算巯基和二硫键含量。

式(2)

式(3)
式中:A412表示加Ellman试剂时样品的吸光度;D表示稀释系数;C表示样品蛋白最终质量浓度,mg/mL。
1.2.9 十二烷基磺酸钠聚丙烯酰胺凝胶电泳分析 参考安然[22]的方法,并稍作修改。样品缓冲液包含25 g/100 mL甘氨酸、12.5 g/100 mL的0.5 mol/L Tris-HCl(pH6.8)、2 g/100 mL SDS及1 g/100 mL溴酚蓝,分离胶浓度为12%,浓缩胶浓度为5%。样品处理:将蛋白样品中加入2%(v/v)β-巯基乙醇,电泳前煮沸5 min,上样量为10 μL,凝胶电泳在恒流模式下进行,在浓缩胶中电流80 mA,进入分离胶后增至120 mA。凝胶染色液采用0.25%考马斯亮蓝(R250)溶液,脱色采用高甲醇的醋酸溶液,甲醇/冰乙酸/去离子水按227∶37∶236 (v/v/v)。
1.2.10 蛋白溶解度的测定 参照Petrucelli等[23]的方法,并稍作修改。2%(w/w)的燕麦蛋白的分散液经充分搅拌后离心(10000×g,10 min,20 ℃)。用凯氏定氮法测上清液的蛋白含量。上清液的蛋白总含量与样品蛋白总含量的比值即为溶解度。
式(4)
式中:S表示溶解度,%;P0表示上清液中蛋白质的总量,mg;P1表示样品中蛋白质的总量,mg。
1.2.11 乳化性和乳化稳定性的测定 参照Pearce等[24]的方法,并稍作修改。在管内在测试管中分别加入15 mL 0.1%(w/v)蛋白质溶液和5 mL玉米油,乳液经高速均质机(24000 r/min)处理1 min后,从测试管底部取出50 μL乳液,用0.1%(w/v)的SDS溶液稀释100倍后,在500 nm波长下测出吸光度。乳化活性指数(EAI)和乳化稳定性指数ESI的计算公式为:
式(5)
式(6)
式中,DF表示稀释引子,DF=100;A0、A30分别表示0、30 min时的吸光度;c表示蛋白浓度,g/mL;φ表示光程,φ=0.01 m;θ表示油相所占分数,θ=0.25。
1.3 数据处理
每个实验均进行三次重复平行实验,利用SPSS Statistics 22软件对数据进行ANOVA差异显著性分析,用Tukey’s HSD法进行ANOVA差异性检验,差异显著P<0.05为显著性差异。采用Origin 9.1软件、PeakFit 4.12软件分析等进行数据分析、图表处理及图谱分析处理。
2 结果与分析
2.1 可溶性超声燕麦蛋白氧化聚集体的结构
如图1~图4可知,与SOAP相比,SOOAP的粒径增大,PDI值和浊度值也随之增大,而电位值随之降低;与SOOAP相比,经过超声处理的氧化燕麦蛋白,随着超声功率的增大,蛋白粒径值、PDI值和浊度值呈现先减小后增大趋势,粒径值、PDI值和浊度值在超声功率为500 W时分别从855.33 nm、0.97和543下降到最小值507.34 nm、0.26和267,电位值则呈现先增大后减小的趋势,且在超声功率为500 W时最大。
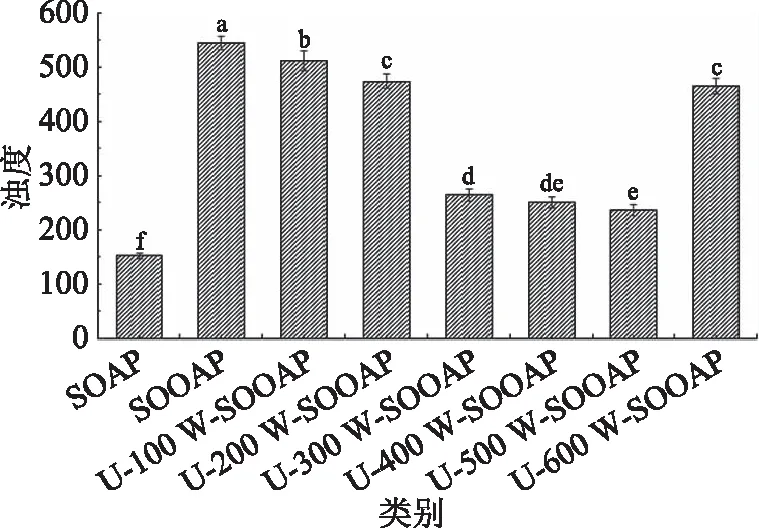
图1 可溶性超声燕麦蛋白浊度值Fig.1 The turbidity value of soluble ultrasonic oat protein注:不同小写字母代表差异显著(P<0.05),图2~图4,图6、图8、图9同。

图2 可溶性超声燕麦蛋白平均粒径Fig.2 The average particle size of soluble ultrasonic oat protein

图3 可溶性超声燕麦蛋白PDI值Fig.3 The PDI value of soluble ultrasonic oat protein
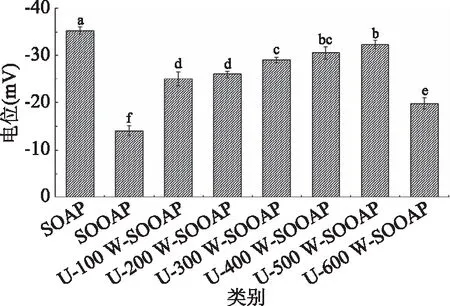
图4 可溶性超声燕麦蛋白电位值Fig.4 The potential value of soluble ultrasound oat protein
氧化可诱导蛋白结构部分解折叠暴露出更多的疏水基团,增大蛋白结构体积和疏水相互作用,减小表面静电荷密度,增大多肽链间静电相互作用,促进了氧化聚集体的形成,颗粒大小的差异也较大,蛋白液体中悬浮物增多,进而导致蛋白粒径、PDI值和浊度的增大。聚集过程中的对电荷的包埋掩藏作用消耗了溶液中的电荷,促使蛋白电位值减小。研究表明,超声可通过空化作用打开蛋白聚集体,使其最大程度的解离和崩解[25],蛋白颗粒进一步减小[10],平均粒径、PDI值和浊度值降低,电位值增大,且随着超声功率的增大其作用效果越明显,并在超声功率为500 W时效果达到最大。当超声功率超过500 W时,粒径、PDI值和浊度值增大可能与强烈的超声波造成蛋白构象改变,导致一些疏水基团的嵌入而形成大的聚集体有关[10,26]。
2.2 氧化聚集体二级结构组分测定
红外光谱图有3组特征吸收谱带,包括酰胺Ⅰ带、酰胺Ⅱ带、酰胺Ⅲ带,酰胺Ⅰ带位于波数1600~1700 cm-1范围内,主要由C=O的伸缩振动和H-O-H弯曲振动引起的,能够反映蛋白质二级结构α-螺旋、β-折叠、β-转角、无规则卷曲含量的变化。如表1所示,与SOAP相比,SOOAP中β1结构增多,α-螺旋和无规卷曲结构均减少;与SOOAP相比,氧化的燕麦蛋白经过超声处理后,随着超声功率的增大(100~200 W),β-折叠结构增多,α螺旋和β转角结构减少,随着超声功率的进一步增大(300~500 W),β折叠结构减少,α螺旋和β转角结构增多,而当超声功率为600 W时β1和β2结构增多。

表1 二级结构组分含量Table 1 Secondary structure component content
研究表明,反向平行的折叠结构(β1)在聚集的蛋白质分子中形成[27],β1结构的增多从侧面反映蛋白发生聚集。蛋白在经过氧化诱导时,蛋白发生解折叠反应,α-螺旋结构被打开,且暴露的疏水性基团增大到某个值时,静电斥力和疏水相互作用的平衡被打破,促进蛋白发生聚集,因此β-折叠结构含量上升,α-螺旋和无规卷曲含量下降,这与尤翔宇等[28]研究结果一致。超声处理产生的剪切力和空穴效应诱导蛋白质部分结构的展开[29],将不可溶性聚集体转化为可溶性聚集体,在超声功率为100~200 W时β-折叠结构增多,α-螺旋和β-转角结构减少可能与转化过程导致可溶性聚集体含量大量增多有关。随着超声功率的进一步增大,强烈的剪切力促使β-折叠结构进一步主要转化为β-转角、非天然α-螺旋结构和高度有序的超分子结构,β-折叠结构减少,α-螺旋、β-转角和γ-无规则卷曲增多,且伴有更强的分子内部氢键,由此提高了蛋白的功能性质。但当超声功率达到600 W时,高强度超声作用可诱导蛋白构象发生变化[30],促进蛋白发生聚集,促使α-螺旋含量和无规则卷曲结构的减少,β-折叠结构的增加,这与He等[30]的研究结果相一致。

图5 红外光谱图Fig.5 Infrared spectrum map
2.3 可溶性超声燕麦蛋白氧化聚集体的表面疏水性
蛋白质表面疏水性是与极性水性环境接触的蛋白质分子表面上疏水基团数量的指数,并且与其功能性质密切相关。如图6所示,与SOAP相比,蛋白经过氧化后,其表面疏水性增大。与SOOAP相比,氧化燕麦蛋白经过超声处理后,随着超声功率的增大,其表面疏水性呈现先增大后减小的趋势,且在超声功率为400 W时表面疏水性最大,提高了1180.4。

图6 表面疏水性Fig.6 Surface hydrophobicity diagram
蛋白经过氧化后,氧化修饰可导致蛋白质片段化、交联、展开和构象变化,暴露蛋白疏水性基团,使疏水相互作用增大,而疏水性的增大在一定程度上促进蛋白发生聚集,表面疏水性降低。经过超声处理后,随着超声功率的增加(100~400 W),蛋白发生解折叠作用,将不溶性聚集体转化为可溶性聚集体,蛋白分子扩大,暴露出疏水基团,表面疏水性增大。超声处理引起的空化现象导致局部温度和压力的大幅增加也可促进蛋白的解聚,使位于分子内部的疏水区域暴露于表面,即表面疏水性增大,超声功率越大解聚效果越明显[31]。但当超声功率超过500 W,蛋白的构象变化导致更多亲水性氨基酸残基以水为导向致使蛋白重新聚集,蛋白的表面疏水性减小[32]。
2.4 可溶性超声燕麦蛋白氧化聚集体的官能团含量
游离氨基的含量变化可从侧面表征蛋白氧化的程度[33]。巯基基团(-SH)是蛋白中重要的功能基团,其含量变化可反映蛋白质的变性程度,对其功能性质的发挥具有很重要的作用。如图所示,与SOAP相比,SOOAP的二硫键含量增加,氨基、巯基含量减少。与SOOAP相比,氧化的燕麦蛋白聚集体经过超声处理后,随着超声功率的增大,游离氨基和游离巯基含量呈现先增加后降低的趋势,且巯基和氨基在500 W时达到最大,而二硫键含量呈现先降低后增加的趋势,且二硫键在500 W时达到最小值,降低了0.77 nmol/mg。
研究表明,AAPH是一种水溶性偶氮类自由基引发剂[34],其溶液在有氧条件下热降解可形成过氧自由基,其解折叠作用促使蛋白中更多的SH基团暴露,二硫键断裂,且随着氧化程度的增大,促进蛋白发生了分子间聚集,进而导致游离巯基和总巯基含量的下降,二硫键含量增加,并诱导赖氨酸残基上的ε-氨基转化为蛋白质羰基基团,氨基含量减少[35]。超声对蛋白二、三级结构的破坏作用促进了二硫键断裂,使SH基团暴露于蛋白质的表面,即SH含量增加。而随着超声功率的增大,二硫键断裂含量减少,SS转化为SH,游离氨基和游离巯基含量增多[36]。随着超声功率的进一步增大,燕麦蛋白质变性伸展,疏水性区域[37]和游离氨基暴露,疏水相互作用的增大促使蛋白发生聚集,二硫键含量增多,游离氨基含量和游离巯基减少。超声可调控分子间的聚合与解聚,改变氨基和巯基含量,进而影响蛋白的功能特性。

表2 官能团含量分布Table 2 Distribution of functional groups
2.5 可溶性超声燕麦蛋白氧化聚集体的十二烷基磺酸钠聚丙烯酰胺凝胶电泳分析
超声处理对可溶性氧化燕麦蛋白的十二烷基磺酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)图谱如图7所示,其中泳道1为标准分子量。通过凝胶成像分析仪分析SDS-PAGE图谱,发现与SOAP相比,SOOAP中7 S蛋白的α亚基和11 S蛋白的A亚基的特征条带的强度明显减弱;与SOOAP相比,氧化的燕麦蛋白经过超声处理后,随着超声功率的增大(100~500 W),7 S蛋白的α′亚基、β亚基含量和11 S蛋白的B碱性亚基含量逐渐增加,而当超声功率为600 W时蛋白因氧化导致的7 S蛋白的α亚基和11 S蛋白的A亚基的特征条带明显减弱现象有所改善,且7 S蛋白的α′亚基、β亚基和11 S蛋白的B亚基条带密度明显增加。研究表明,在氧化过程中β-伴球蛋白和球蛋白会受到AAPH的侵害,导致亚基特征条带的强度减弱[38];而随着超声功率的增加,蛋白亚基含量升高是因为超声处理产生的空穴效应使二硫键断裂,蛋白分子的空间结构被破坏,亚基被解聚,含量增加。当超声功率过高时,因超声作用被解聚的亚基又重新聚合,进而影响蛋白的结构特性[18,39]。
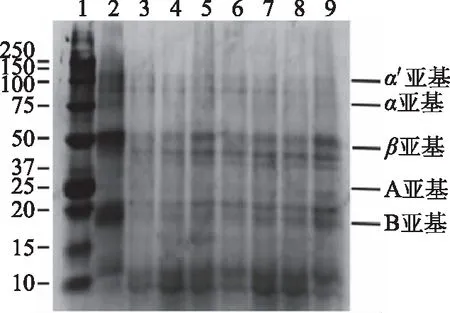
图7 超声处理对可溶性氧化燕麦蛋白的SDS-PAGE电泳图谱Fig.7 SDS-PAGE electropherogram ofsolubilized oxidized oat protein by sonication注:从1~9泳道依次对应为Marker、SOAP、SOOAP、U-100 W-SOOAP、U-200 W-SOOAP、U-300 W-SOOAP、U-400 W-SOOAP、U-500 W-SOOAP和U-600 W-SOOAP。
2.6 可溶性超声燕麦蛋白氧化聚集体的溶解度
如图8示,与SOAP相比,蛋白经过氧化后,其溶解度减小。与SOOAP相比,氧化燕麦蛋白经过超声处理后,随着超声功率的增大,溶解度呈现先增大后减小的趋势,且在超声功率为500 W时溶解性最大,提高了2.3%,当超声功率为600 W时溶解度减小。AAPH氧化诱导下蛋白质结构逐渐解折叠,氧化蛋白的共价和非共价交联相互作用弱化,暴露出更多的疏水基团,当疏水相互作用超出某一临界值,促进了蛋白聚集,产生不溶性聚集体,降低了蛋白的溶解度[40]。已有研究表明,超声处理可提高蛋白溶解度[41],且随着超声功率的增大而溶解度增大。但当超声功率为600 W时,超声促使蛋白发生聚集,溶解度减小[42]。

图8 蛋白溶解度图Fig.8 Protein solubility map
2.7 可溶性超声燕麦蛋白氧化聚集体的乳化性和乳化稳定性
当蛋白质吸附于乳液的油水界面形成界面层,其乳化能力取决于分子结构特征和物理化学性质,包括构象稳定性、溶解度和疏水性等[43-44]。如图9所示,与SOAP相比,SOOAP的乳化性和乳化稳定性降低。与SOOAP相比,燕麦氧化蛋白随着超声功率的增大,乳化性和乳化稳定性呈现先增大后减小的趋势,乳化性在超声功率为500 W时达到最大,提高了207.95 m2/g;乳化稳定性在超声功率为400 W时达到最大,提高了361.48 m2/g。

图9 乳化特性图Fig.9 Emulsification characteristics map
AAPH氧化诱导的蛋白随着蛋白结构的展开,其疏水相互作用逐渐增大,促进蛋白聚集,疏水性基团被重新掩埋,表面疏水性和溶解性降低,导致蛋白的乳化性和乳化稳定性降低。研究发现,超声产生的空化效应和剪切力可破坏蛋白聚集体结构,改变颗粒尺寸,影响尺寸分布以及颗粒形状,进而改变蛋白的功能[10]。随着超声功率的增大,维持蛋白质空间结构稳定性的非共价键被超声造成的空化作用力破坏,蛋白质的疏水基团暴露,更多蛋白质分子扩散到水油界面,提高了蛋白的乳化特性[45]。但随着超声功率进一步增大,小分子蛋白吸附在界面上时易被大分子蛋白代替,导致乳化性和乳化稳定性降低[46]。
3 结论
与SOAP相比,氧化处理后的SOOAP平均粒径、浊度、表面疏水性和二硫键含量显著上升(P<0.05),蛋白质的有序结构增多,亚基含量增加,溶解度、乳化性和乳化稳定性显著降低(P<0.05)。这表明氧化可以通过改变燕麦蛋白的空间构象和聚集形态,降低其功能特性。500 W的超声处理,可以明显降低SOOAP的平均粒径、PDI和浊度,增大表面疏水性和ζ电位,并促使蛋白质有序结构往无序结构转变,聚合后的亚基因超声作用重新解聚,含量增加,进而提高其溶解性、乳化性和乳化稳定性。当功率超过500 W时,超声促使蛋白质发生重新聚集。这表明超声(500 W)能通过改变氧化后燕麦蛋白的分子间作用力,调控其空间构象和聚集形态,进而改善其功能特性。
