脑室周围白质软化症合并脑瘫患儿的磁共振征象与智能的相关性分析
2020-06-15黄婷婷吴云虎王道清
黄婷婷 张 岚 王 飞 邢 威 吴云虎 王道清△
1)河南中医药大学第一附属医院,河南 郑州 450000 2)郑州市第二人民医院,河南 郑州 450004
脑室周围白质软化症(periventricular leukomalacia,PVL)是脑性瘫痪(cerebral palsy,CP)的主要原因[1-2]。是CP的独立危险因子[3]。CP导致儿童严重的肢体残疾[4],已成为重要的临床和社会问题,全球CP的患病率为1‰~5‰,我国CP发病率为1.8‰~4‰[5-8]。CP不仅引起运动障碍,同时常伴有智力缺陷、癫痫、行为异常、精神障碍及视听觉、语言障碍[9]。研究表明[10],智能障碍不仅影响运动功能及康复治疗,而且会影响患儿融入社会,影响其整个人生。已有学者研究发现儿童神经突触网络及白质通路网络的构建会一直持续到青春期,因此发育中的大脑在损伤后的自我修复能力远远高于成人大脑[11]。MRI有助于早期分析脑瘫病因及进行预后的判定[12-14,4]。本研究旨在对PVL合并CP患儿的颅脑磁共振征象与智能障碍进行相关性分析,以探讨CP患儿颅脑结构损伤与功能之间的关系。
1 资料与方法
1.1一般资料连续的纳入2013-10—2019-07于河南中医药大学第一附属医院诊治的PVL合并CP患儿共45例,男27例,女18例,年龄6个月~6岁,年龄(28.24±27.14)个月。纳入标准:(1)经常规颅脑MRI诊断为PVL[2];(2)年龄6个月~6岁,符合脑瘫诊断标准[15];(3)临床资料及磁共振图像完整。排除标准:(1)神经肌肉源性疾病所导致的周围性瘫痪和进行性加重的中枢性瘫痪;(2)经相关检查除外遗传代谢性疾病、感染或外伤等导致运动障碍的疾病;(3)合并颅内感染、出血。本研究经医院医学伦理委员会审核通过,因是回顾性研究,均免除签署知情同意书。
1.2方法
1.2.1 检查方法:使用飞利浦 Ingenia 3.0T磁共振扫描仪,头颅8通道线圈。为保护患儿听力,给予患儿3M耳塞,将患儿头部两侧用海绵固定于线圈中。对于不能配合的患儿,口服/灌肠10%的水合氯醛(0.5 mL/kg,最大剂量为10 mL),待熟睡后进行MR检查。扫描序列及参数如下:T1WI(TR 2 000 ms,TE 20 ms,层厚5 mm,层间距0 mm,FOV 220 mm×220 mm,矩阵 260×260);轴位T2WI(TR 2 104 ms,TE 80 ms,层厚5 mm,层间隔0 mm,FOV 220 mm×220 mm,矩阵256×256);轴位T2FLAIR(TR11 000 ms,TE 120 ms,层厚5 mm,层间隔0 mm,FOV 220 mm×220 mm,矩阵320×320);矢状位T2WI(TR 2 500 ms,TE 80 ms,层厚5 mm,层间隔0 mm,FOV 220 mm×220 mm,矩阵384×384)。
1.2.2 MR征象的评价:参考PVL分级[16]系统及最新欧洲小儿脑瘫监测组织(Surveillance of Cerebral Palsy in Europe,SCPE)[17]发布的灰质损伤分级系统,将MRI征象分为7个项目进行评价:白质异常高信号,白质体积减少,白质囊变,侧脑室扩张,侧脑室壁不整,胼胝体变薄,灰质异常高信号。
评估前,首先对参与评估的人员进行相关知识和文献的培训,由1名具有8 a儿科影像诊断经验的高年资医师及1名具有4 a影像诊断经验的低年资医师分别对所有病例图像进行单独评价,对于意见不一致者,两者通过协商确定最终结果,其最终的结果用来计算观察者间的一致性。2周后,高年资医师再次对所有患儿图像进行评价,其前后两次的评估结果用来计算观察者内部的一致性。评价均在同一台工作站上完成,2 次评价均不提供受试者年龄、性别等相关临床信息。
1.3神经学评价在MRI 检查前后1周内,由2名儿科康复评估医师分别对患儿进行粗大运动功能及Gesell智能评估。粗大运动功能分级系统(Gross Motor Function Classification System,GMFCS)用来评估CP的严重程度,参照粗大运动功能分级系统按照不同年龄组(<2岁、2~<4岁、4~<6岁)分为Ⅰ~Ⅴ级。智能发育采取Gesell发育量表,该测试适合于0~6岁的儿童,可客观反映正常小儿的神经运动和精神心理发育规律,其中包括个人~社交行为、适应性行为、精细动作、大运动、语言 5 个项目,根据患儿的发育情况及年龄进行计算发育商(Developmental quotient,DQ)。智能发育评定标准:DQ≥85为正常,异常分为 5 级,边缘(75~85)、轻度(56~75)、中度(41~55)、重度(25~40)、极重度(<25)。

2 结果
2.1 MR征象评价的一致性及可重复性分析高低年资医师第1次MRI征象评估的Kappa值最小为 0.81;高年资医师前后2次的Kappa 值最小为0.92;组内及组间的一致性较好,说明MRI征象的可重复性较好,可以用来进行下一步分析。
2.2 CP分型与智能障碍分级的相关性分析排除7例不能确定分型的CP,纳入39例患儿,结果显示CP的分型与智能障碍具有明显相关性(P<0.05)。见表1。
2.3 GMFCS与智能障碍分级的相关性分析结果显示GMFCS与智能障碍呈正相关(P<0.05),GMFCS分级越高代表CP的程度越严重,则智能障碍越严重。见表2。
2.4磁共振征象与智能障碍分级的相关性分析CP患儿MR征象中,体部白质异常高信号,半卵圆中心白质体积减少,中央皮质异常高信号与智能障碍相关(P<0.05)。(见表4,图1~3)。

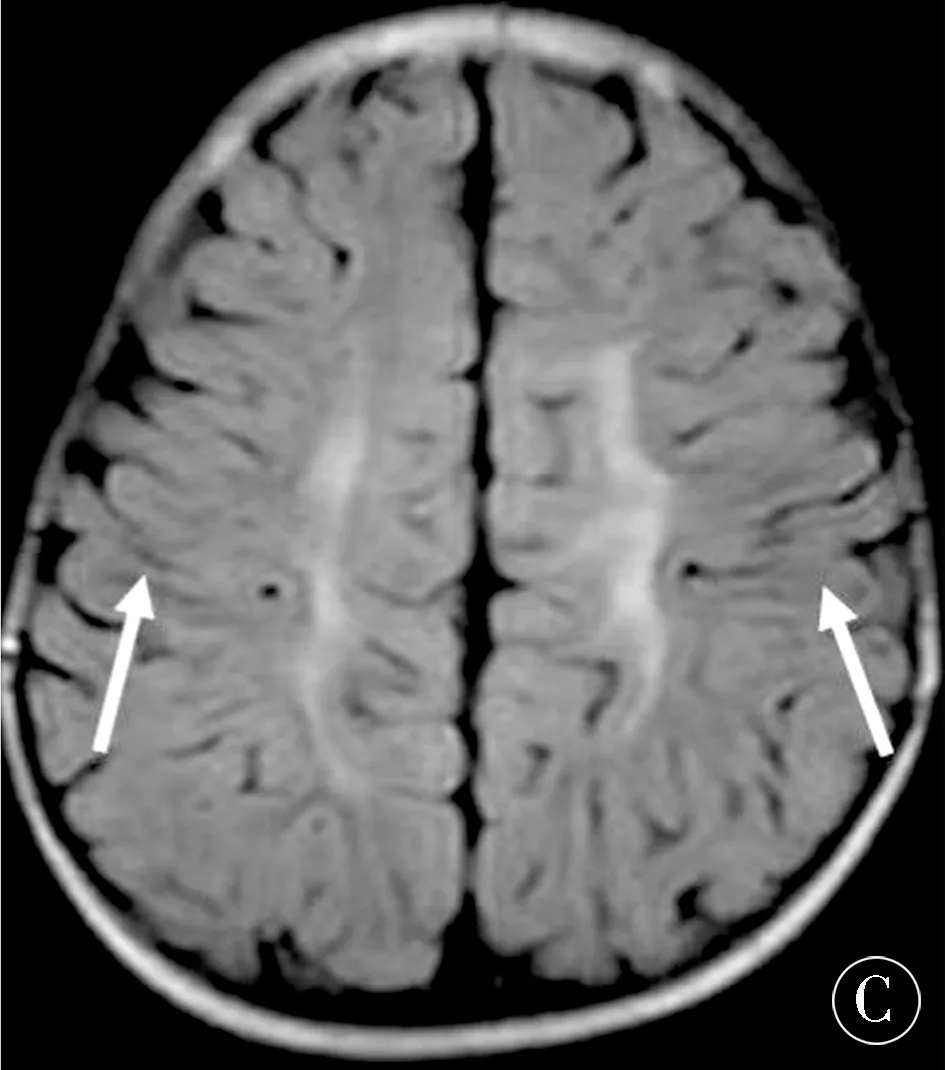
图1 痉挛型双瘫,DQ=56.1,轻度智能障碍。A(T2WI):双侧侧脑室体部旁可见斑片状高信号病灶(白箭);B(T2WI):双侧半卵圆中心白质损伤,白质体积轻度减少(白箭);C(T2FLAIR):双侧中央皮质信号正常(白箭)Figure 1 Spastic diplegia,DQ = 56.1,mild intellectual dysfunction.A(T2WI):Patchy hyperintense in bilateral body part of lateral ventricles (white arrow);B (T2WI):The white matter in centrum semiovale injuried and white matter volume mild reduction (white arrow);C (T2FLAIR):Normal signal in bilateral central cortex (white arrow)

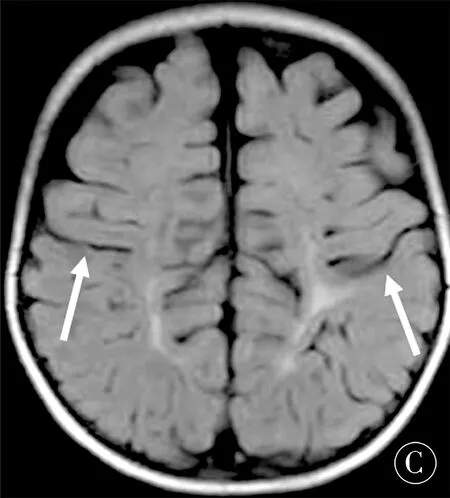
图2 痉挛型双瘫,DQ=41.4,中度智能障碍。A(T2WI):双侧侧脑室体部旁可见弥漫高信号病灶(白箭);B(T2WI):双侧半卵圆中心白质损伤并白质体积显著减少(白箭);C(T2FLAIR):双侧中央皮质信号正常(白箭)Figure 2 Spastic diplegia,DQ = 41.4,moderate intellectual dysfunction.A(T2WI):Diffuse hyperintense lesions in bilateral body part of lateral ventricles (white arrow);B (T2WI):The white matter in centrum semiovale injuried and white matter volume reduced significantly (white arrow);C (T2FLAIR):Normal signal in bilateral central cortex (white arrow)
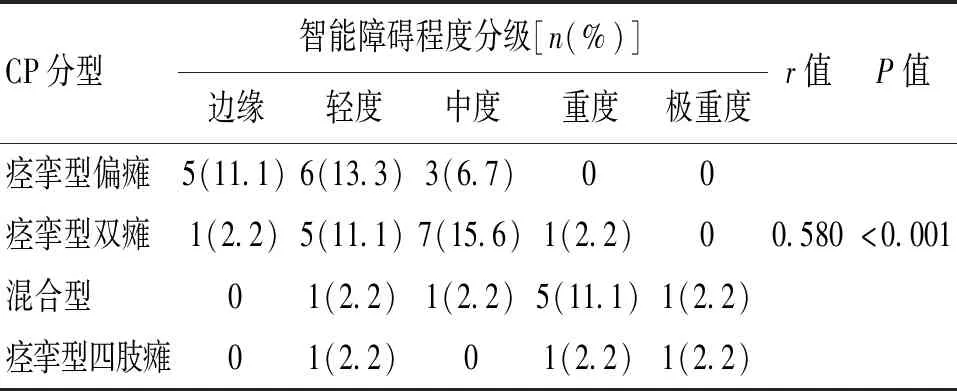
表1 CP分型与智能障碍分级的相关性分析Table 1 Correlation analysis between CP typing and the classification of intellectual impairment
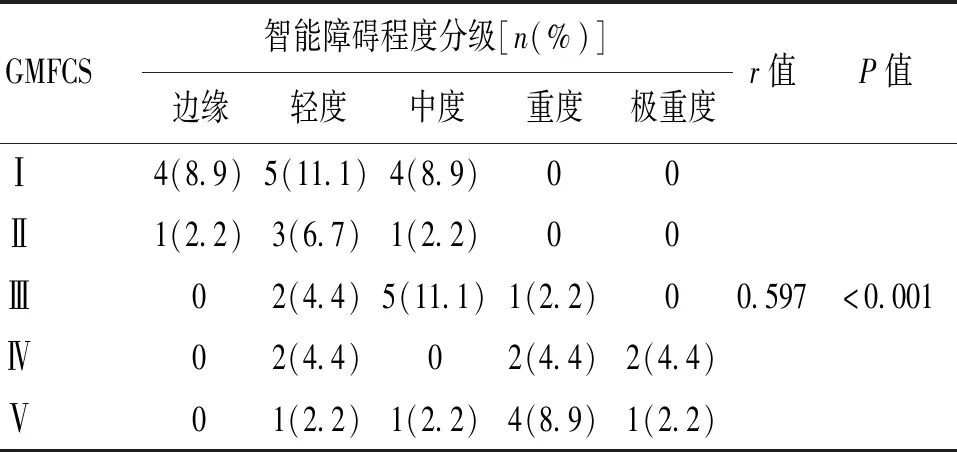
表2 GMFCS与智能的相关性分析Table 2 Correlation analysis between GMFCS and the classification of intellectual impairment
注:GMFCS:Gross Motor Function Classification System,粗大运动功能分级系统

表3 临床基线资料、磁共振征象与智能障碍分级的相关性分析Table 3 Correlation between clinical baseline data,MRI signs and classification of intellectual dysfunction
注:“—”代表无
3 讨论
PVL在MRI上显示为脑室周围白质区域的条带状T1WI中低信号,T2WI和T2Flair高信号病灶,主要由于患儿脑组织缺血缺氧及终末动脉侧支循环尚未建立,引起脑组织瘢痕、胶质增生,髓鞘化延迟和白质液化,最终导致脑室周围白质坏死[18]。PVL主要引起痉挛型CP,与CP患儿的智力障碍、肢体功能障碍有关。研究发现[19],人类大脑快速动态发展的关键时期主要在2岁之前,尤其是生后8个月内[20]。在此期间,大脑处于高速生长和发育的状态,皮层增厚、树突增多,白质的髓鞘化范围不断扩大,各部分的脑功能处于不断的协调发展之中,这一时期脑的可塑性及恢复能力较好,一些神经细胞能代替邻近受损细胞的功能,轴突绕道投射及树突出现不寻常分叉,形成新的功能通路;同时脑的某些区域在出生以后还能再生新神经细胞(如小脑外颗粒层)进行受损细胞的自我修复。过去CP被认为无法治愈,但近期研究结果表明[21],如能早期诊断、早期治疗,除极严重者外,大部分均可正常化。


图3 痉挛型左侧偏瘫,DQ=21.4,极重度智能障碍。A(T2WI):双侧侧脑室体部旁可见弥漫高信号病灶(白箭);B(T2WI):右侧半卵圆中心白质几乎消失;C(T2FLAIR):右侧中央皮质异常条状高信号(白箭)Figure 3 Spastic left hemiplegia,extremely severe intellectual dysfunction.A(T2WI):Diffuse hyperintense lesions in bilateral body part of lateral ventricles (white arrow);B (T2WI):The white matter in right centrum semiovale area almost disappeared (white arrow);C (T 2FLAIR):Abnormal strip hyperintense in right central cortex (white arrow)
本研究发现CP的分型与智能障碍的程度呈正相关,痉挛型偏瘫多为边缘~轻度智能障碍,双瘫多为轻~中度智能障碍,而混合型及四肢瘫则多为重度~极重度,与之前的研究结果一致[22]。本研究同时还发现CP患儿的GMFCS与智能障碍程度正相关,即CP的运动障碍程度越重,伴随的智力问题越严重。
前期的研究表明[23-24,2],CP的智能障碍程度与PVL的分级呈正相关,即分级越高,智能障碍越严重,但部分PVLⅠ~Ⅱ级的CP患儿也会出现严重的智力障碍,我们的研究发现CP患儿智能障碍不仅与PVL损伤程度相关,可能更与病变的部位有关。侧脑室体部及半卵圆中心区域是PVL损伤的主要区域,当胎儿发育到24~34周时脑室周围白质对缺血缺氧比较敏感[25],如果此时发生早产、宫内缺氧、感染等干扰因素时此区域最先受到攻击,会阻断少突胶质细胞前体的移行过程及白质的髓鞘化进程,导致神经纤维数量减少及投射中断,神经连接异常和神经信息的传导通路受影响从而引起智能缺陷[26]。因此,侧脑室体部白质损伤及半卵圆中心白质体积的减少均与智能障碍正相关;而当胎脑发育成熟后即越接近足月时,此时出现大脑缺血缺氧或者比较严重的缺血缺氧,大脑就会广泛的受损,波及皮层及皮层下神经元发生变性坏死,神经细胞数量减少[6],对脑的进一步发育造成威胁,直接影响到发育中脑组织的功能与分化,对认知功能产生影响[27-28]。SARAH等[29]的研究也认为智能障碍与潜在的皮质及皮质下白质损伤有关,本研究结果与其一致。另外,之前的研究发现胼胝体变薄,尤其是压部的变薄与智力低下有关,与本研究结果不一致,可能由于病例数较少的原因。
本研究为单中心、回顾性研究,样本量偏少,目前尚处于研究初期,在今后的研究中还将纳入更多病例;此外,部分脑组织精细结构的异常在 2 岁之后MRI才有所体现,所以应系统规范的随访至学龄早期甚至更长的时间,才能更为客观地诠释PVL合并CP患儿颅脑结构与功能的关系。
