线粒体活性氧在心肌成纤维细胞NLRP3炎症小体激活中的作用
2020-06-11颜骏张浩王好陶艾彬姚永伟张国辉芮涛
颜骏, 张浩, 王好, 陶艾彬, 姚永伟, 张国辉, 芮涛
(江苏大学附属人民医院心内科, 江苏 镇江 212002)
临床上脓毒症并发心功能障碍的发病率高且死亡率高[1]。但是脓毒症引起心功能损伤的机制尚不清楚,也欠缺有效的针对性治疗。
有文献报道,白介素(IL)-1β与脓毒症心肌功能损伤相关[2],IL-1β的生成和调控与炎症小体相关。炎症小体是一类存在于细胞质中的蛋白复合体,能识别细胞内病原相关分子模式(PAMPs)或损伤相关分子模式(DAMPs)等,通过介导IL-1β和IL-18的生成,调控炎症相关基因表达等方式产生各种生物学效应[3-4]。核苷酸结合寡聚化结构域样受体蛋白3(NLRP3)炎症小体可对多种物理、化学刺激做出反应,如活性氧(ROS)、外源性三磷酸腺苷(ATP)等[5-6]。NLRP3炎症小体由NLRP3、凋亡相关斑点样蛋白(apoptosis associated speck-like protein containing a CARD,ASC)和caspase-1前体组成。NLRP3小体有多种活化途径,经典的为双信号途径,分为引发和激活两个阶段。引发阶段胞质内的NLRP3和IL-1β前体的合成增多,激活阶段通过活化的caspase-1进一步生成IL-1β和IL-18,发挥生物学作用[7]。
目前影响NLRP3炎症小体激活的因素尚未完全明确。我们之前的研究显示,使用脂多糖刺激6 h,可使心肌成纤维细胞内NLRP3、pro-IL-1蛋白合成增多,再使用ATP刺激30 min,可激活NLRP3炎症小体,产生IL-1β和IL-18。并通过“细胞交互作用”与高迁移率族蛋白B1联合作用,引起心肌细胞收缩功能减弱[8]。本研究使用线粒体活性氧(mtROS)靶向清除剂mito-TEMPO减少炎症小体激活阶段心肌成纤维细胞胞内mtROS的表达,探讨mtROS在心肌成纤维细胞NLRP3炎症小体激活中的作用及机制。
1 材料与方法
1.1 材料与试剂
C57BL/6小鼠购自江苏大学实验动物中心,动物合格证号SCXK(苏)2013—0011。IL-1β鼠抗体、NLRP3兔抗体、ASC兔抗体、脂多糖、ATP(Cell Signaling Technology公司);caspase-1鼠抗体(Novus Biologicals公司);兔多克隆β-肌动蛋白抗体、羊抗兔IgG抗体(英国Abcam公司);羊抗鼠IgG抗体(美国Bio-world公司); mito-TEMPO、Hoechst 33342、胶原酶、中性蛋白酶(美国Sigma-Aldrich公司);培养基DMEM/F12(维森特生物技术有限公司);胎牛血清(ExCell Bio公司);测定IL-1β的酶联免疫吸附(ELISA)试剂盒(美国RδD Systems公司);MitoSOX(美国Thermo Fisher公司);细胞裂解液、蛋白A/G琼脂糖珠、蛋白酶抑制剂混合物、BCA蛋白浓度测定试剂盒(江苏碧云天生物技术有限公司);其他试剂都为化学分析纯。
1.2 小鼠成纤维细胞的分离和培养
取3~4周雌雄不限的C57BL/6小鼠6只,以断颈法处死,于超净工作台在无菌条件下取出心脏,将心脏在冷D-Hanks液中切割为约1 mm3的组织小块后,浸没于胶原酶(0.002 g/mL)和中性蛋白酶(0.001 g/mL)中,在37 ℃、5%CO2培养箱缓慢振荡45 min,取上清液1 500 r/min离心5 min,去除上清液后加入含10%胎牛血清的DMEM到培养皿中。如此反复2~3次,收集所得细胞置于37 ℃、5%CO2培养箱中,3 h后去除未贴壁细胞悬液,剩余贴壁细胞每日更换培养基,显微镜下观察细胞生长状态,培养72 h可用于实验[9]。
1.3 实验分组
取培养的心肌成纤维细胞分为4组处理。引发组:加入含0.001 ng/L脂多糖的培养基处理6.5 h;激活组:先加入含0.001 ng/L脂多糖的培养基,6 h后加入3 mmol/L的 ATP,继续培养0.5 h[10];干预组:先加入含0.001 ng/L脂多糖的培养基,5.5 h后加入25 μmol/L的mito-TEMPO[11],0.5 h后再加入3 mmol/L的ATP,维持0.5 h;对照组:加入常规培养基6.5 h后,添加与干预组试剂等量的D-Hanks液。
1.4 MitoSOX染色观察小鼠心肌成纤维细胞mtROS表达
将处理好的各组心肌成纤维细胞去除培养基后,使用D-Hanks液洗涤3次,加入5 μmol/L的MitoSOX,37 ℃避光孵育10 min[12],去除染液并再次清洗后,加入0.001 μg/L的Hoechst 33342染液37 ℃避光孵育10 min,去除染液并再次清洗后在荧光显微镜(Zeiss LSM880, 美国)下观察、拍照。胞质中mtROS呈红色,细胞核呈蓝色,每组观察10个细胞,通过Image J软件分析荧光强度数值后取平均值,重复3次。
1.5 蛋白质印迹法检测细胞Pro-IL-1β、ASC、NLRP3、Pro-caspase-1蛋白表达
收集4组细胞提取蛋白,取10 μL样品由10%SDS-PAGE电泳转移到PVDF膜上。5%的脱脂奶粉室温封闭1 h,分别使用一抗IL-1β(1 ∶1 000)、ASC(1 ∶1 000)、NLRP3(1 ∶1 000)、caspase-1(1 ∶1 000)、β-肌动蛋白(1 ∶1 000)4 ℃孵育过夜,二抗羊抗兔IgG抗体(1 ∶5 000)、羊抗鼠IgG抗体(1 ∶5 000)室温孵育2 h。Bio-Rad曝光仪摄像,以β-肌动蛋白作为内参,Image J软件分析灰度值。
1.6 蛋白质印迹法检测细胞上清液中IL-1β和caspase-1 p20蛋白表达
分别收集4组细胞上清液,将上清液与无水甲醇、氯仿混合,4 ℃以15 000×g离心15 min,去除上清液,加入无水甲醇800 μL,再4 ℃以15 000×g离心15 min,去除上清液后得到所需提取蛋白。所提取蛋白通过蛋白印迹法分别检测caspase-1 p20、IL-1β蛋白表达。
1.7 ELISA法检测小鼠心肌成纤维细胞上清液中IL-1β蛋白含量
将4组细胞上清液各50 μL加入微孔板室温孵育2 h,洗涤后加入100 μL酶标检测抗体室温孵育2 h,再次洗涤后加入显色剂混合物100 μL室温孵育30 min。加入终止液100 μL,30 min内使用酶标检测仪测量450 nm的光密度值,设置540 nm作为校正波长。根据标准曲线计算出各组标本中IL-1β蛋白含量。
1.8 免疫共沉淀法检测与ASC结合的NLRP3及Pro-caspase-1蛋白的表达
心肌成纤维细胞用混合有蛋白酶抑制剂混合物的裂解缓冲液裂解后,15 000×g,4 ℃离心15 min,收集上清液。将蛋白A/G琼脂糖珠与上清液混合,4 ℃摇晃20 min;再以4 ℃,12 000 r/min离心15 min,所得上清液用BCA蛋白浓度测定试剂盒测定蛋白质浓度。将兔抗ASC单克隆抗体(31 μg)加入到含500 μg总蛋白的上清液中,将所得混合物在4 ℃以4 000×g离心5 min,去上清液,将上样缓冲液加入到琼脂糖珠-抗原抗体复合物中。将混合物煮5 min,取上清液行SDS-PAGE并转移至PVDF膜,并用针对小鼠ASC、NLRP3和Pro-caspase-1蛋白的抗体进行蛋白质印迹。
1.9 统计分析

2 结果
2.1 各组小鼠心肌成纤维细胞mtROS比较
如图1所示,小鼠心肌成纤维细胞受脂多糖和ATP刺激后,mtROS水平较对照组明显增加(P<0.05);使用mito-TEMPO干预后,mtROS水平较激活组明显下降(P<0.05),但仍明显高于对照组(P<0.05)。
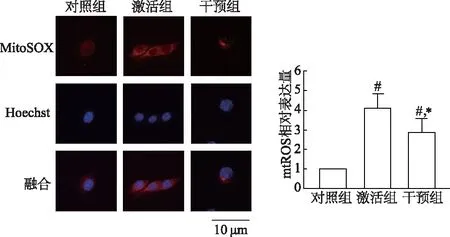
n=3; #:P<0.05,与对照组比较;*:P<0.05,与激活组比较图1 mitoSOX染色观察小鼠心肌成纤维细胞mtROS水平
2.2 各组心肌成纤维细胞NLRP3炎症小体相关蛋白的表达
如图2所示,心肌成纤维细胞经脂多糖刺激后,细胞内NLRP3和Pro-IL-1β蛋白较对照组明显升高(P<0.05),而Pro-caspase-1、ASC的表达无明显变化;经ATP激活和mito-TEMPO干预后,干预组中Pro-IL-1β较激活组升高(P<0.05)。
使用ATP激活NLRP3炎症小体,上清液中caspase-1 p20和IL-1β较对照组明显升高(P<0.05),而干预组使用mito-TEMPO降低mtROS后使caspase-1 p20和IL-1β较激活组明显减少(P<0.05)。ELISA检测结果显示,激活组上清液中IL-1β含量较对照组明显升高(P<0.05),干预组上清液中IL-1β含量较激活组明显减少(P<0.05)。见图3。
2.3 各组心肌成纤维细胞中NLRP3、Pro-caspase-1与ASC结合情况
免疫共沉淀法检测可见,经脂多糖和ATP刺激后,心肌成纤维细胞中NLRP3-ASC连接形成复合体,干预组NLRP3和ASC的结合减少。而Pro-caspase-1蛋白不受影响。见图4。
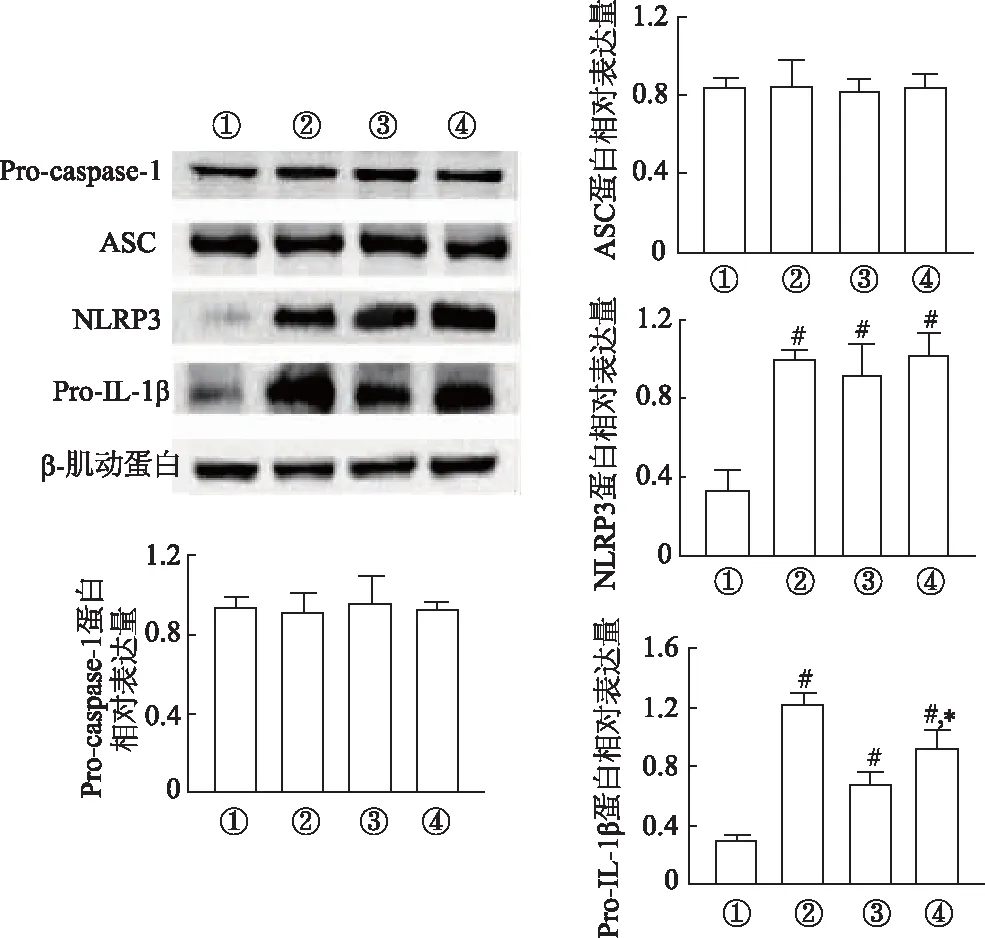
① 对照组; ② 引发组; ③ 激活组; ④ 干预组n=3; #:P<0.05,与对照组比较;*:P<0.05,与激活组比较图2 各组心肌成纤维细胞胞内NLRP3炎症小体相关蛋白的表达

① 对照组; ② 引发组; ③ 激活组; ④ 干预组n=3; #:P<0.05,与对照组比较;*:P<0.05,与激活组比较图3 各组心肌成纤维细胞上清液中NLRP3炎症小体相关蛋白的表达
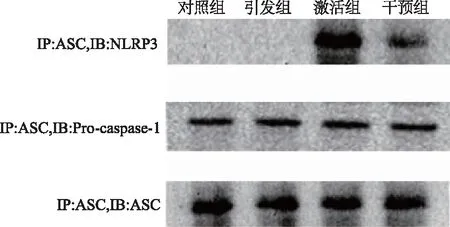
图4 免疫共沉淀法检测各组心肌成纤维细胞NLRP3和ASC的结合
3 讨论
IL-1β的生成增加是脓毒症引发心肌收缩力下降和脓毒症休克的重要因素[13],IL-1β的生成、成熟、分泌受NLRP3炎症小体激活的调节[14]。我们之前的研究发现,脓毒症可导致心肌成纤维细胞中NLRP3炎症小体的激活[8, 10],来自心肌成纤维细胞的IL-1β经心肌成纤维细胞-心肌细胞相互作用,引起脓毒症诱导的心肌细胞凋亡和心肌功能障碍。在本研究中,我们进一步发现脂多糖可引起心肌成纤维细胞中mtROS生成增加,mtROS增加又通过促进细胞内NLRP3和ASC蛋白的结合激活NLRP3炎症小体,而通过减少激活阶段的mtROS可抑制NLRP3炎症小体的激活和心肌成纤维细胞分泌IL-1β。
NLRP3炎症小体为细胞内的多蛋白平台,其激活经引发和激活两个阶段。在引发阶段,刺激因素通过NF-κB途径,增加了细胞内Pro-IL-1β和NLRP3蛋白水平,但并不会影响ASC和Pro-caspase-1的细胞内水平。而激活阶段,刺激物引发NLRP3蛋白的NACHT结构域发生自身寡聚化,从而连接蛋白ASC与Pro-caspase-1,引发相互作用。NLRP3炎症小体复合物通过切割Pro-caspase-1使其活化,活化的caspase-1再将Pro-IL-1β和Pro-IL-18切割,引起IL-1β和IL-18成熟和释放[7]。我们的研究结果表明,在脓毒症中mtROS在NLRP3炎症小体激活中起到关键作用,其通过促进NLRP3蛋白和ASC蛋白的结合引发NLRP3炎症小体的激活。而在激活阶段使用mito-TEMPO可有效降低细胞内mtROS的含量,从而可进一步抑制炎症小体的激活。
但本研究尚不能确定mtROS是通过何种方式来促进NLRP3-ASC蛋白连接,或是否存在其他途径促进心肌成纤维细胞NLRP3炎症小体激活。本研究结果表明mtROS在心肌成纤维细胞NLRP3炎症小体激活中起到重要作用,可能是治疗脓毒症诱发的心肌功能障碍的潜在靶点。
