分泌型cGMP依赖性蛋白激酶Ⅱ对胃癌细胞增殖相关基因表达的调控
2020-06-11李帼瑞庞吉钱海吴燕陈永昌
李帼瑞, 庞吉, 钱海, 吴燕, 陈永昌
(江苏大学医学院, 江苏 镇江 212013)
蛋白质磷酸化是最常见的蛋白翻译后修饰之一[1]。多数蛋白质磷酸化发生在胞内,由分布在细胞内的蛋白激酶催化完成。但是,细胞外的蛋白质也有磷酸化的现象,早在1883年,就已发现细胞外蛋白质酪蛋白的磷酸化,但引起其磷酸化的蛋白激酶一直未找到[2]。直到130年后,Tagliabracci发现Fam20C作为一种分泌型蛋白激酶在起作用[2-3]。自此,分泌型蛋白激酶引起人们高度重视,陆续发现VLK、c-Src酪氨酸激酶等多种分泌型蛋白激酶[4-6]。研究发现,cGMP依赖性蛋白激酶Ⅱ(type Ⅱ cGMP-dependent protein kinase,PKG Ⅱ)也是一种分泌型蛋白激酶[7]。但是,分泌到胞外的PKG Ⅱ对细胞的作用及机制尚不明确。 为此,本研究采用重组蛋白PKG Ⅱ在细胞外直接作用于胃癌细胞的方式来模拟分泌型蛋白的作用模式,并利用转录组测序分析进行初步筛选, 结合实时荧光定量PCR(quantitative real-time PCR, qRT-PCR)和蛋白质免疫印迹进行进一步验证,初步探索分泌型PKG Ⅱ对人胃癌HGC-27和AGS细胞株基因表达的影响。
1 材料与方法
1.1 材料
1.1.1 细胞株和试剂 人胃癌HGC-27和AGS细胞株购自中国科学院上海细胞库。胎牛血清(美国Excell公司);RPMI-1640培养液,二甲基亚砜,焦碳酸二乙酯均为美国Hyclone公司产品;F12K培养液(加拿大Wisent公司);人谷胱甘肽转移酶(GST)-PKG Ⅱ融合蛋白(加拿大Signalchem公司);8-pCPT-cGMP(美国Biolog公司);Trizol试剂(美国Invitrogen公司);逆转录试剂盒,qRT-PCR试剂盒均购自南京诺唯赞生物科技有限公司;β-巯基乙醇(美国Sigma公司);蛋白质标准参照物(美国Thermo Fisher公司);抗人表皮生长因子(EGF)前体多克隆抗体(美国Novus公司);β-肌动蛋白抗体(美国Santa Cruz公司);HRP标记的羊抗兔多克隆抗体(美国Jackson公司);ECL发光液(美国Millipore公司)。
1.1.2 主要仪器 超净工作台(苏州净化设备有限公司);细胞培养箱,高速冷冻离心机,普通PCR仪均为美国Thermo Fisher公司产品;倒置显微镜(德国Zeiss公司);恒温水浴锅(上海福玛实验设备有限公司);超微量蛋白核酸分析仪(北京美林恒通仪器有限公司);超声波细胞破碎仪(美国Emerson公司);实时荧光定量PCR仪,蛋白电泳仪均为美国Bio-Rad公司产品;干式恒温器(北京百晶生物技术有限公司);凝胶成像及分析系统(北京赛智公司)。
1.2 方法
1.2.1 细胞培养 人胃癌HGC-27细胞株培养于含10%胎牛血清的RPMI-1640培养液中,AGS细胞培养于含10%胎牛血清的F12K培养液中,置37℃、5%CO2培养箱中培养。
1.2.2 总RNA抽提及逆转录 采用Trizol法提取总RNA,用超微量蛋白核酸分析仪对得到的样品进行浓度及纯度鉴定。将D(260 nm)/D(280 nm)在1.8~2.0之间的样品逆转录为cDNA,立即进行后续研究或置于-20℃保存备用。
1.2.3 转录组测序分析 转录组测序广泛应用于各个物种基因差异表达的研究,现有的商业化深度测序技术中Illumina HiSeq 2000具有高输出量和低成本的优势,是目前应用最为广泛的测序平台之一[8-9]。对使用谷胱甘肽硫转移酶标签在杆状病毒Sf 9昆虫细胞中表达的重组全长人PKG Ⅱ(GST-PKG Ⅱ, 100 μg/L)处理前、后的胃癌AGS细胞株转录组进行测序:加药4 h后提取细胞中总RNA,行质量检测,采用Illumina HiSeq 2000高通量测序平台对浓度、纯度和完整性符合测序质量要求的样品进行转录组测序。该部分实验交由南京集思慧远生物科技有限公司完成。将整理后的转录本通过基于局部对比算法的搜索工具(BLAST)BLASTn及BLASTx程序与蛋白相邻类的聚簇(COG)、基因本体(Gene Ontology, GO)、京都基因与基因组百科全书(KEGG)、真核生物蛋白相邻类的聚簇(KOG)、Pfam、Swiss-prot和NR非冗余蛋白序列数据库等7个公共数据库对比。以FDR≤0.05、│log2(FPKMGST-PKG II组/FPKM对照组) │>1为条件筛选出表达差异≥2倍的基因,再从中筛选出部分与增殖相关的基因进行验证。
1.2.4 qRT-PCR验证重组PKG Ⅱ对筛选出的增殖相关基因mRNA水平的影响 将汇合度达70%左右的HGC-27和AGS细胞消化后接种于6孔板,分为2组:对照组和GST-PKG Ⅱ (100 μg/L)+ 8-pCPT-cGMP(250 μmol/L)组。待细胞汇合度达到70%时,换无血清培养液饥饿处理8~12 h;弃上清液,无菌PBS清洗;加入相应浓度药物处理4 h。提取总RNA,逆转录为cDNA用于qRT-PCR。PCR反应体系:2×SYBR Green Ⅰ预混试剂5 μL,前引物(5 μmol/L)0.4 μL,后引物(5 μmol/L)0.4 μL,模板1 μL,加双蒸水将体系总体积调整至10 μL。反应条件:95 ℃预变性5 min;95 ℃变性10 s,60 ℃退火30 s,72 ℃延伸30 s,共40个循环。用2-ΔΔCt法计算候选基因的相对表达量,实验重复3次。qRT-PCR所用引物由上海生工生物工程股份有限公司合成,引物序列见表1。

表1 引物序列
1.2.5 蛋白质免疫印迹检测EGF前体的表达 培养细胞,待汇合度达70%时用胰蛋白酶消化,接种于6孔板中,分为5组:对照组、GST(100 μg/L)组、GST-PKG Ⅱ(100 μg/L)组、GST+8-pCPT-cGMP(250 μmol/L)组、GST-PKG Ⅱ+8-pCPT-cGMP组。待细胞汇合度达60%~70%时,更换无胎牛血清的培养液饥饿处理8~12 h;弃培养液,PBS冲洗;加相应浓度的药物处理24 h;裂解细胞,提取总蛋白,煮沸变性后于-20 ℃保存备用。取20 μg行SDS-PAGE,70 V恒压电泳;冰上300 mA恒流120 min,将蛋白转移至PVDF膜;5%牛血清白蛋白室温封闭1 h;目的条带用以5%牛血清白蛋白1 ∶500稀释的EGF前体蛋白多克隆抗体4 ℃孵育过夜;TBST清洗3次,再分别以TBST 1 ∶10 000稀释的HRP标记的羊抗兔多克隆抗体和β-肌动蛋白抗体室温孵育目的条带和内参1 h;TBST清洗3次;ECL发光液显色、凝胶成像系统扫描成像后用Image J软件进行灰度扫描分析;实验重复3次。
1.3 统计学处理

2 结果
2.1 表达受重组PKG Ⅱ调节的基因转录组测序筛选
对GST-PKG Ⅱ处理前、后的胃癌AGS细胞株转录组进行测序,质控后分别得到24.36 Gb和27.61 Gb的数据。对拼接后的转录组进行全转录组注释,将组装后的转录本通过BLASTn及BLASTx程序与COG、GO、KEGG、KOG、Pfam、Swiss-prot和NR共7个公共数据库对比,分别获得7 034、16 850、10 729、13 308、18 575、18 311和20 227条同源对比信息,具体如表2所示。
共筛选出579个差异表达基因。其中,在GST-PKG Ⅱ作用下267个基因表达明显上调,312个显著下调(图1)。将所筛选出的差异表达基因与COG数据库对比,共获得93个注释信息,划分为19个功能类别:分布最多的是一般功能预测基因,达31个(R);其次为涉及氨基酸转运与代谢的功能基因(E),共有11个;功能涉及复制、重组与修饰(L)以及信号转导机制(T)的基因各有10个,详见图2。
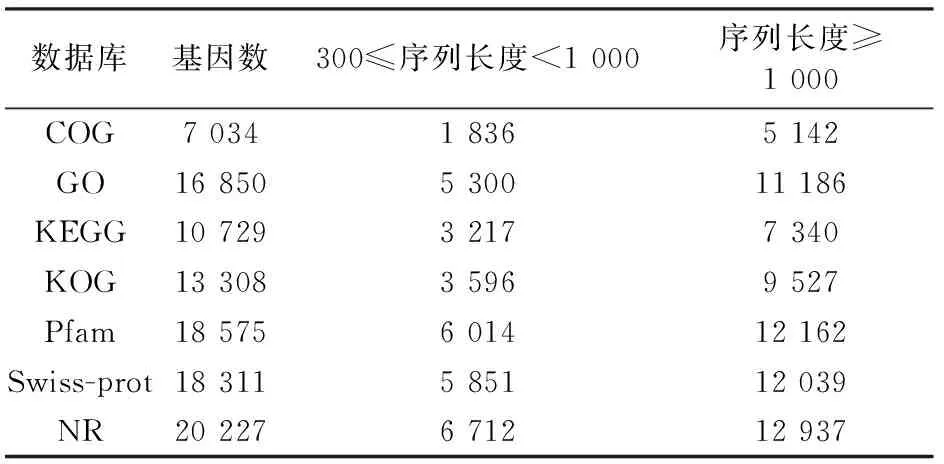
表2 胃癌细胞株AGS全转录组功能注释结果
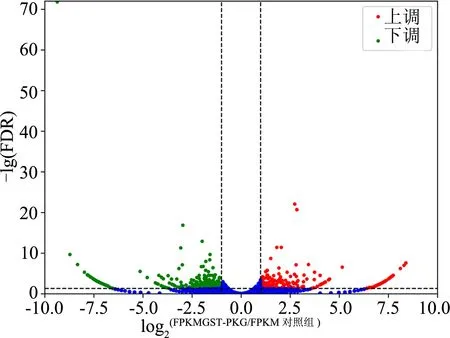
虚线以下的点无意义;虚线以上的点表示FDR≤0.05且│log2(FPKMGST-PKG II组/FPKM对照组)│>1的基因;其中,右侧虚线以右者表示在GST-PKG Ⅱ作用后表达上调,左侧虚线以左者表示表达下调
图1 差异表达基因火山图
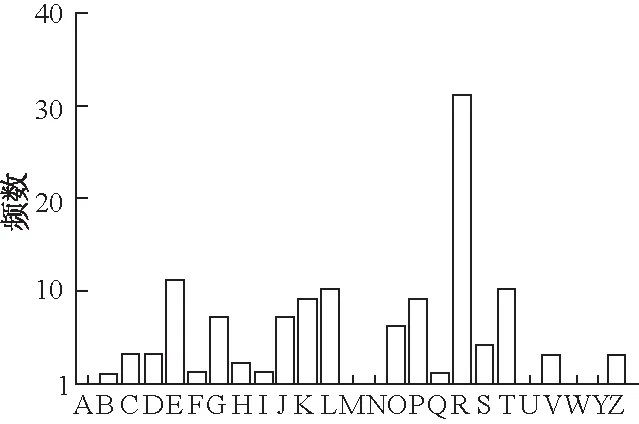
A:RNA加工和修饰;B:染色体结构和动力学;C:能量生成与转化;D:细胞周期调控,细胞分裂,染色体分离;E:氨基酸转运与代谢;F:核酸转运与代谢;G:碳水化合物转运与代谢;H:辅酶转运与代谢;I:脂类转运与代谢;J:翻译,核糖体结构与生物发生;K:转录;L:复制,重组与修饰;M:细胞壁/细胞膜生物发生;N:细胞活性;O:翻译后修饰,蛋白质折叠,伴侣;P:无机离子转运和代谢;Q:次级代谢物生物合成,转运及代谢;R:一般功能预测;S:未知功能;T:信号转导机制;U:细胞间运输,分泌物和膜泡运动;V:防御机制;W:胞外结构;Y:核结构;Z:细胞骨架
图2 差异表达基因COG功能注释分布图
对579个差异表达基因进行GO富集分析,共获得2 749个注释。将其功能划分为细胞组分、分子功能和生物过程三大类:其中,关于生物过程的注释最多,共有1 254个;其次为细胞组分,有1 089个GO注释;分子功能有406个注释。全转录组及差异表达基因GO功能分类的详细情况见图3。

每个亚分类中左侧表示全部基因的GO功能注释数,右侧代表差异表达基因的GO功能注释数图3 GO功能分类
进一步功能分类显示,579个差异表达基因中,58个与肿瘤生物学活动密切相关,20个与神经系统功能相关,9个与心脏活动有关,具体如图4所示。根据对差异表达基因的功能注释,提示分泌型PKG Ⅱ参与细胞生长、神经系统以及心脏活动等多种生物功能调节。重点筛选出与肿瘤细胞增殖相关的9个候选基因(EGF、FGF7、MARK1、GLI1、COL6A3、DFNA5、SEPT4、DACT1、PSCA,分别编码表皮生长因子、成纤维细胞生长因子7、微管亲和调节激酶1、胶质瘤相关癌基因1、Ⅵ型胶原蛋白α3链、耳聋相关基因Gasdermin-E、Septin-4、β-环连蛋白抑制基因1、前列腺干细胞抗原),进行后续验证及分析。

图中颜色深浅表示与对照组相比的表达差异,颜色越深表明表达差异越大;↓:表达下调的基因;*:后续重点筛选出的候选基因
图4 部分差异表达基因及其功能注释
2.2 重组PKG Ⅱ对肿瘤细胞增殖相关基因转录水平的影响
qRT-PCR结果显示,与对照组比较,在GST-PKG Ⅱ和8-pCPT-cGMP共同作用下,HGC-27和AGS细胞中FGF7和MARK1等mRNA水平比较均无明显差异(P均>0.05);EGFmRNA水平明显降低(P<0.01),DFNA5、DACT1、PSCA等mRNA水平明显增高(P<0.01或<0.05),与转录组测序一致;两个细胞株中GLI1、COL6A3和SEPT4 等mRNA水平比较,差异有统计学意义,但表现出相反的趋势,表明重组PKG Ⅱ在不同胃癌细胞株中发挥的作用并不完全一致(图5)。
2.3 重组PKG Ⅱ对胃癌细胞中EGF表达的影响
如图6所示,HGC-27细胞中,与对照组及GST组相比,GST-PKG Ⅱ组、GST+cGMP组和GST-PKG Ⅱ+cGMP组EGF前体蛋白水平均明显下调(P均<0.01),且与GST-PKG Ⅱ组相比,GST-PKG Ⅱ+cGMP组EGF前体蛋白水平下调更为明显(P<0.01);AGS细胞中,与对照组相比,GST组、GST-PKG Ⅱ组、GST+cGMP组和GST-PKG Ⅱ+cGMP组EGF前体蛋白表达水平均明显降低(P均<0.01),但与GST-PKG Ⅱ组相比,GST-PKG Ⅱ+cGMP组EGF前体蛋白表达水平无明显差异(P>0.05)。

a:P<0.05,b:P<0.01,与对照组比较图5 增殖相关基因的mRNA水平
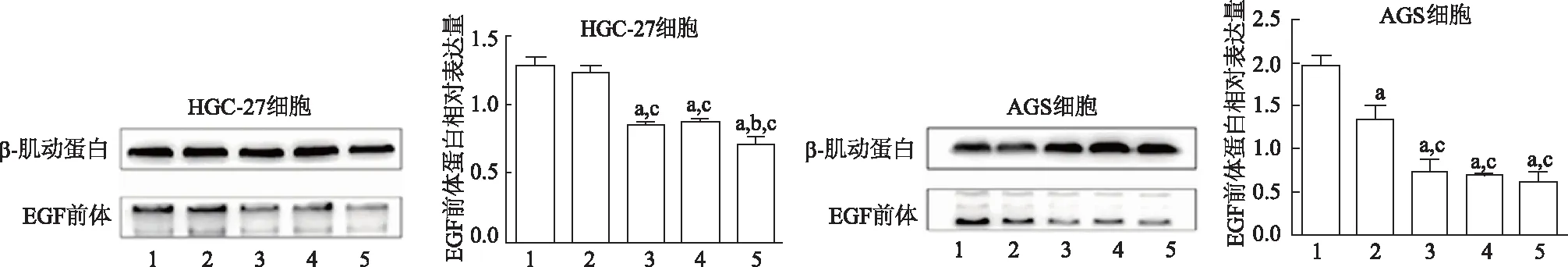
1:对照组;2:GST组;3:GST-PKG Ⅱ组;4:GST+8-pCPT-cGMP组;5:GST-PKG Ⅱ+8-pCPT-cGMP组;a:P<0.01,与对照组比较;b:P<0.01,与GST-PKG Ⅱ组比较;c:P<0.01,与GST组比较
图6 各组EGF前体蛋白表达水平比较
3 讨论
为研究PKG Ⅱ作为分泌型蛋白激酶对肿瘤基因表达的调控作用,本研究首先通过转录组测序分析筛选出579个差异表达基因,267个基因表达显著上调,312个显著下调,涉及肿瘤生物学活动、神经系统功能和心脏功能等多个方面。这些差异表达基因中个别基因的功能也有部分重叠:其中CDON具有抑制增殖和迁移、促进肿瘤细胞凋亡的作用,同时参与神经前体细胞迁移和神经元分化的正调节,在心肌重塑中也发挥一定的作用[10-13]。为增加研究结果的可靠性,本研究采用HGC-27和AGS两个细胞株对转录组测序结果进行qRT-PCR验证,结果显示从579个差异表达基因中筛选出的9个候选基因中有4个mRNA水平的变化趋势在两个细胞株中均与转录组测序结果一致,即在重组PKG Ⅱ作用下,EGF表达下调,而DFNA5、DACT1和PSCAmRNA表达上调。由此表明,该测序结果对研究分泌型PKG Ⅱ对细胞基因表达的影响有一定的参考价值。
进一步得到验证的4个基因——EGF、DFNA5、DACT1和PSCA在肿瘤细胞增殖中均具有重要的调控作用:Akino等[14]发现,DFNA5/GSDME因异常甲基化所致的沉默在原发性胃癌中常有发生,而将外源DFNA5导入NUGC3沉默细胞可抑制新霉素抗性菌落形成,逆转胃癌细胞对化疗药物的耐药性,提示DFNA5可能在胃癌中起到生长抑制作用;Rogers等[15]发现活化的caspase-3可以裂解DFNA5/GSDME,产生靶向透化质膜的坏死性DFNA5-N末端片段,介导细胞凋亡。DACT1启动子甲基化在许多研究中均有报道,包括胃癌[16]、食管鳞状细胞癌[17]和鼻咽癌[18]等,其异常甲基化与肿瘤的发生发展及患者的不良预后密切相关[16-17],在体内和体外试验中均表现出对胃癌的抑制作用[19]。DACT1过表达还可通过抑制KG-1α增殖、促进细胞凋亡进而抑制白血病发生和进展[20]。PSCA在前列腺癌中高表达,但在胃癌和食管癌中却几乎不表达[21],敲除PSCA基因在体外和体内均能促进胃癌细胞增殖,体外试验中PSCA高表达可抑制胃癌AGS细胞增殖[22]。多篇文献报道EGF与肿瘤细胞增殖密切关联[23-24]。由此得出,分泌型PKG Ⅱ可能通过下调EGF表达,同时上调DFNA5、DACT1和PSCA表达,促进胃癌细胞凋亡,抑制胃癌细胞增殖,最终抑制肿瘤生长。
除了对肿瘤细胞增殖相关基因的调节作用外,本次测序结果还显示重组PKG Ⅱ对神经系统功能调控和心脏活动的众多基因都有明显的调节作用。例如,重组PKG Ⅱ除了可以通过调节编码钠/钙交换蛋白2的SLC8A2(NCX2)表达抑制肿瘤生长[25-26];还可通过增强SLC8A2表达,维持突触完整性和突触密度、保证正常的认知和记忆[27];此外,PKG Ⅱ还可能通过上调编码二氢嘧啶脱氢酶4的DPYSL4表达,从而促进肿瘤细胞凋亡、抑制肿瘤生长[28],保证神经突的正常形成、神经元正常分化,增加树突的数量及长度[29]。可见,分泌型PKG Ⅱ除了可以通过调节肿瘤生物学活动相关基因的表达,影响肿瘤细胞生长,还可能参与调控神经系统和心血管系统的活动。
对EGF前体蛋白水平的检测结果进一步显示,在GST-PKG Ⅱ作用下,HGC-27和AGS细胞中EGF前体蛋白水平较对照组明显降低,加入8-pCPT-cGMP后,GST-PKG Ⅱ对HGC-27细胞中EGF前体蛋白表达的抑制作用更为明显。GST对HGC-27细胞中EGF前体表达无抑制作用,而cGMP加入可能引起细胞中内源性PKG Ⅱ的激活,进而导致EGF前体表达下调。对于AGS细胞株,GST对EGF前体表达也有一定的抑制作用,但与GST组相比,重组PKG Ⅱ组EGF前体表达明显降低(P<0.01),表明重组蛋白GST-PKG Ⅱ中PKG Ⅱ对EGF前体表达有抑制作用,而非单纯GST起作用。cGMP的加入同样可能导致AGS细胞株中内源性PKG Ⅱ的激活,从而引起EGF前体表达降低。在AGS细胞株中,GST-PKG Ⅱ+cGMP组与GST-PKG Ⅱ组相比差异无统计学意义,表明cGMP激活并不能增强重组PKG Ⅱ对EGF前体蛋白表达的抑制作用。
综上所述,PKG Ⅱ能够作为一种分泌型蛋白激酶调控EGF的转录和翻译,但其抑制EGF表达的机制有待进一步探索。
