长链非编码RNA PAPPA-AS1在人肺腺癌细胞铂类耐药中的作用
2020-06-11施辰曹海霞徐陈欣张辉娄芮吴建中马蓉冯继锋
施辰, 曹海霞, 徐陈欣, 张辉, 娄芮, 吴建中, 马蓉, 冯继锋
(1. 南京医科大学附属肿瘤医院肿瘤内科, 江苏 南京 210009; 2. 江苏省肿瘤医院临床肿瘤研究中心, 江苏 南京 210009)
肺癌是全球范围内发病率、死亡率最高的恶性肿瘤[1]。根据组织病理学分类,肺癌可分为小细胞肺癌(small cell lung cancer, SCLC)和非小细胞肺癌(non-small cell lung cancer, NSCLC),其中肺腺癌是NSCLC最主要的亚型之一,约占所有肺癌病例的40%[2]。NSCLC生长迅速,转移早,多数患者在确诊时已属进展期,失去手术机会。目前,含铂的双药联合化疗仍然是临床上治疗NSCLC的一线标准方案。铂类化合物是一类非特异性细胞周期抗肿瘤药物,具有广泛的抗瘤谱,主要包括顺铂(cisplatin, DDP),奈达铂(nedaplatin, NDP),卡铂(carboplatin,CBP),奥沙利铂(Oxaliplatin, OXA)等[3]。这类药物的作用机制相似,主要通过诱导肿瘤细胞DNA损伤、抑制修复,进而造成细胞凋亡[4]。然而,随着此类药物的普遍应用,致使癌细胞不可避免地对其产生了耐药性,严重降低肺癌的治愈率和远期生存率[5]。长链非编码RNA(long noncoding RNA,lncRNA)是一类长度大于200个核苷酸的非编码序列,由于缺乏开放阅读框架,不具备编码蛋白的能力[6]。研究表明,在癌组织和细胞中频繁出现lncRNA异常表达的情况,它们可能与肿瘤的发生发展、侵袭转移、药物抵抗有密不可分的相关性[7]。然而,lncRNA引起肺腺癌铂类耐药的机制尚不完全清楚。本研究利用人肺腺癌铂类耐药细胞 (A549/DDP和A549/NDP)及其亲代敏感细胞A549细胞进行lncRNA和mRNA的芯片表达谱分析,筛选出lncRNA PAPPA-AS1作为研究对象,探讨其在肺腺癌铂类耐药细胞中的作用以及潜在机制。
1 材料与方法
1.1 细胞株及培养
人肺腺癌细胞系A549购于中国科学院上海细胞库,其铂类耐药细胞系A549/DDP和A549/NDP均由江苏省肿瘤医院临床肿瘤研究中心诱导构建并且传代培养。为维持耐药株的状态,在A549/DDP和A549/NDP细胞培养基中分别加入2.5 μmol/L DDP和NDP。所有细胞置于5%胎牛血清的RPMI-1640培养基中培养,每2~3天更换一次培养液。
1.2 实验试剂及仪器
RPMI-1640培养基(南京凯基生物科技有限公司),胎牛血清(美国Gibco公司),Trizol RNA抽提试剂、Lipofectamine RNA iMAX试剂(美国Invitrogen公司),Opti-MEM减血清培养基(美国Gibco公司),Cell Counting Kit-8试剂盒(日本同仁化学研究所),Qubit RNA分析试剂盒(美国Life Technologies公司),NEBNext Ultra RNA试剂盒(美国NEB公司),TruSeq PE聚类试剂盒(美国Illumina公司),顺铂(美国Sigma-Aldrich公司),奈达铂(江苏奥赛康药业股份有限公司),细胞凋亡检测试剂盒(美国BD公司),蛋白抗体(美国CST公司),恒温细胞培养箱、超低温冰箱(-80℃)(美国Thermo公司),恒温水浴锅(太仓市科教器材厂),7300实时荧光定量PCR仪(美国ABI公司),酶联免疫检测仪(美国Epoch Bio Tek公司),流式细胞仪(美国BD公司),蛋白电泳仪、蛋白转膜仪(美国Bio Rad公司),纳米分光光度计(美国Implen公司)。
1.3 RNA-Seq分析肺腺癌细胞中lncRNA以及mRNA的差异表达
RNA测序分析由中国上海嘉因生物科技公司完成。使用Trizol分离A549和铂类耐药细胞的总RNA。利用纳米分光光度计检测RNA纯度。Qubit分析试剂盒测量RNA浓度。安捷伦RNA纳米试剂盒检测RNA的完整性。总共3 μg RNA/样本作为输入材料的RNA样品制备。使用NEBNext Ultra RNA试剂盒生成测序文库,并添加索引代码来为每个样本添加属性序列。使用TruSeq PE聚类试剂盒对索引编码的样本进行聚类分析,结果生成后在Illumina HiSeq 4000平台上进行RNA测序。
1.4 小干扰RNA (siRNA)转染耐药细胞
PAPPA-AS1特异性小干扰序列(si-PAPPA-AS1)由中国广州锐博科技有限公司合成。将10 μL iMAX加入250 μL的Opti-MEM中稀释,吹打混匀后,室温静置5 min,按照iMAX试剂说明书转染细胞。转染48~72 h siRNA后,收集细胞用于进一步的实验。siRNA的靶序列:5′-AATTCCCAGCTCCAGGTTTC-3′。
1.5 CCK-8实验检测细胞对铂类药物的敏感性
细胞以5 000个/孔接种到96孔板,分别加入浓度为3.3、6.6、13.2、19.8、26.4、33.0 μmol/L DDP或5、10、20、30、40、50 μmol/L NDP的培养液。每个细胞株和药物浓度设立6个复孔。48 h后加入CCK-8试剂孵育1~2 h,待培养液颜色明显变黄后,用酶标仪在450 nm处测定各孔的光密度(D) 值,计算各细胞的半数抑制浓度(IC50)。每组实验重复3次。
1.6 CCK-8实验检测敲减PAPPA-AS1后耐药细胞的增殖能力
转染后的铂类耐药细胞接种于96孔板,每孔内加入细胞6 000个,放置于37℃、5% CO2恒温培养箱中培养。在细胞培养后的24、48、72、和96 h, 弃旧培养液,每孔加入含CCK-8试剂(10 μL)的100 μL培养液, 放在培养箱中培养1~2 h,待视觉颜色明显变黄时,用酶标仪测量450 nm处的D值。实验重复3次。
1.7 细胞克隆形成实验检测敲减PAPPA-AS1后耐药细胞的增殖活力
用胰蛋白酶消化处于对数生长期的铂类耐药细胞,完全培养基重悬以备用。将细胞以每孔200个/孔均匀接种于含10%胎牛血清的RPMI-1640培养基的6孔板中。置于37℃、5% CO2的恒温箱中培养,每3天更换一次完全培养液。大约培养2周,每天观察细胞,待细胞集落形成时,终止培养。吸出培养液,PBS缓冲液润洗2~3次。每孔加入适量多聚甲醛固定半小时,弃多聚甲醛,加入0.1%结晶紫染色15~20 min。用PBS缓冲液洗去染色液,放于室内通风处自然干燥。拍照,计数。
1.8 qRT-PCR检测lncRNAs在耐药细胞中的表达情况
按照TRIzol说明书步骤提取细胞总RNA,采用PAPPA-AS1特异的引物进行lncRNA逆转录反应,β-肌动蛋白作为内参。实时荧光定量PCR反应体系:2× SYBR Green Master Mix 10 μL,cDNA 4 μL,上下游引物(10 mol/L)各1 μL,无菌蒸馏水4 μL。反应程序:95℃预变性30 s,95℃变性5 s、60℃退火34 s、68℃延伸45 s,共进行40个循环。RNA引物由中国广州锐博生物科技有限公司设计。PAPPA-AS1上游引物:5′-AGTGTGGTTCTGAGTGCAGTCTT-3′,下游引物:5′-TGGCAATCAGTGGTAGTAGGGA-3′;β-肌动蛋白上游引物:5′-GATGAGATTGGCATGGCTTT-3′,下游引物:5′-CACCTTCACCGTTCCAGTTT-3′。通过公式2-△△CT计算基因的相对表达量。所有实验重复3次。
1.9 流式细胞术分析敲减PAPPA-AS1后的细胞凋亡率
用不含EDTA的胰蛋白酶消化收集转染后的耐药细胞于离心管中,1 000 r/min离心5 min。弃上清液,用预冷的PBS缓冲液冲洗,1 000 r/min离心5 min,重复2次。采用Annexin V-荧光素异硫氰酸酯/碘化丙钠(FITC/PI)进行细胞染色, 室温(20°C左右)避光放置15~20 min后检测凋亡细胞。
1.10 蛋白印迹实验检测敲减PAPPA-AS1后耐药细胞中相关通路蛋白的表达
细胞在预冷的RIPA缓冲液中裂解完全,放入低温离心机中4℃、12 000 r/min离心15 min。保留上清液,用BCA试剂盒测定浓度。置于70°C金属浴上加热10 min,将变性的蛋白样品逐一加样,电泳仪设置为220 V、60 min进行蛋白电泳。电泳结束取胶,300 mA转膜。2 h后取出PVDF膜,浸于一抗Cleaved Caspase-3、Cleaved Caspase-9、p-PI3K、p-mTOR稀释比均为1 ∶1 000,p-Akt稀释比为1 ∶2 000,4℃孵育过夜。清洗后常温孵育二抗(1 ∶5 000)1 h。利用ECL试剂盒配置显影液,滴于PVDF膜上,暗室曝光,记录蛋白图片。
1.11 统计分析

2 结果
2.1 人肺腺癌铂类耐药细胞株A549/DDP和A549/NDP的建立
采用大剂量冲击法将人肺腺癌细胞系A549连续暴露于剂量递增的DDP或NDP中。经过6个月的药物诱导,铂类耐药细胞株A549/DDP和A549/NDP由亲代A549细胞构建成功。CCK-8检测结果显示,A549和A549/DDP细胞对DDP的IC50值为(6.14±1.21)μmol/L和(38.49±1.32)μmol/L,A549和A549/NDP细胞对NDP的IC50值为(12.41±1.58)μmol/L和(54.74±1.97)μmol/L(图1A、1B)。将肺腺癌细胞置于显微镜下观察,可见亲代A549细胞呈上皮形态、圆球形、成簇生长,而A549/DDP和A549/NDP细胞体积较大、形态拉长且不规则(图1C、1D、1E)。

A、B: CCK-8实验检测肺腺癌细胞在铂类药物作用下的生存活力;C~E:肺腺癌细胞的镜下形态学观察(×100)
图1 铂类耐药细胞 A549/DDP和A549/NDP的建立
2.2 芯片中差异表达lncRNA的验证筛选
利用RNA-Seq对人肺腺癌亲代敏感细胞株A549和顺铂耐药细胞A549/DDP进行lncRNA以及mRNA表达谱的分析。测序分析的聚类图显示了两个细胞株之间差异表达的6 899个lncRNA和22 268个mRNA (图2)。以倍数变化值>2和假发现率<0.05作为筛选显著差异表达lncRNA和mRNA的标准。结果显示与A549细胞相比,A549/DDP细胞中共有110个显著差异表达的lncRNA,其中70例上调,40例下调。此外,耐药细胞中有642个mRNA显著上调,430个mRNA显著下调。通过细胞生物学功能的KEGG通路分析,初步探讨A549和A549/DDP细胞中差异表达mRNA的生物学功能。结果显示,显著上调的基因主要参与了p53信号通路、细胞外基质与受体的相互作用、局灶性黏附以及PI3K-Akt通路。相反,表达下调的mRNA所靶向富集的通路主要涉及唾液分泌、PPAR信号通路和不饱和脂肪酸的生物合成。基于以上结果,我们随机选择了其中显著差异表达的6个lncRNA通过qRT-PCR验证其在A549/DDP细胞中的相对表达水平,以检测芯片结果的准确性。与亲代A549细胞相比,A549/DDP细胞中CTD-2653D5.1、LINC01021、RP11-1151B14.4、PAPPA-AS1的表达水平升高,与测序结果一致。而MEG3、LINC00473的表达水平与亲代细胞A549相比并无明显差异。随后,通过qRT-PCR检测了这6个候选lncRNA在A549/NDP细胞中的相对于A549细胞的表达情况。最终,挑选出在两株铂类耐药细胞中均明显上调的lncRNA PAPPA-AS1进行下一步的研究。
2.3 敲减PAPPA-AS1增强A549/DDP和A549/NDP细胞对铂类药物的敏感性
将小干扰序列si-PAPPA-AS1或si-NC转染到A549/DDP和A549/NDP细胞中,qRT-PCR结果显示,si-PAPPA-AS1组中PAPPA-AS1的表达明显下调。测算DDP和NDP对转染后耐药细胞的IC50。结果显示,PAPPA-AS1敲减后, A549/DDP和A549/NDP对DDP和NDP的IC50值分别为(7.85±1.27)μmol/L和(21.48±1.42)μmol/L,si-NC组的IC50值分别为(22.57±1.03)μmol/L和(45.27±1.38)μmol/L。见图3。
2.4 敲减PAPPA-AS1抑制A549/DDP和A549/NDP细胞的增殖
与si-NC组相比,si-PAPPA-AS1组细胞的增殖速率明显降低。平板克隆实验结果显示,下调PAPPA-AS1的表达后,A549/DDP和A549/NDP细胞增殖受到抑制,与si-NC组相比,形成的细胞集落数量明显减少。见图4。
2.5 敲减PAPPA-AS1促进A549/DDP和A549/NDP细胞凋亡
流式细胞术检测结果显示,si-PAPPA-AS1组中的肺腺癌铂类耐药细胞的凋亡率较si-NC组显著升高。蛋白印迹结果表明,PAPPA-AS1下调可促使A549/DDP和A549/NDP细胞中Cleaved Caspase-3和Cleaved Caspase-9蛋白表达升高,磷酸化PI3K、Akt和mTOR的蛋白表达下调,而PI3K、Akt和mTOR蛋白表达无明显变化。见图5。
3 讨论
肺腺癌是NSCLC中最常见的一种类型,化疗是其临床治疗的重要手段之一[8]。临床上以铂类药物为基础的联合化疗被认为是NSCLC的一线治疗方案。然而,随着铂类抗癌症药物的广泛长期使用,有超过半数的肿瘤患者对其产生了耐药性[9]。耐药性的产生是多因子网络共同调控的结果,至今临床上仍然缺乏公认的预测因子和基于分子机制的有效干预策略。因此,深入探究参与肿瘤耐药性的基因及其作用机制对优化肺癌的治疗具有十分积极的意义。

A、B:lncRNA(A)和mRNA(B)差异表达的聚类热图分析,绿色代表下调的RNA;红色代表上调的RNA;C: RT-qPCR验证lncRNA在铂类耐药细胞中的相对表达情况,*:P<0.05, 与A549细胞比较;D、E:差异表达mRNA的KEGG通路富集分析
图2 肺腺癌细胞中显著差异表达lncRNA筛选验证
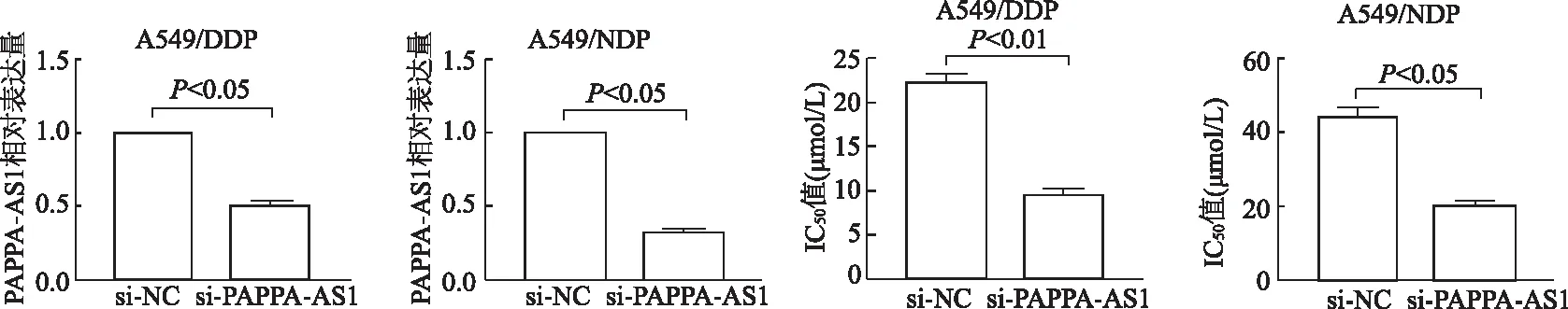
图3 敲减PAPPA-AS1增强A549/DDP和A549/NDP细胞对铂类药物敏感性
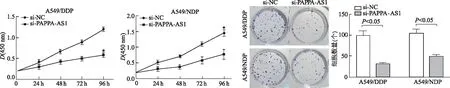
*: P<0.01,与si-NC组比较图4 敲减PAPPA-AS1抑制A549/DDP和A549/NDP细胞的增殖
研究表明,lncRNA可以通过转录及转录后水平调控靶基因的表达从而参与肿瘤细胞耐药性的形成[10]。以lncRNA UCA1为例,其可通过促进Wnt6的表达增强膀胱癌细胞对DDP的耐药性[11]。然而,目前关于lncRNA与肺腺癌铂类耐药的报道较少。本研究通过RNA测序技术在肺腺癌细胞中筛选出了一种新的lncRNA PAPPA-AS1,它定位于染色体9q33.3,是一个长度为2 450 bp的反义lncRNA,有关它的生物学功能几乎是未知的。与测序结果一致,与肺腺癌亲代敏感A549细胞相比,PAPPA-AS1在A549/DDP和A549/NDP细胞中均显示出明显的高表达,提示它可能与肺腺癌的铂类耐药密切相关。随后,对其进行生物学功能的体外研究,结果显示敲减PAPPA-AS1可以增强耐药细胞对DDP以及NDP的敏感性,抑制细胞的增殖,促进细胞凋亡。
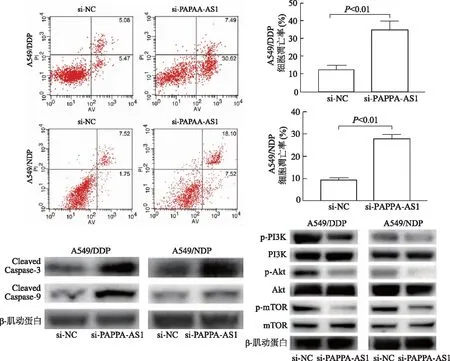
图5 PAPPA-AS1下调对A549/DDP和A549/NDP细胞凋亡的影响
PI3K/Akt信号通路是一条公认的致癌通路,对细胞生长存活等过程至关重要[12]。研究证实,它的激活可以通过增加P53蛋白的降解而促进癌细胞的存活,亦可通过抑制蛋白水解酶caspase-9的活性而阻止细胞凋亡[13-14]。近年来,有研究表明PI3K/Akt信号通路在A549/DDP细胞中被激活,而PI3K/Akt通路的失活可增强肺腺癌细胞对铂类药物的化学敏感性[15]。本研究结果显示,下调PAPPA-AS1可降低A549/DDP和A549/NDP细胞中磷酸化PI3K、Akt和mTOR蛋白的表达水平,增加执行细胞凋亡的关键性蛋白Cleaved Caspase-9以及Cleaved Caspase-3的表达水平。本研究数据说明,PAPPA-AS1下调可通过抑制PI3K/Akt信号通路促进肺腺癌铂类耐药细胞凋亡。然而,lncRNA PAPPA-AS1在化疗耐药中的具体机制还需要在体内实验中进一步验证。
综上所述,本研究结果证实PAPPA-AS1在肺腺癌铂类耐药细胞中呈高表达,它的下调可以通过抑制PI3K/Akt信号通路,促进耐药细胞凋亡,抑制细胞增殖,进而逆转细胞对铂类药物的抵抗性。提示PAPPA-AS1可能作为一种促癌因子参与肺腺癌化疗耐药表型的形成,其有望成为逆转铂类耐药的生物学靶点。
