桥本甲状腺炎对孕鼠额叶谷氨酸及其转运体的影响
2020-06-11柳田田吴章碧朱德发
柳田田,杨 昊,夏 琴,程 锦,吴章碧,王 囡,朱德发
桥本甲状腺炎(hashimoto’s thyroiditis,HT)是常见的自身免疫性甲状腺疾病,发病率0.3% ~ 10%,女性高发。其特征为甲状腺内淋巴细胞浸润,部分甲状腺滤泡破坏以及血清自身抗体甲状腺球蛋白抗体(thyroglobulin antibody,TgAb)、甲状腺过氧化物酶抗体(thyroid peroxidase antibody, TPOAb)的增加[1]。相关研究[2]表明,妊娠期女性血清抗TPOAb水平与情绪障碍有着明显关系。有文献[3]指出情绪障碍与谷氨酸能系统功能障碍有关。谷氨酸(glutamic acid, Glu)具有广泛的神经调节作用,是中枢神经系统中主要的兴奋性神经递质[4]。高浓度的Glu产生的神经毒性可导致神经元死亡,Glu在神经元细胞外维持低浓度主要依赖于Glu转运体的调节[5]。课题组前期研究[6]显示,HT可导致小鼠额叶Glu含量增加,额叶是影响情绪行为的关键大脑区域。现试图探讨小鼠在妊娠状态下,HT对额叶Glu水平的影响。
1 材料与方法
1.1 实验动物6周龄健康NOD雌性小鼠50只、NOD雄鼠10只,购自北京华阜康生物科技有限公司,体质量20~23 g,标准饲养条件饲养于安徽医科大学动物实验中心,温度21~23 ℃, 湿度 (55±5)%,实验过程遵循《安徽医科大学实验动物管理和使用指南》。
1.2 主要试剂及仪器猪甲状腺球蛋白(porcinethyroglobulin,pTg)、完全弗氏佐剂(complete Freund′s adjuvant,CFA)、不完全弗氏佐剂(incomplete Freund′s adjuvant,IFA)(美国Sigma公司); 三碘甲状腺原氨酸(triiodothyronine,T3)试剂盒、四碘甲状腺原氨酸 (tetraiodothyronine,T4)试剂盒、甲状腺球蛋白抗体(thyroglobulin antibody,TgAb)、甲状腺过氧化物酶抗体(thyroid peroxidase antibody,TPOAb)(德国Roche公司); 促甲状腺激素(thyroid stimulatinghormone, TSH) ELISA试剂盒(武汉云克隆、CEA463Mu); Glu ELISA 试剂盒(武汉华美公司);兔单克隆抗体囊泡谷氨酸转运蛋白(vesicular glutamate transporter, VGLUT)1、兴奋性谷氨酸转运蛋白(excitatory glutamate transporter,EAAT)2及内参一抗GAPDH(美国Abcam公司);辣根过氧化物酶标记山羊抗兔IgG抗体(美国Millipore公司);超敏显影液(美国Thermo公司);化学发光成像仪(上海 Tanon公司);高速台式冷冻离心机(安徽嘉文仪器装备有限公司);低速迷你离心机(海门市其林贝尔仪器制备有限公司);普通PCR仪(杭州晶格科学仪器公司);微量移液器(德国Eppendorf公司);微板孔迷你离心机(杭州奥盛仪器有限公司);逆转录试剂盒、荧光定量 PCR仪(美国Thermo Scientific公司);形态学图像分析系统(Image-ProPlus 6.0,美国 Media Cybernetics公司)。
1.3 制备动物模型适应性喂养50只NOD雌性小鼠1周后,随机分成2组,即CON组(20只)和 HT组(30只)。在100 μl生理盐水中溶入25 μg pTg ,分别在一次性注射器中吸入等量CFA与pTg溶液,接通三通管,冰浴条件下研磨至完全乳化。随后固定小鼠,在HT组小鼠尾根部1 cm处用一次性注射器皮下注射乳状剂0.1 ml。在CON组注射等量不含pTg的CFA 乳化剂。14 d后将CFA替换成IFA,与pTg制备成乳化剂,同样操作方法在每只HT组小鼠尾根部1 cm处皮下注射0.1 ml乳化剂。在CON组注射等量不含 pTg的IFA乳化剂。造模周期49 d。造模成功后,将各组雌鼠与健康NOD雄鼠2:1合笼建立妊娠模型。实验经安徽医科大学伦理委员会审核批准。
1.4 方法
1.4.1妊娠小鼠模型制备 将造模成功的雌鼠与健康雄鼠随机分组合笼,雌雄比2 ∶1,每日19:30-20:00合笼,次日7:00-7:30观察雌鼠阴道口是否有阴栓,若有阴栓判断为已交配,取出另笼饲养,记为受孕0.5 d。
1.4.2血清甲状腺激素水平测定 取2组孕鼠各15只经水合氯醛麻醉后眼眶静脉取血1 ml,4 ℃冰箱静置4~6 h,4 000 r/min离心15 min,分离血清并于4 ℃ 冰箱保存。ELISA法检验血清TSH水平,电化学发光免疫分析法检验血清T3、T4、TPOAb、TgAb水平。
1.4.3标本制备 妊娠4.5 d小鼠取血后立即断头处死,冰上迅速分离脑组织,取额叶置于-80 ℃冰箱保存。2组各分离6只小鼠甲状腺,4%多聚甲醛中固定分离的甲状腺,置于摇床上24 h后,石蜡包埋,连续切成5 μm厚薄片。
1.4.4HE染色 将甲状腺切片脱蜡、复水,苏木精染色后水洗,盐酸乙醇分色、蓝化,伊红染色后水洗,再经脱水、透明后烘干封片。光学显微镜下拍摄图片。
1.4.5ELISA法检测谷氨酸水平 2组各取6只左脑额叶组织加入300 μl PBS (pH 7.4)冰上匀浆,4 ℃、3 000 r/min离心20 min,收集上清液。按Glu的ELISA试剂盒说明操作:配置标准品与洗涤液;将50 μl标准品加入酶标包被板的标准孔中;样品孔加入样品稀释液40 μl后加入样品10 μl(最终稀释度为5倍);每孔加入酶标试剂100 μl;空白孔不加入酶标试剂及样品;封板膜封板后37 ℃温育1 h;弃去液体,洗涤液重复洗涤各孔5次;每孔相继加入显色剂A、显色剂B各50 μl,轻轻震荡混匀后37 ℃避光显色15 min;各孔加终止液50 μl,终止反应;以空白孔调零,酶标仪450 nm波长测量各孔的吸光度(optical density,OD)值;对照标准曲线换算出样品的Glu浓度。
1.4.6Western blot法检测VGLUT1、EAAT2蛋白表达水平 2组孕鼠各取3只右脑额叶,按100 ∶1混匀组织裂解液和蛋白酶抑制剂后,加右脑额叶并冰上匀浆,4 ℃、15 000 r/min离心15 min ,取上清液再次4 ℃、15 000 r /min离心15 min,取上清液按BCA试剂盒方法测定蛋白浓度; 使用2×上样缓冲液稀释定量,100 ℃、10 min 蛋白变性,分装-20 ℃保存;制胶,每组取蛋白样本 20 μg进行SDS-PAGE电泳分离后转至PVDF膜上;丽春红染色,三蒸水洗涤3次7 min;5%脱脂牛奶封闭2 h,三蒸水洗涤3次7 min;加入不同一抗(VGLUT 1 1 ∶1 000,EAAT 2 1 ∶1 000,GAPDH 1 ∶4 000)4 ℃条件下摇床孵育过夜。PBST洗膜3次,每次10 min,PBS洗膜10 min;加入HPR相应二抗(VGLUT 1/EAAT 2 1 ∶80 000,2 h; GAPDH 1 ∶150 000)室温孵育40 min;PBST洗膜3次,每次10 min,PBS洗膜10 min;滴加超敏显影液后置于化学发光成像仪中拍摄蛋白条带;Image proplus图像分析软件进行灰度值分析,计算目的蛋白与内参对照GAPDH的灰度值比值。
1.4.7RT-qPCR法检测VGLUT1、EAAT2 mRNA水平 2组各取8只额叶组织60 mg,剪碎研磨,加入1 ml TRIzol匀浆,加0.2 ml氯仿,振荡15 s,室温孵育5 min后离心,加0.5 ml预冷异丙醇,混匀,冰上孵育30 min后离心弃上清液,加1 ml预冷75%乙醇后离心弃上清液,室温干燥RNA沉淀,加50 μl DEPC水,-80 ℃保存;在0.2 ml EP管中,加入总RNA (质量为1 μg)、10 μmol/L Oligo(dT)1 μl、DEPC水补足至11 μl后混匀,进行离心、加热、冰浴;上述EP管中加入5×Reaction Buffer 4.0 μl、10 mmol/L dNTP Mix 2 μl、RibolockTM Rnase inhibitor 1 μl、RevertAidTM M-MuLV Reverse Transcniptase 1 μl;42 ℃、60 min, 70 ℃、5 min;取出上述反应液,即为cDNA,-80 ℃ 保存备用。取出cDNA作为荧光定量的模板,反应体系:2×SYBR Green mixture 5 μl;Forward primer(10 μmol/L)1 μl;Reverse primer(10 μmol/L)1 μl;cDNA 1 μl;不含RNase 的纯水2 μl;反应条件:95 ℃ 变性2 min;95 ℃退火5 s;60 ℃延伸10 s,3个步骤进行40个循环;进行目的基因扩增。荧光定量结果用2-ΔΔCt进行分析。各基因引物序列见表 1。
2 结果
2.1 孕鼠血清甲状腺激素及抗体水平两组T3、T4、TSH水平差异无统计学意义,HT组TgAb、TPOAb水平较CON组升高(P<0.05)。见表 2。

表2 各组孕鼠T3、T4、TSH、TgAb、TPOAb水平
与CON组比较:*P<0.05
2.2 两组孕鼠甲状腺HE染色情况对比与CON组相比,HT组孕鼠甲状腺内可见部分甲状腺滤泡破坏及大量淋巴细胞浸润。见图1。
2.3 两组孕鼠额叶谷氨酸含量比较ELISA法检测结果显示,CON组孕鼠额叶Glu浓度水平低于HT组,差异有统计学意义(P<0.05)。见图3。

图1 孕鼠甲状腺组织HE染色 ×200
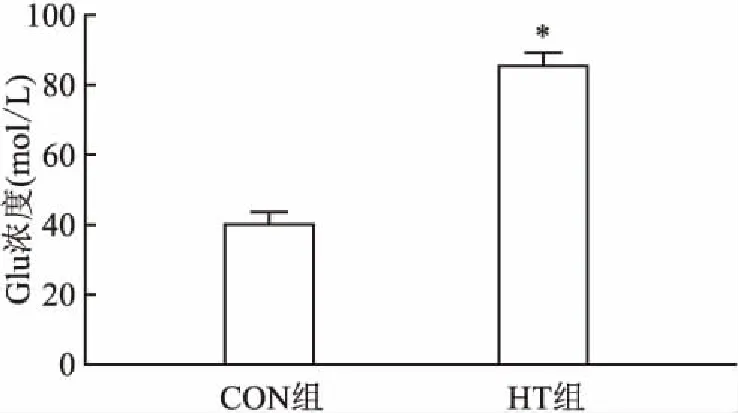
图2 两组孕鼠额叶Glu水平的表达与CON组比较:*P<0.05
2.4 两组孕鼠额叶VGLUT1、EAAT2蛋白表达水平情况HT组孕鼠额叶组织中谷氨酸转运体VGLUT 1蛋白表达较CON组孕鼠降低(P<0.05),差异有统计学意义; 与CON组相比,HT组额叶组织中谷氨酸转运体EAAT 2的蛋白表达差异无统计学意义。见图3。
A:VGLUT 1和EAAT 2在孕鼠额叶中的蛋白表达的情况; B:两组VGLUT 1蛋白表达;C:两组EAAT 2蛋白表达;与CON组比较:*P<0.05
2.5 两组孕鼠额叶VGLUT1、EAAT2 mRNA表达情况与 CON组相比,HT组额叶组织中VGLUT 1 mRNA表达降低(P<0.05),差异有统计学意义;而两组额叶中EAAT 2 mRNA表达差异无统计学意义。见表3。

表3 两组孕鼠VGLUT 1、EAAT 2 mRNA表达水平
与CON组比较:*P<0.05
3 讨论
本研究通过将pTg结合弗氏完全佐剂和弗氏不完全佐剂注射于NOD小鼠尾根部建立HT动物实验模型[7],结果显示HT组小鼠仅表现TgAb和TPOAb升高,甲状腺HE染色结果见大量淋巴细胞浸润及部分甲状腺滤泡破坏,提示HT造模成功。HT造模成功后,将健康NOD雄鼠与2组小鼠合笼,选取妊娠小鼠。
课题组前期对HT小鼠进行研究[6],显示HT小鼠额叶Glu较CON组升高;本实验通过对孕鼠的研究,显示HT组孕鼠额叶Glu含量高于CON组;有文献报道[8-9]对多发性硬化症患者的研究,发现血清Glu含量及脑脊液Glu水平升高,多发生情绪障碍。Kashanian et al[2]的研究显示在甲状腺功能正常的孕妇中,妊娠早期血清抗TPOAb阳性比血清抗TPOAb阴性的孕妇焦虑与抑郁增加更明显。这提示了HT可能是导致孕妇情绪改变的一个关键因素,推测其机制可能与脑内Glu水平相关。有报道[10]进一步表明HT可能导致大脑失衡,其机制可能是抗TPOAb水平与T淋巴细胞的细胞因子相关。T淋巴细胞产生的细胞因子包括肿瘤坏死因子α和干扰素γ显著增加,这些炎性因子可能通过改变其自身的合成,释放和再摄取影响神经递质Glu的水平。
Glu转运体能摄取转运Glu,保护神经元免受谷氨酸能过度信号传递产生的兴奋性毒性,其表达降低,可造成Glu堆积在突触间隙[5]。Glu转运体分为VGLUTs与EAATs。研究[11]显示,突触间隙中的Glu浓度由介导Glu胞吐释放的VGLUTs和增加Glu再摄取的EAATs调节。VGLUTs能特异性地将神经元胞质内的Glu转运至突触囊泡内,其主要分布于囊泡膜上,有3种亚型(VGLUT 1-3),VGLUT 1最重要[5,12]。EAATs有5种亚型(EAAT 1-5),其中EAAT 2主要表达于神经元及神经胶质细胞膜上,以高亲和力运输Glu,负责将Glu从突触间隙中清除,维持低水平的细胞外Glu[5,13]。本研究中Western blot法表示,HT组额叶中VGLUT 1蛋白表达水平较CON组降低。RT-qPCR结果显示,与CON组相比,HT组VGLUT 1的mRNA表达降低。2种方法中EAAT 2的蛋白表达水平与mRNA表达虽有下调趋势,但差异无统计学意义。有研究[12,14]发现,模拟严重抑郁症行为模型中,小鼠前脑VGLUT 1水平的降低,能引起Glu水平的增加。自身免疫性脑脊髓炎大鼠脊髓Glu摄取上调伴随着EAAT 2蛋白水平降低。本研究实验结果显示HT妊娠小鼠额叶内VGLUT 1表达水平降低,可能不能有效的将神经细胞产生和在摄取的Glu储存于突触囊泡内,导致神经细胞外Glu的堆积。
综上所述,HT可导致孕鼠额叶Glu含量升高,Glu转运体VGLUT 1蛋白表达下降。该结果提示HT可导致Glu代谢紊乱,为妊娠HT患者的情绪障碍提供一定的理论依据。
