白藜芦醇通过调控IL-6/JAK2/STAT3信号通路对卵巢癌SKOV-3细胞增殖、凋亡、迁移和侵袭的影响
2020-06-11李根林余芙蓉
李根林,刘 杰,谢 晶,余芙蓉,胡 意
卵巢癌是女性生殖系统中第三常见的癌症类型,死亡率在女性生殖系统恶性肿瘤中最高,5年生存率仅约30%~ 40%。卵巢癌以腹腔内浸润和转移为特征,晚期临床常有多处远处转移[1]。白细胞介素6(interleukin 6, IL-6)是一种重要的炎症因子,它与细胞膜上的IL-6受体结合,激活多种下游途径,如JAK2/STAT3和PI3K/AKT途径。JAK2/STAT3途径是一种从膜到核的信号转导途径。JAK2蛋白激酶的激活可以催化STAT3蛋白磷酸化进入细胞核,从而调节上皮间充质转化(epithelial-mesenchymal transition,EMT)相关基因和其他基因的表达[2]。已有研究[3]发现,IL-6/JAK2/STAT3通路的过度激活可以促进肿瘤细胞的EMT。已发现天然植物提取物对抗肿瘤具有良好治疗功效,且不良反应少。白藜芦醇(resveratrol,Rev)作为典型的天然植物抗毒素,能有效抑制与癌症生长和进展相关的多种细胞行为[4]。且该植物抗毒素化合物能通过未知机制下调锌指转录因子Slug表达来抑制癌细胞EMT[5]。故现利用Rev处理卵巢癌SKOV-3细胞来探讨其通过调控IL-6/JAK2/STAT3信号通路对卵巢癌细胞增殖、凋亡、迁移、侵袭的影响。
1 材料与方法
1.1 细胞株及主要试剂人卵巢癌SKOV-3细胞购自北京BNCC;McCOY’S 5A培养基、胎牛血清以及胰酶均购自美国Gibco公司;结晶紫染液购自北京Solarbio公司;BCA蛋白浓度测定试剂盒(增强型)购自上海碧云天生物技术公司;B淋巴细胞瘤-2蛋白(B lymphoma-2,Bcl-2)、Bcl-2家族促凋亡蛋白(Bcl-2 family apoptotic proteins,Bax)、活化的半胱氨酸的天冬氨酸蛋白水解酶3(cleaved Caspase-3)、钙黏着蛋白E(Ca2+dependent cell adhesion moleculue family-E,E-cadherin)、N-cadherin、波形蛋白(Vimentin)、β-连环蛋白(β-catenin)、IL-6、酪氨酸激酶(tyrosine kinase,JAK2)、信号传导及转录激活因子(signal transduction and activator of transcription,STAT3)、GAPDH一抗以及辣根过氧化物酶标记的山羊抗兔IgG二抗均购自英国Abcam公司。
1.2 细胞培养及药物处理将人卵巢癌SKOV-3细胞悬浮于含有10%胎牛血清和1%胰岛素双抗的McCOY’S 5A培养基中,将培养基置于37 ℃、5% CO2的恒温培养箱培养。将培养好的人卵巢癌SKOV-3细胞分为人卵巢癌SKOV-3细胞空白组(CON组)、白藜芦醇低浓度(1.0×106mol/L)组(Rev-L组)、 白藜芦醇中浓度(5.0×106mol/L)组(Rev-M组)、白藜芦醇高浓度(2.50×105mol/L)组(Rev-H组)[6]。药物处理24或48 h后,收集各组细胞待后续检测。
1.3 CCK-8法检测卵巢癌SKOV-3细胞的增殖按照每孔2×104个细胞将制备好的人卵巢癌SKOV-3细胞悬液接种到96孔板中,每孔约100 μl细胞悬液,每组设置3个重复孔。将培养板放入37 ℃培养箱中培养,待细胞在培养板上贴壁后,加入含10 % CCK-8的培养基溶液进行换液,继续培养4 h后,将培养板取出,测定450 nm波长处的吸光度(optical density, OD)值。药物处理24 h后检测1次,药物处理48 h后检测1次。
1.4 流式细胞术检测卵巢癌SKOV-3细胞的凋亡收集各组细胞,分别用预冷的4%多聚甲醛固定细胞10 min,用PBS溶液洗涤2次。在室温(25 ℃)下用0.25%的含EDTA胰蛋白酶消化液消化细胞。收集细胞培养基,1 000 r/min离心5 min,再用PBS轻轻悬浮细胞。将1×106个细胞/ml悬浮,300 r/min 离心10 min,在100 μl细胞悬浮液中加入5 μl膜联蛋白V-FITC,室温下保持10 min。在室温下加入5 μl的PI染液保持5 min,再加入500 μl PBS溶液,1 h内上机进行流式细胞术检测细胞凋亡。
1.5 细胞划痕法检测卵巢癌SKOV-3细胞的迁移能力在6孔培养板中以1×105个细胞/孔的密度培养各组细胞,加入无血清培养液放置在37 ℃培养箱中培养24 h。再用枪头比着直尺垂直沿同一方向刮伤,用PBS洗涤细胞3次,在37 ℃、5% CO2恒温培养箱中培养36 h后,在显微镜下拍摄结果照片。
1.6 Transwell法检测卵巢癌SKOV-3细胞的侵袭能力用无血清培养基将预冷的基底膜稀释,将稀释了的基底膜加入Transwell板上室,覆盖整个聚碳酯膜,在37 ℃培养箱中孵育30 min使之形成凝胶。在下室中添加750 μl含有10% FBS的DMEM,在上室中添加1×105个细胞/孔的细胞悬液。培养48 h后,用甲醇固定细胞,加入0.1%结晶紫染色10 min,然后用PBS洗涤2次,再用棉球擦去表面细胞,放在显微镜下观察。
1.7 Western blot法检测卵巢癌SKOV-3细胞凋亡、迁移以及IL-6/JAK2/STAT3通路相关蛋白收集每组细胞,加入裂解液充分裂解后,在4 ℃的离心机中12 000 r/min离心15 min,取上清液分装于0.5 ml离心管中。BCA蛋白浓度测定试剂盒(增强型)对蛋白质进行定量。将蛋白质样品(约20 μg)在沸水浴中处理10 min,在常温离心机中12 000 r/min 离心5 min后去除上清液。将制备的样品加入到12%的SDS-PAGE胶中,120 V电泳50 min,直到溴酚蓝接近分离凝胶的底部,完成电泳。再用湿转法将分离出的蛋白质转移到PVDF膜上。用5%BSA封闭液室温封闭1 h,然后加入一抗Bax(1 ∶1 000)、Bcl-2(1 ∶1 000)、cleaved Caspase-3(1 ∶500)、E-cadherin(1 ∶500)、N-cadherin(1 ∶1 000)、Vimentin(1 ∶1 000)、IL-6(1 ∶500)、p-JAK2(1 ∶1 000)、p-STAT3(1 ∶2 000)及GAPDH(1 ∶10 000)在4 ℃下封闭过夜。再用Tris-HCl/Tween 20(TBST)冲洗3次后,加入辣根过氧化物酶标记的山羊抗兔抗体IgG(1 ∶2 000)室温下孵育1 h,然后用TBST洗涤3次。将膜浸入ECL工作溶液中,2 min后曝光显色,并放在BIO RAD凝胶成像系统中观察灰度值,最后计算所测蛋白相对表达量。
2 结果
2.1 Rev抑制SKOV-3细胞增殖、促进细胞凋亡不同浓度Rev处理SKOV-3细胞24、48 h后,CCK-8检测结果(图1A)显示,与CON组比较,24、48 h的Rev-M和Rev-H组的SKOV-3细胞增殖能力降低(F=62.286,P<0.05;F=126.345,P<0.05),而Rev-L组与CON组比较差异无统计学意义(t=0.219,P>0.05;t=3.756,P>0.05)。流式细胞术检测结果(图1B)显示,与CON组比较,Rev-M和Rev-H组的SKOV-3细胞凋亡比例升高(F=135.400,P<0.05),而Rev-L组与CON组比较差异无统计学意义(t=1.566,P>0.05)。
2.2 Rev抑制SKOV-3细胞迁移侵袭能力不同浓度Rev处理SKOV-3细胞48 h后,细胞划痕实验(图2A)结果显示,与CON组比较,Rev-M和Rev-H组SKOV-3细胞迁移能力下降(F=41.570,P<0.05),而Rev-L组与CON组比较差异无统计学意义(t=2.844,P>0.05)。Transwell实验(图2B)结果显示,Rev-M和Rev-H组SKOV-3细胞的侵袭细胞数量低于CON空白组的SKOV-3细胞(F=36.803,P<0.05),而Rev-L组的SKOV-3的侵袭细胞数量与CON组的细胞数量差异无统计学意义(t=1.815,P>0.05)。

图1 Rev对SKOV-3细胞增殖和凋亡的影响
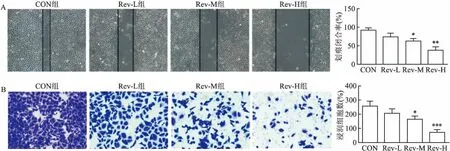
图2 Rev对SKOV-3细胞迁移和侵袭的影响 ×200
2.3 Rev上调Bax及cleaved Caspase-3且下调Bcl-2蛋白表达水平不同浓度Rev处理SKOV-3细胞48 h后,Western blot实验(图3)结果显示,与CON组比较,Rev-L、Rev-M和Rev-H组SKOV-3细胞中Bax(F=33.243,P<0.05)及cleaved Caspase-3(F=82.990,P<0.05)促凋亡蛋白表达水平上升,而Bcl-2(F=43.351,P<0.05)抑凋亡蛋白表达水平下降。

图3 Rev对SKOV-3细胞凋亡相关蛋白的影响
与CON组比较:*P<0.05,**P<0.01,***P<0.001
2.4 Rev上调SKOV-3细胞E-cadherin且下调N-cadherin、Vimentin及β-catenin蛋白表达水平不同浓度Rev处理SKOV-3细胞48 h后,Western blot实验(图4)结果显示,与CON组比较,Rev-L、Rev-M和Rev-H组SKOV-3细胞中E-cadherin(F=113.902,P<0.05)蛋白表达水平上升, Rev-M和Rev-H组中N-cadherin(F=40.920,P<0.05)以及Rev-L、Rev-M和Rev-H组中Vimentin(F=87.936,P<0.05)蛋白表达水平下降,而Rev-L组N-cadherin蛋白与CON组的表达差异无统计学意义(t=0.719,P>0.05)。

图4 Rev对SKOV-3细胞EMT相关蛋白的影响
与CON组比较:*P<0.05,**P<0.01,***P<0.001
2.5 Rev下调SKOV-3细胞IL-6/JAK2/STAT3通路蛋白活性不同浓度Rev处理SKOV-3细胞48 h后,Western blot实验(图5)结果显示,与CON组比较,Rev-M和Rev-H组SKOV-3细胞中IL-6(F=106.308,P<0.05)、p-JAK2(F=326.622,P<0.05)及p-STAT3(F=118.054,P<0.05)蛋白表达水平降低,而Rev-L组SKOV-3细胞中的通路蛋白IL-6(t=0.995,P>0.05)、p-JAK2(t=1.090,P>0.05)及p-STAT3(t=2.145,P>0.05)蛋白表达水平与CON组比较差异无统计学意义。
3 讨论
Rev是一种天然的非黄酮类多酚化合物,主要存在于葡萄、藜芦和日本野杂草等植物中。Rev吸收良好,代谢迅速,主要通过尿液排出。Rev具有多种治疗功效,包括抗感染、抗氧化、抗肿瘤、心血管保护和促进生殖功能[7]。据报道[8],Rev通过调节产生炎症介质的酶和途径表现出抗感染活性。一些研究表明,Rev抑制许多癌症的肿瘤发生和转移,包括乳腺癌、前列腺癌和胰腺癌。已有的研究[9]表明Rev具有抗肿瘤和抗转移的特性。EMT在肿瘤中通过降低肿瘤细胞间的黏附性,分泌大量细胞因子,促使细胞发生侵袭和迁移,已被证实EMT可以增强上皮癌细胞的侵袭、转移以及抗凋亡3种恶性潜能[10]。研究[11]显示,Rev通过下调EMT转录因子来抑制各种癌细胞EMT,如Rev通过降低Snail和Vimentin的表达来抑制EGF诱导的乳腺癌MCF-7细胞EMT。另外Rev也能抑制顺铂处理后的卵巢癌细胞的EMT[12]。本研究以人卵巢癌SKOV-3细胞为研究对象,结果表明Rev能抑制卵巢癌细胞迁移和侵袭,与之前的研究结果类似。不仅如此,本研究还显示Rev对人卵巢癌SKOV-3细胞的增殖凋亡水平有影响,能抑制SKOV-3细胞增殖,促进细胞凋亡水平。由此可见Rev对人卵巢癌SKOV-3细胞的多种生物学行为的改变起重要作用,但相关的作用机制不甚清楚。

图5 Rev对SKOV-3细胞IL-6/T3JAK2/STAT通路蛋白的影响
与CON组比较:*P<0.05,***P<0.001
IL-6是一种由癌相关成纤维细胞释放的促炎细胞因子,其与卵巢癌细胞的侵袭性和转移性行为有关。IL-6与特定受体复合物的结合激活下游激酶的磷酸化和核定位[13]。STAT3被广泛认为是一种能上调许多增殖或抗凋亡基因(如Cyclind1和Bcl-2)的癌基因,其在促进促癌炎症途径中具有主导作用[14]。IL-6/JAK2/ STAT3在肿瘤的发生发展过程中具有重要调控意义,而Rev和IL-6以相反的方式影响mRNA的表达,并参与细胞运动和细胞外基质重塑的miRNA的表达,进而影响卵巢癌细胞的侵袭性。因此本研究从IL-6着手,探讨IL-6/JAK2/ STAT3信号通路是否参与Rev对人卵巢癌SKOV-3细胞生物学行为的影响。目前的数据表明,Rev通过表观遗传机制诱导其抗肿瘤作用,并支持其纳入高度侵袭性卵巢癌的化疗方案[15]。本研究的细胞划痕和Transwell实验证实,Rev可以有效抑制卵巢癌SKOV-3细胞的迁移和侵袭,并且Rev处理后,SKOV-3细胞的IL-6、JAK2/STAT3磷酸化水平均受到了抑制,说明Rev可能通过下调IL-6/JAK2/STAT3信号通路活性进而促进细胞凋亡,抑制细胞增殖、侵袭、迁移能力。
综上所述,Rev对人卵巢癌SKOV-3细胞具有抑制细胞增殖作用和促细胞凋亡作用;同时还能有效抑制卵巢癌SKOV-3细胞的迁移和侵袭,这与IL-6/JAK2/STAT3信号通路的失活相关,具有重要临床治疗意义。
