丙戊酸钠对肺腺癌细胞的增殖、迁移能力的影响
2020-06-11代丽丽沈继龙
代丽丽,束 军, 朱 宁,张 梅,沈继龙
癌细胞在有氧条件下能加速葡萄糖消耗,增加乳酸积累,这种现象被称为有氧糖酵解[1],可刺激关键酶如乳酸脱氢酶(lactic dehydrogenase,LDH)等的合成增加,在多种肿瘤中发现了异常的LDH表达[2-5],抑制LDH可以抑制肿瘤的进展[4,6]。丙戊酸钠(sodium valproate,VPA)在多种癌症中发挥抗癌作用,VPA可抑制肝癌细胞的上皮间质转化(epithelial-mesenchymal transition,EMT)[7],VPA通过抑制有氧糖酵解抑制神经母细胞瘤的进展[8],然而,VPA与肺腺癌PC9细胞的研究鲜有报道,与其有氧糖酵解及EMT的关系尚不清楚,该实验旨在研究VPA是否能抑制PC9细胞的增殖迁移能力及其可能的机制。
1 材料与方法
1.1 实验主要试剂与仪器人肺腺癌PC9细胞购自上海生命科学院;酶联免疫检测仪购自美国Biotek公司;VPA购自大连美仑生物技术有限公司;CCK-8试剂盒(c0039)、胰酶购自上海碧云天生物技术有限公司;胎牛血清购自杭州四季青生物技术有限公司;DMEM低糖培养基购自美国HyClone公司;LDH试剂盒(A020-1-2)、LD试剂盒(A019-2)购自南京建成生物工程研究所;人E-钙黏蛋白(E-cadherin,E-cad)ELISA 试剂盒(CSB-E04519h)、人波形蛋白(vimentin,VIM)ELISA 试剂盒(CSB-E08982h)购自武汉华美生物公司。
1.2 实验方法
1.2.1细胞培养 用DMEM低糖培养基常规培养人肺腺癌PC9细胞,用37 ℃、5% CO2的细胞培养箱,胎牛血清的浓度为10%,细胞呈贴壁生长,每2~3 d传代1次。
1.2.2CCK-8法检测VPA对PC9细胞增殖能力的影响 待细胞密度达到5×104个/ml时,在96孔培养板的每孔中加入100 μl细胞悬液,细胞贴壁后,加入2 ml含不同浓度的VPA(0、2、4、8、16 mmol/L)的培养基,每组设5个复孔。分别作用24、48 h后,每孔加入10 μl CCK-8试剂,调整酶联免疫检测仪波长为450 nm,分别于0.5、1、2、3、4 h检测吸光度(optical density,OD)值。计算各组增殖抑制率,抑制率(%)=[1-实验组OD值]/对照组OD值×100%,实验均重复3次。
1.2.3用划痕实验检测VPA对PC9细胞体外迁移能力的影响 在6孔板背面每隔0.5~1 cm划一条横线,加入PC9细胞,待细胞长满时用200 μl枪头垂直于横线划痕。弃原培养基后,加无血清的培养基,使用显微镜拍照,为0 h的划痕宽度,弃无血清培养基,加入2 ml含不同浓度的VPA(0、2、4、8、16 mmol/L)的培养基,24 h后使用倒置显微镜在和0 h拍照位置同样的位置拍照,用Image-pro plus 6.0软件计算迁移距离,迁移距离=0 h距离-24 h距离。
1.2.4乳酸脱氢酶活性检测试剂盒检测VPA对LDH活性的影响 将PC9细胞接种于6孔板,浓度调整为2×105个/ml,待细胞密度约60%~70%后,弃原培养基,加入2 ml含不同浓度的VPA(0、2、4、8、16 mmol/L)的培养基,24 h后弃去培养液,消化离心,将离心后的细胞加入裂解液,室温放置1 h后将其置于-80 ℃冰箱15 min,后迅速放入37 ℃水浴锅5 min,反复操作3次。后放入离心机离心,将上清液移至EP管中备用。按照LDH测试盒说明书中的操作步骤分别进行加样后,用酶联免疫检测仪在波长为440 nm时测定OD值,计算出LDH活性,计算公式为:LDH活性=(测定OD值-对照OD值)/(标准OD-空白OD值)×标准品浓度(2 mmol/L)×N×1 000(N为样本稀释倍数)。
1.2.5乳酸定量试剂盒检测VPA对LD生成量的影响 将PC9细胞接种于6孔板,浓度为2×105个/ml,待细胞贴壁密度60%~70%后,弃原培养基,加入2 ml含不同浓度的VPA(0、2、4、8、16 mmol/L)的培养基,24 h后,将上清液离心,离心机参数为4 ℃、3 000 r/min,离心20 min,将上清液备用。按照LD测试盒说明书中的操作步骤分别进行加样后,用酶联免疫检测仪在波长为530 nm时测定OD值,计算出LD生成量,计算公式为:培养液中的乳酸含量(mmol/L)=(测定OD值-空白OD值)/(标准OD值-空白OD值)×标准品浓度(3 mmol/L)×样本测试前稀释倍数。
1.2.6人E-cad及VIM酶联免疫吸附测定试剂盒检测细胞上清液及细胞内E-cad及VIM的浓度 按1.2.4及1.2.5方法制备待测样本后,按照酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒说明书进行操作后用酶联免疫检测仪在450 nm 波长依序测量各孔的OD 值,计算出蛋白含量,计算方法为:以标准物的浓度为横坐标,OD 值为纵坐标,在坐标纸上绘出标准曲线,根据样品的 OD值由标准曲线查出相应的浓度,再乘以稀释倍数。
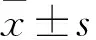
2 结果
2.1 VPA抑制PC9细胞的增殖CCK-8法检测结果显示,不同浓度的VPA分别干预24、48 h后,实验组与对照组相比,差异均有统计学意义(P<0.05)。在同样的作用时间,VPA浓度越大,其对PC9细胞的增殖抑制率越高,差异有统计学意义(P<0.05);在同样浓度的VPA作用下,VPA作用时间越长,其对PC9细胞的增殖抑制率越高,差异有统计学意义(P<0.05)。24 h时(F=162,P<0.05);48h时(F=145,P<0.05)。综上,VPA对PC9细胞的增殖抑制作用有浓度依赖性和时间依赖性,见图1。

图1 VPA对PC9细胞抑制率的影响
与0 mmol/L对照组比较:*P<0.05;与2 mmol/L实验组比较:#P<0.05;与4 mmol/L实验组比较:&P<0.05;与8mmol/L实验组比较:★P<0.05;与24 h比较:▲P<0.05
2.2 VPA抑制PC9细胞的迁移与对照组比较,VPA浓度越高,迁移距离越少,各实验组间差异有统计学意义(F=133,P<0.05),见图2。
2.3 VPA抑制LDH活性不同浓度的VPA(0、2、4、8、16 mmol/L)作用24 h后,VPA浓度越高,LDH活性越低,0、2、4、8、16 mmol/L每两组之间比较差异均有统计学意义(F=157,P<0.05)。见表1。
2.4 VPA抑制LD生成不同浓度的VPA(0、2、4、8、16 mmol/L)作用于细胞24 h后,VPA浓度越高,乳酸生成量越低,0、2、4、8、16 mmol/L每两组之间比较差异均有统计学意义(F=289,P<0.05)。见表1。

图2 VPA对PC9细胞迁移能力的影响 ×100
A:对照组;B~E: VPA 2、4、8、16 mmol/L;1:0 h;2:24 h;与0 mmol/L对照组比较:*P<0.05;与2 mmol/L实验组比较:#P<0.05;与4 mmol/L实验组比较:&P<0.05;与8 mmol/L实验组比较:★P<0.05

表1 不同浓度的VPA分别干预PC9细胞对其LDH活性、LD生成量、上清液及细胞内E-cad、VIM的影响
与0 mmol/L对照组比较:*P<0.05;与2 mmol/L实验组比较:#P<0.05;与4 mmol/L实验组比较:&P<0.05;与8 mmol/L实验组比较:★P<0.05;与上清液中E-cad含量比较:■P<0.05;与上清液中VIM含量比较:▲P<0.05
2.5 VPA促进E-cad生成不同浓度的VPA(0、2、4、8、16 mmol/L)作用于细胞24 h后,VPA浓度越高,E-cad含量越高,0、2、4、8、16 mmol/L每两组之间比较差异均有统计学意义,上清液中E-cad含量(F=235,P<0.05),细胞内E-cad含量(F=268,P<0.05)。见表1。
2.6 VPA抑制VIM生成不同浓度的VPA(0、2、4、8、16 mmol/L)作用于细胞24 h后,VPA浓度越高,VIM含量越低,0、2、4、8、16 mmol/L每两组之间比较差异均有统计学意义,上清液中VIM含量(F=180,P<0.05),细胞内VIM含量(F=149,P<0.05),见表1。
3 讨论
在所有癌症中,肺癌的发病率和死亡率均居前列。在2019年180万新发癌症病例中,肺癌占12.9%,占癌症相关死亡病例的19.4%[9]。既往已有的治疗方式很多,但患者的预后仍需进一步改善。新开发药物需要耗费很多的财力和时间,探索已有的药物是否有抑制肿瘤作用成为一个新的方向。
VPA作为一种组蛋白去乙酰化酶抑制剂(HDACIs),已被广泛应用于治疗癫痫症等疾病。组蛋白去乙酰化酶通过组蛋白的去乙酰化,使DNA更紧地缠绕在组蛋白上,导致与细胞分化、细胞周期阻滞等蛋白的表达受到抑制引起癌症,HDACIs能恢复这些癌症抑制因子的表达达到抑制肿瘤的目的[10]。VPA可以抑制多种癌症的发展,Xu et al[11]证明VPA诱导甲状腺癌细胞凋亡和自噬,Fanian et al[12]证明 VPA通过抑制MMP-2抑制甲状腺癌细胞的迁移和侵袭,Fang et al[8]证明VPA通过抑制有氧糖酵解抑制神经母细胞瘤的进展。但VPA与PC9的相关研究目前鲜有报道,本研究旨在探讨不同浓度VPA对肺腺癌PC9细胞增殖、迁移能力的影响及可能的机制。结果表明,不同浓度的VPA可以抑制PC9细胞的增殖和迁移,VPA浓度越高,抑制作用越明显,同时与对照组相比,VPA浓度越高,LDH活性及LD生成量越少,说明VPA抑制了有氧糖酵解。VPA对PC9细胞的增殖和迁移的抑制与对有氧糖酵解的抑制呈现一致性,提示VPA有可能通过抑制有氧糖酵解途径抑制PC9细胞的增殖和迁移。
EMT在肿瘤细胞发生侵袭和转移时发挥重要的作用,EMT的标志物很多,其中上皮标志物E-cad和间质标志物VIM较为典型,发生EMT时,E-cad含量降低,VIM的含量增高[13],本研究中,ELISA的结果表明,随着VPA浓度增加,实验组细胞培养上清液中和细胞内E-cad蛋白浓度均逐渐增高,VIM蛋白浓度均逐渐降低,这表明VPA可以抑制EMT的进展,这与许多研究[4,12]结果相符。
Hou et al[2]在肺癌中检测到LDH高表达,敲低肺癌细胞中的LDH-A可抑制癌细胞的增殖、侵袭,且敲低前后E-cad的表达水平上调,而VIM的表达水平下调,证明了LDH可以调节EMT,同样的Jiang et al[4]证明膀胱癌中检测到LDH高表达,敲低LDH后,VIM、N-cad、snail下调,而E-cad上调,表明抑制LDH抑制EMT,与之一致,由此笔者猜想VPA可能是通过抑制LDH活性来抑制EMT从而抑制肺癌细胞的增殖、迁移,其中的机制仍然需要进一步的研究。
综上所述,本实验表明VPA可以抑制PC9细胞的增殖、迁移,但是VPA在体内的抗肿瘤作用、对正常支气管上皮细胞的影响及具体的作用机制仍需进一步的研究。
