TGFβ1-Sp1信号通路靶向调控豚鼠巩膜成纤维细胞分泌与合成胶原表达的研究
2020-06-11应充慧朱子诚孙思勤
应充慧, 朱子诚,孙思勤,张 楚
转化生长因子-β1(transforming growth factor-β, TGF-β1)参与近视巩膜重塑[1],转录因子特异性蛋白1(specificity protein 1,Sp1)被认为是TGF-β1下游能标靶调节I型胶原的合成和降解的蛋白[2-3],但Sp1是否在巩膜成纤维细胞中表达、是否参与了Ⅰ型胶原的合成与降解、在近视巩膜重塑中的具体功能为何均未见报道。该研究拟通过豚鼠巩膜成纤维细胞,利用免疫组化、qRT-PCR等分子生物学技术研究成纤维细胞内TGF-β1-Sp1对I型胶原蛋白表达的影响、探明TGF-β1-Sp1信号通路在巩膜重塑过程中的功能,进而为靶向TGF-β1-Sp1信号通路调控巩膜成纤维细胞生成与合成胶原蛋白提供实验数据,为开发近视治疗手段提供科学依据。
1 材料与方法
1.1 材料
1.1.1实验动物 随机选用出生7 d左右、100~140 g的健康新生三色豚鼠10只,由中国科技大学第一附属医院动物实验中心提供,雌雄不限。
1.1.2主要试剂 DMEM培养液、胎牛血清(美国GIBCO公司);TGFβ1(美国Sigma公司);TGFβ1抑制剂(SB-431542)、Sp1抑制(Plimcamycin)(美国MCE公司);Sp1抗体(1 ∶150)(21962-1-AP)、Ⅰ型胶原抗体(1 ∶150)(14695-1-AP)(武汉三鹰生物技术有限公司);免疫组化二抗通用型PV6000(北京中杉金桥公司)。
1.2 方法
1.2.1培养豚鼠巩膜成纤维细胞 首先在无菌条件和操作下取出豚鼠眼球,用PBS液漂洗眼,沿角膜缘的切口切除角膜并去除晶状体、玻璃体、视网膜、色素上皮-脉络膜组织。分离后的巩膜组织,将其裁剪成1 mm2的组织块,PBS液再洗3次,接种于25 cm培养瓶壁上, 组织块间距0.3~0.5 cm,置于37 ℃、50 ml/L CO2的培养箱中使组织块贴壁。静置2 h后,加入含体积分数15%胎牛血清及双抗溶液的DMEM培养液。使培养液与组织块接触。每3~5 d换液1次。当细胞密度达到80%时进行传代,用浓度为0.25%胰蛋白酶消化,加入2 ml新的完全培养基重悬细胞,轻轻将细胞吹打混匀后,分装成2或3瓶作传代培养。取3代细胞分成4组,第1组加入最终浓度10 ng/ml的TGFβ1,第2组加入浓度10 ng/ml的TGFβ1+100 ng/ml的TGFβ1抑制剂,第3组加入浓度10 ng/ml的TGFβ1+100 ng/ml的Sp1蛋白抑制剂,第4组为空白对照组。
1.2.2免疫组织化学染色细胞鉴定及检测豚鼠巩膜中Sp1和Ⅰ型胶原蛋白的表达 分别从4组中取细胞制细胞爬片,在培养箱中培养2 d,PBS重复浸洗2 min共3次,冰丙酮固定10 min。PBS浸洗 min,反复3次,含3% H2O2的甲醛室温下用 30 min,以封闭内源性酶,0.1%胰蛋白酶室温下消化5 min,滴加相应一抗(滴度为1 ∶50)湿盒内4 ℃过夜,复温后,滴加相应二抗孵育30 min,以上每次加均用PBS浸洗2 min,反复3次,然后用DAB显色,苏木精复染。观察Sp1蛋白、Ⅰ型胶原蛋白、波形蛋白的表达。
1.2.3qRT-PCR检测细胞内TGFβ1-Sp1对Ⅰ型胶原的表达 分别将4组处理后的的细胞根据说明提取总RNA,测定浓度和纯度后,按试剂盒说明进行逆转入,得到逆转录cDNA,存于-80 ℃备用。以cDNA作为模板进行PCR扩增。PCR反应条件:95 ℃预变性5 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸40 s,共35 个循环;72 ℃延伸10 min,4 ℃延伸10 min后保存。PCR产物进行电泳,凝胶成像系统观察结果并进行拍照,为了确保准确性,所有实验进行了至少3次。实验中引物核苷酸序列Sp1:上游引物5’-CTCAAAGGAACAGAGTGGCA-3’,下游引物5’-GAGCTGGGAGTCAAGGTAGC-3’;Ⅰ型胶原:上游引物:5’-ACAAGCGATTACACACCCAA-3’,下游引物:5’-TTAGTTTCCTGCCTCTGCCT-3’。
1.2.4各组中豚鼠巩膜成纤维细胞中的Sp1和Ⅰ型胶原的蛋白表达检测 4组中分别加入细胞裂解液裂解,提取每组中的总蛋白,BCA法测量巩膜组织蛋白浓度,采用Western blot法测定巩膜组织中Sp1和Ⅰ型胶原蛋白表达水平,以Sp1抗体为一抗、Ⅰ型胶原抗体为一抗,β-actin为内参。采用 Quantity One软件进行条带灰度分析,Sp1蛋白相对表达水平=Sp1蛋白条带灰度值/β-actin条带灰度值,Ⅰ型胶原蛋白相对表达水平=Ⅰ型胶原蛋白条带灰度值/β-actin条带灰度值。
1.2.5判断标准 免疫组化染色爬片采用双盲法阅片。Sp1蛋白及Ⅰ型胶原免疫组化染色阳性产物为棕黄色细颗粒状。采用半定量标准,每例随机观察 10个高倍视野,通过计算阳性细胞数及记录细胞的染色深浅对其进行评价:阳性细胞数≤10%为0分,11%~25%为1分,26%~50% 为 2 分,51% ~75% 为 3 分,≥76%为4分; 按阳性细胞的着色强度计分:无阳性着色或与背景均匀一致的淡黄色为0分,浅棕黄色为1分,棕黄色为2分,棕褐色为3分。最后将两项积分相乘:0 分为(-) ,1~4 分为(+) ,5~8 分为中度阳性() ,9~12 分为() 。结果重复观察2次,计分不一致者需再次观察确认。
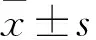
2 结果
2.1 细胞形态学观察组织块培养 4~5 d后可发现有细胞从组织块中爬出并开始贴壁, 细胞透明,形态为梭形, 胞体饱满、扁平而长突起 (图1)。细胞传3代后,可见细胞透明呈梭形,大小较一致,排列成不规则的栅栏状(图2)。
2.2 细胞鉴定成纤维细胞胞质可见大量波形蛋白表达,本试验鉴定结果为波形蛋白表达阳性,细胞浆中可见棕黄色染色(图3)。
2.3 巩膜成纤维细胞中Sp1蛋白和Ⅰ型胶原的表达各组细胞中均可见Sp1和Ⅰ型胶原蛋白的表达,可见棕黄色染色(图4)。TGFβ1组中细胞核内Sp1蛋白显色强于对照组(t=3.337,P<0.05);TGFβ1+TGFβ1抑制剂组中弱于对照组(t=4.163,P<0.05);TGFβ1+Sp1抑制剂组中比TGFβ1+TGFβ1抑制剂组强但比对照组弱(t=13.86,P<0.05)。TGFβ1组中细胞核内Ⅰ型胶原显色强于对照组(t=3.464,P<0.05);TGFβ1+TGFβ1抑制剂组中弱于对照组(t=4.434,P<0.05);TGFβ1+Sp1抑制剂组中比TGFβ1+TGFβ1抑制剂组强但比对照组弱(t=12.12,P<0.05)。见图5。

图1 原代培养的豚鼠巩膜成纤维细胞 ×200 图2 传3代的豚鼠巩膜成纤维细胞 ×200图3 免疫荧光化学检测波形蛋白阳性 ×200

图4 免疫组织化学染色检测各组Ⅰ型胶原和Sp1蛋白的表达 ×200
A:TGFβ1+TGFβ1组中的Ⅰ型胶原;B:TGFβ1+Sp1抑制剂组中的Ⅰ型胶原;C:空白对照组中的Ⅰ型胶原;D:TGFβ1中的Ⅰ型胶原;E:TGFβ1+TGFβ1组中的Sp1蛋白;F:TGFβ1+Sp1组中的Sp1蛋白;G:空白对照组中的Sp1蛋白;H:TGFβ1组中的Sp1蛋白

图5 各组中Sp1蛋白和Ⅰ型胶原的定量及相关性
A:空白对照组;B:TGFβ1组;C:TGFβ1+Sp1抑制剂组;D:TGFβ1+TGFβ1抑制剂组;与空白对照组比较:*P<0.05;与TGFβ1+TGFβ1抑制剂组比较:#P<0.05
2.4 豚鼠巩膜成纤维细胞中Sp1蛋白和Ⅰ型胶原的mRNA表达豚鼠巩膜成纤维细胞中均有Sp1和Ⅰ型胶原的mRNA表达阳性(图6、7)。TGFβ1组中Sp1蛋白mRNA表达量强于对照组(t=3.074,P<0.05);TGFβ1+TGFβ1抑制剂组中弱于对照组(t=4.330,P<0.05);TGFβ1+Sp1抑制剂组中比TGFβ1+TGFβ1抑制剂组强但比对照组弱(t=6.736,P<0.05)。TGFβ1组细胞中Ⅰ型胶原mRNA表达量强于对照组(t=2.882,P<0.05);TGFβ1+TGFβ1抑制剂组中弱于对照组(t=3.695,P<0.05);TGFβ1+Sp1抑制剂组中比TGFβ1+TGFβ1抑制剂组强但比对照组弱(t=5.092,P<0.05)。见图8。

图6 qRT-PCR检测各组豚鼠巩膜成纤维细胞中Sp1 mRNA的表达
M:标准蛋白分子量;1:空白对照组;2:TGFβ1+Sp1抑制剂组3:TGFβ1组;4:TGFβ1+TGFβ1抑制剂组

图7 qRT-PCR检测各组豚鼠巩膜成纤维细胞中Ⅰ型胶原的 mRNA的表达
M:标准蛋白分子量;1:空白对照组;2:TGFβ1+Sp1抑制剂组;3:TGFβ1组;4:TGFβ1+TGFβ1抑制剂组
2.5 豚鼠巩膜成纤维细胞中Sp1和Ⅰ型胶原的蛋白表达豚鼠巩膜成纤维细胞中均有Sp1和Ⅰ型胶原的蛋白表达阳性(图9)。TGFβ1组中Sp1和Ⅰ型胶原的蛋白表达量强于对照组(P<0.05);TGFβ1+TGFβ1抑制剂组中弱于对照组(P<0.05);TGFβ1+Sp1抑制剂组中比TGFβ1+TGFβ1抑制剂组强但比对照组弱(P<0.05)。

图8 各组中Sp1蛋白和Ⅰ型胶原的mRNA荧光定量及相关性
A:空白对照组;B:TGFβ1+Sp1抑制剂组;C:TGFβ1组;D:TGFβ1+TGFβ1抑制剂组;与空白对照组比较:*P<0.05;与TGFβ1+TGFβ1抑制剂组比较:#P<0.05
3 讨论
近视的发病机制尚未完全明了,多数学者认为近视是遗传因素和外部环境共同导致的;在生理改变上,近视的眼轴延长,与巩膜重塑密切相关,大量的基础研究实验和临床研究均表明巩膜生物力学性质的改变和细胞外基质的重塑、细胞类型的转变是导致眼球眼轴延长的主要原因[3]。巩膜中含量最多的是胶原纤维,占巩膜净重的90%,其中Ⅰ型胶原纤维在巩膜中占75%以上,在近视巩膜重塑中Ⅰ型胶原的表达量明显下降[4-5]。TGF-β1是一种多肽生长因子,存在于多种细胞和组织中,具有广泛的生物学活性,调控细胞增殖、分化、免疫监视等[6]。已有研究[7-8]认为TGFβ1是巩膜重塑中重要的转录因子,在巩膜组织中的表达可以促进Ⅰ型胶原的表达。本研究结果显示,在免疫组织化学染色法和逆转录PCR检测法中,TGFβ1组中的Ⅰ型胶原蛋白及其mRNA量较空白对照组表达增强,TGFβ1+TGFβ1组中较空白对照组减弱,从而可以推测在豚鼠巩膜成纤维细胞中TGFβ1与Ⅰ型胶原存在正相关性。
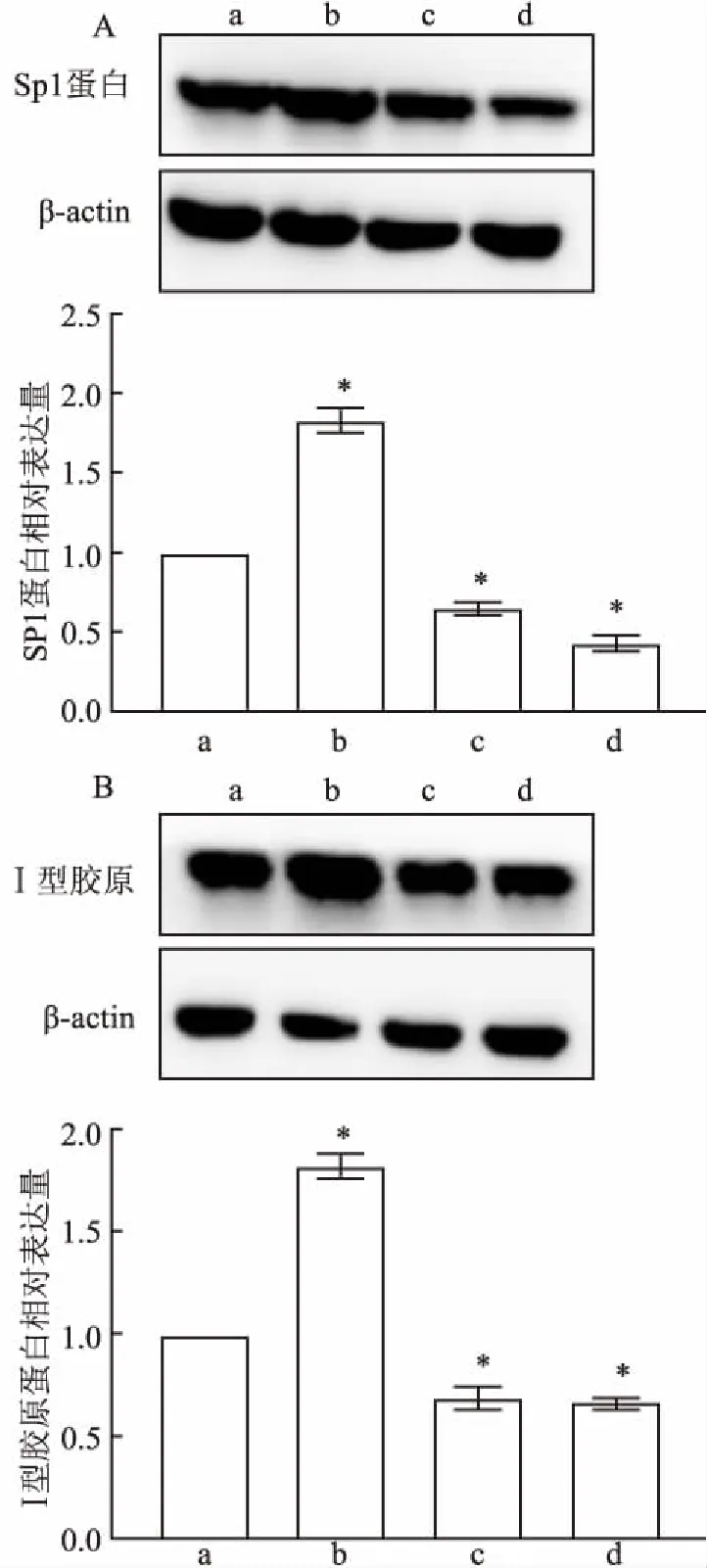
图9 Western blot法检测各组豚鼠巩膜成纤维细胞中Sp1和Ⅰ型胶原的蛋白表达
A:Sp1蛋白表达;B:Ⅰ型胶原的蛋白表达;a:空白对照组;b:TGFβ1组;c:TGFβ1+Sp1抑制剂组;d:TGFβ1+TGFβ1抑制剂组;与空白对照组比较:*P<0.05
转录因子Sp1在所有哺乳动物的细胞中有所表达,且Sp1调节多种细胞进程,包括细胞周期进程,增殖,生长,代谢和凋亡[9-10]。Martin-Gallausiaux et al[11]的研究中表明TGF-β1可与Sp1结合,并可激活转录因子Sp1。在Li et al[12]的研究中发现TGF-β1-Sp1信号通路在调节纤维化中起作用。已有研究[13-14]表明一定浓度的TGFβ1可以刺激转录因子Sp1的活化,并促进Ⅰ型胶原的表达。本项研究中显示,在免疫组织化学染色法和逆转录PCR检测法中,TGFβ1的细胞组中的Sp1和Ⅰ型胶原蛋白表达及mRNA量较空白对照组均增强;TGFβ1+TGFβ1抑制剂组较空白对照组均减弱;TGFβ1+Sp1抑制剂组中较空白对照组均减弱,但比TGFβ1+TGFβ1抑制剂组均增强。进而表明豚鼠巩膜成纤维细胞中TGFβ1与Sp1存在正相关性。Sp1的表达及mRNA的量与1型胶原的表达及mRNA的量成高度正相关,这说明Sp1与1型胶原在豚鼠巩膜成纤维细胞中的变化趋于一致,进而推测TGFβ1可能通过Sp1来调控Ⅰ型胶原的合成和降解。
在本研究中,TGFβ1+Sp1抑制剂组中Sp1和Ⅰ型胶原蛋白的表达及mRNA量较空白对照组均减弱,但比TGFβ1+TGFβ1抑制剂组的均增强。这一现象可能是TGFβ1存在其他信号通路调控Ⅰ型胶原合成所造成的,具体还存在何种信号通路目前尚不清楚,需要进一步的研究。
