肾衰泄浊汤及其拆方对周细胞-肌成纤维细胞转分化相关蛋白的影响
2020-06-09万鸣宏罗富里晏子友
万鸣宏 罗富里 晏子友
1江西中医药大学(南昌330006);2江西中医药大学附属医院(南昌330006)
许多慢性肾脏病进入肾衰竭阶段都伴有肾间质纤维化(renal interstitial fibrosis,RIF)的病理改变,严重危害患者健康。目前治疗方法多为抑制RIF的发展,达到延缓慢性肾脏病进展的治疗初衷。周细胞-肌成纤维细胞转分化(pericyte-myofibroblast transition,PMT)是RIF 形成过程中的重要环节[1-2]。周细胞是一种血管壁细胞,研究表明,肾脏中存在大量周细胞,而周细胞与肾脏病关系密切,例如间质纤维化和糖尿病肾病[3]。周细胞可调节微血管的稳定性与渗透性、调节血管的新生与成熟,并且还是一种具有多种分化潜能的干细胞,可以分化成成纤维细胞等[4]。研究表明肾损伤后周细胞与肌成纤维细胞(myofibroblast,MF)的形成密切相关[5]。周细胞与内皮细胞分离使肾小管周围毛细血管稳定性下降,导致肾小管血流量减少、供血不足以及细胞外基质(extracellular matrix,ECM)沉积,促进RIF 形成[6]。研究表明,α-平滑肌肌动蛋白(α-SMA)可作为MF的标记物,且α-SMA的表达量与ECM的表达量呈正相关[7]。血小板衍生生长因子受体(PDGFR)主要表达于周细胞、肾小球系膜细胞等[8],且血小板衍生生长因子(PDGF)信号通路对周细胞的募集及转分化非常重要[9]。此外还有研究发现,干预PDGF 信号通路可使肾脏中周细胞数量下降,α-SMA表达水平降低[10]。PDGF 通路的激活使神经/胶质细胞2型硫酸软骨素糖蛋白(NG-2)胶质细胞增多,NG-2的表达增加[11]。肾衰泄浊汤根据RIF的中医病机“虚、湿、瘀、毒”进行研制,本课题组之前的研究结果表明肾衰泄浊汤具有延缓慢性肾衰竭的作用[12-13]。但机制尚不明确。本研究建立单侧输尿管梗阻(UUO)大鼠模型,观察肾衰泄浊汤及其拆方干预PMT 过程中相关蛋白PDGFR-β、NG-2、α-SMA表达的程度,讨论肾衰泄浊汤及其拆方对PMT的影响,为临床上防治RIF 提供治疗依据。
1 材料与方法
1.1 实验动物选取1个月龄健康雌性SD 大鼠(SPF级)96只,体质量180~190 g[浙江省医学科学院实验动物中心培养,合格证号SCSK(浙)20170001]进行实验。
1.2 药物及试剂将实验所需中药(由江西中医药大学中药饮片厂提供)常规水煎、浓缩,制成肾衰泄浊汤浓缩剂,浓缩剂每1 mL 含生药量1.2 g(剂量均相当于每1 kg 成人剂量10倍,依据沈映君《中药药理学》中药实验用药换算大鼠用药剂量换算)。中药组及贝那普利组均按《中药药理学》给药。各中药组组成:补虚方组(生黄芪30 g、巴戟天10 g)、袪邪方组(生牡蛎30 g、蒲公英15 g、丹参15 g、生大黄(后下)10 g、槐花10 g)、肾衰泄浊汤组(生黄芪30 g、生牡蛎30 g、丹参15 g、蒲公英15 g、巴戟天10 g、生大黄10 g(后下)、槐花10 g)。水煎浓缩后真空密封包装,每袋150 mL,5℃冰箱保存备用。北京诺华制药有限公司提供贝那普利(商品名:洛丁新)。福州迈新生物技术开发有限公司提供DAB 显色试剂盒、免疫组化超敏SP 试剂盒、HE染色试剂盒、Masson染色试剂盒;北京中杉金桥生物技术有限公司提供磷酸缓冲液、柠檬酸缓冲液。
1.3 方法
1.3.1 分组与造模大鼠正常喂养7 d,取尿蛋白阴性大鼠用于实验。按体质量随机分为肾衰泄浊汤组、补虚方组、袪邪方组、贝那普利组、模型组、假手术组,每组16只。肾衰泄浊汤组、祛邪方组、补虚方组、贝那普利组、模型组建立UUO 动物模型,制作参照文献制作[14],假手术组不作处理。
1.3.2 动物给药肾衰泄浊汤组按照1.2 g/mL 比例配制肾衰泄浊汤浓缩剂给药,即剂量为12 g/(kg·d)体质量灌胃;祛邪方组按照0.6 g/mL、补虚方组按照0.6 g/mL 比例配制肾衰泄浊汤浓缩剂给药,即剂量为6 g/(kg·d)体质量灌胃;贝那普利组大鼠予以贝那普利1.5 mg/(kg·d)体质量灌胃;模型组及假手术组大鼠予等量生理盐水灌胃。术后7、14 d 随机选取大鼠8只,给药2 h 后腹主动脉取血并处死,立即将血液滴入含0.4 mL 4%EDTA-Na2的抗凝管中,250 g 离心10 min 并分离血清,存于-20℃冰箱内。
1.4 检测指标肾组织学检查:取标本后予4%福尔马林固定,脱水、石蜡包埋后切片,厚度大约为4 μm。行HE 及Masson染色后置于光镜下观察,进行UUO 肾小管损伤评估。
1.4.2 Western blot分析取150 mg 肾组织标本置于预冷的RIPA 裂解缓冲液中冰浴超声裂解,在4℃下按12 000 r/min 离心10 min,取上清液用Bradford 法测蛋白浓度。测完后分装蛋白并在95℃下煮沸10 min 使其变性,-20℃下保存,供Western blot 测定使用。使用抗体如下:α-SMA(1∶2 000)、NG-2(1∶1 000)、PDGFR-β(1∶500)、β-actin(1∶1 000),抗体均购自美国Santa Cruz公司。以βactin为内参照进行带灰度分析。将目标带与参考带的灰度比值作为蛋白质的相对表达,采用Image J 1.8 软件进行图片处理。北京普利莱生物科技有限公司提供RIPA 裂解液、Bradford 蛋白浓度测定试剂盒。
1.5 肾小管损伤程度评分及纤维化指数测定
1.5.1 HE染色分析光学显微镜单盲观察视野内肾小管病变(肾小管扩张、萎缩,红细胞管型、蛋白管型、肾间质水肿等)数目。肾小管损伤指数按Banff 分级(0~3级)计分评定。计分标准:无明显病理变化(肾小管病变数目0个)计0分;轻度病理改变(累及小管数目<3个)计1分;中度病理改变(累及小管数目3~5个)计2分;重度病理改变(累及小管数目>5个)计3 分。
1.5.2 Masson染色分析200倍视野下选取每只大鼠5 张组织切片,每张切片选取5个互不重叠的肾小管间质视野,观察视野中染色面积占总视野面积的百分比,并取平均值。评分标准:阳性面积<2%时计0分;阳性面积在2%~10%时计1分;阳性面积在11%~20%时计2分;阳性面积在21%~30%时计3分;阳性面积>30%时计4 分。
1.6 统计学方法实验所得数据用SPSS 23.0软件包处理、分析,数据结果用()表示,组间比较用方差分析与独立样本t检验。P<0.05时表示差异具有统计学意义。
2 结果
2.1 各组大鼠肾脏病理变化光镜下HE和Masson染色(图1-2)。术后第7、14 d时,除假手术组外,各组术后均有炎症表现;随梗阻时间延长,除假手术组外,各组可见纤维化,模型组更为明显,肾小管可见水肿、炎症细胞,部分钙化、坏死;假手术组肾脏结构未发生变化。各治疗组较模型组有所改善。肾衰泄浊汤组改善明显,病变损伤较轻。治疗组较模型组效果好,肾衰泄浊汤组较其他中药组及贝那普利组效果相对较好。

图1 各组药物对大鼠肾组织HE染色结果影响(HE,×200)Fig.1 Effects of each group of drugs on HE staining results in rat kidney tissue(HE,×200)
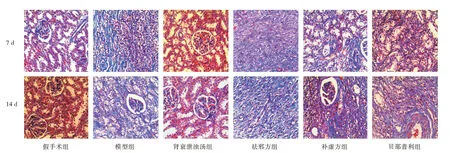
图2 各组药物对大鼠肾组织Masson染色结果影响(Masson,×200)Fig.2 Effect of each group of drugs on Masson staining results in rat kidney(Masson,×200)
2.2 各组大鼠术侧肾脏HE评分及Masson评分比较术后第7、14天时,假手术组大鼠术侧肾脏HE评分及Masson评分无明显变化;模型组大鼠术侧肾脏HE评分及Masson评分显著升高,较假手术组高(P<0.05);各治疗组肾脏HE评分及Masson评分均明显低于模型组(P<0.05,表1)。
2.3 Western Blot 法检测UUO 大鼠肾组织中PDGFR-β、α-SMA、NG-2蛋白的表达术后第7天时,模型组大鼠PDGFR-β、α-SMA、NG-2蛋白表达较假手术组增多(P<0.05),术后第14天时,模型组大鼠蛋白增多更明显(P<0.05)。第7、14天时,各治疗组PDGFR-β、α-SMA、NG-2蛋白的表达有所下降,但较假手术组高。治疗组中肾衰泄浊汤组PDGFR-β、α-SMA、NG-2蛋白减少较其他组明显(P<0.05,图3)。
3 讨论
许多因子[15]和信号通路[16-18]可加速RIF 进展,其中PMT是加速肾纤维化形成的关键[19]。现在公认肾纤维化时PMT 使肾脏ECM 积累增多,且α-SMA 蛋白表达增多,与本实验中α-SMA 蛋白表达随大鼠肾脏纤维化程度加重逐渐增多基本一致。信号通路与肾纤维化的研究近年来趋于成熟[20],但中药复方对信号通路的影响研究结果较少,本实验从该角度,运用中药复方对PMT 进行干预,观察到PDGFR-β蛋白表达上调,说明肾衰泄浊汤可对PDGF 通路产生影响,进而抑制PMT;另有研究指出,PDGF 通路还能调控NG-2 胶质细胞的增殖,使NG-2蛋白表达增多[21],本实验观察到肾衰泄浊汤组NG-2蛋白表达较其他组少,与其结果相似。本实验以PMT为研究RIF的切入点,通过观察肾衰泄浊汤及其拆方对PMT 过程中α-SMA、PDGFRβ、NG-2蛋白表达的影响,提出抑制PMT 可能为肾衰泄浊汤及其拆方延缓RIF 发展的机制,为日后治疗提供新思路。
表1 各组大鼠HE评分及Masson评分Tab.1 HE scores and Masson scores of rats in each group±s
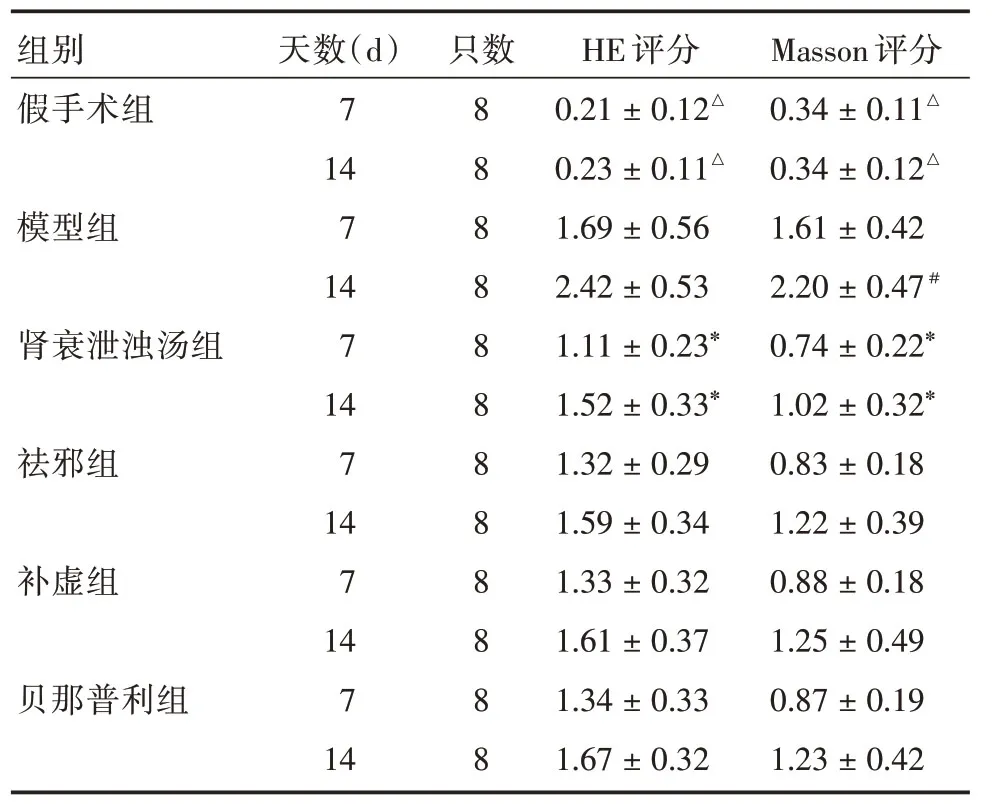
表1 各组大鼠HE评分及Masson评分Tab.1 HE scores and Masson scores of rats in each group±s
注:与同时期模型组及各治疗组比较,△P<0.05;与同时期模型组及各治疗组比较,#P<0.05;与同时期不同治疗组比较,*P<0.05
组别假手术组模型组肾衰泄浊汤组祛邪组补虚组贝那普利组天数(d)7 14 7 14 7 14 7 14 7 14 7 14只数8 8 8 8 8 8 8 8 8 8 8 8 HE评分0.21±0.12△0.23±0.11△1.69±0.56 2.42±0.53 1.11±0.23*1.52±0.33*1.32±0.29 1.59±0.34 1.33±0.32 1.61±0.37 1.34±0.33 1.67±0.32 Masson评分0.34±0.11△0.34±0.12△1.61±0.42 2.20±0.47#0.74±0.22*1.02±0.32*0.83±0.18 1.22±0.39 0.88±0.18 1.25±0.49 0.87±0.19 1.23±0.42

图3 各组大鼠肾组织α-SMA、NG-2、PDGFR-β蛋白的表达Fig.3 Expression of α-SMA,NG-2,PDGFR-β protein in kidney tissue of rats in each group
长期临床实践证明肾衰泄浊汤确实能延缓肾纤维化进程,保护肾功能[12-13],但作用机制尚不明确。RIF 病机为“虚、湿、瘀、毒”,关键病机为“脾肾亏虚、湿毒内蕴、瘀血阻滞”,为本虚标实之证[22],治疗上需标本兼顾,肾衰泄浊汤正是依此治法研制。在疾病前期,多以邪实(湿、瘀、毒)致病为主,活血化瘀、祛湿泄浊为该期基本治法,方中生牡蛎软坚除湿,下泄湿毒,蒲公英清热解毒,丹参活血化瘀,生大黄泻浊毒、破积滞、化瘀血,槐花清瘀热;到疾病晚期,正气消耗过多,则以本虚为主,治以扶正、补肾,方中黄芪补气升阳利尿,巴戟天补肾助阳化气;祛邪与补虚的联合运用,标本兼顾,体现了中医治病的整体观念。近年来,PMT 已成为RIF的研究热点[23],但国外对中药复方抑制PMT的研究相对较少。目前本实验通过研究肾衰泄浊汤及其拆方对PMT 相关蛋白的影响,寻找可能的作用机制。贝那普利可减轻RIF的程度,以其为对照组可以更好地观察肾衰泄浊汤的疗效。本实验结果表明,第7、14天时,各治疗组及贝那普利组治疗后PDGFR-β、α-SMA、NG-2蛋白的表达较模型组降低,较假手术组升高;各治疗组及贝那普利组治疗后Masson、HE评分较模型组降低,较假手术组升高;说明各治疗组及贝那普利组均可抑制PDGFR-β、α-SMA、NG-2蛋白的表达,改善RIF的进展。肾衰泄浊汤组各项指标优于其余治疗组,说明整体治疗效果优于单独治疗,标本兼顾可以起到更好的治疗效果。本实验局限在慢性肾脏病发病机制复杂,肾衰泄浊汤有可能干预多条信号通路达到延缓RIF 作用,目前尚未详细探讨,缺乏整体性对比;且由于研究样本数量较少,具体作用机制尚不明确,本课题组将继续完善相关研究。
综上所述,肾衰泄浊汤及其拆方减轻RIF的机制可能是通过减少PDGFR-β、α-SMA、NG-2蛋白的表达来抑制PMT的过程,达到延缓RIF 发展的作用。
