组蛋白去乙酰化酶2在衰老心肌细胞自噬水平降低中的作用
2020-06-09王睿王艳华柴丽芬吴琪瑞吴凯杨勇杨晓玲姜怡邓李桂忠
王睿 王艳华 柴丽芬 吴琪瑞 吴凯 杨勇 杨晓玲 姜怡邓李桂忠
宁夏医科大学1基础医学院,2临床医学院,3国家卫生健康委员会代谢性心血管疾病研究重点实验室(银川750004);4宁夏回族自治区人民医院(银川750004)
衰老是一个多步骤的细胞程序,具有稳定的细胞周期[1],其已成为心血管疾病,糖尿病,癌症等疾病的危险性因素[2-3]。细胞衰老则为与年龄相关的细胞固有功能的丧失,其亦为许多疾病的重要危险因子[4],特别是心血管疾病。已有文献[5]报道,心肌细胞衰老能够引起心肌细胞水平的功能下降,导致心脏中能够发挥正常功能的心肌细胞数目减少,对心脏功能产生消极影响。且相关研究[6]已证实,心肌细胞的衰老同时伴随着细胞自噬水平的抑制。自噬是一种高度保守的真核降解过程,可将受损或不必要的蛋白质和细胞器输送到溶酶体中进行降解,其在心血管疾病的发生和发展中起着重要的作用[7-8]。自噬的调节可能成为预防和控制心血管疾病的潜在靶标。然而,负责调节自噬的因素和控制自噬的方法目前尚不清楚[9]。组蛋白去乙酰化酶(histone deacetylase,HDACs)是一类蛋白酶,能够转移组蛋白上的乙酰基集团,对染色体的结构修饰和基因表达调控发挥着重要作用。研究表明,高剂量硅酸盐引起细胞自噬功能障碍,但是显著降低和抑制HDACs 家族中的HDAC6 可以恢复自噬流量[10]。另外,HDACs家族中的另一成员HDAC2 被发现在心肌梗死小鼠模型中表达升高,进而导致心肌肥厚[11],但其在衰老心肌细胞中的作用还未见报道。因此,本文拟从D-galactose 诱导的衰老心肌细胞角度出发,探讨HDAC2是否参与了衰老心肌细胞自噬水平的降低。
1 材料与方法
1.1 主要仪器与试剂大鼠心肌细胞H9c2 购于中科院上海细胞生物学研究所细胞中心;超净工作台购于中国香港Heal Force公司;荧光定量基因扩增仪FTC-3000p 购于加拿大Funglyn Biotech公司;-80℃低温冰箱购于美国Thermo Scientific公司;DMEM 培养基和胎牛血清购于美国Gibco公司;D-galactose 购于中国博奥拓达科技有限公司;小鼠来源抗p62抗体,兔来源抗LC3B抗体均购于美国Abcam公司;Cy3 偶联的山羊来源抗兔抗体
购于美国Proteintech公司;兔来源抗HDAC2抗体购于美国CST(Cell Signaling Technology)公司;β-半乳糖苷酶染色试剂盒购于上海碧云天公司;总RNA 提取试剂盒购于北京天根生化科技有限公司;cDNA 第一链合成试剂盒、qRT-PCR检测试剂盒均购于北京Takara公司;HDAC2 引物、内参(GAPDH)引物均购自上海生工生物工程股份有限公司。
1.2 正常心肌细胞的培养及衰老心肌细胞模型的复制在DMEM 纯高糖培养基中加入10%胎牛血清及1%双抗进行H9c2 正常心肌细胞的培养,细胞放置于含有5%CO2的37℃培养箱里,每2 天换液1次。当细胞密度达到80%左右时,使用含有EDTA的胰酶消化后传代,添加培养液后继续培养。使用含有8 mg/mL D-galactose的衰老培养液刺激H9c2 细胞9 d 之后(课题组前期已筛出D-半乳糖刺激的浓度及时间[12]),β-半乳糖苷酶染色验证衰老心肌细胞模型是否复制成功。将正常H9c2 细胞组命名为control,将衰老心肌细胞组命名为D-galactose。
1.3 β-半乳糖苷酶染色鉴定细胞衰老情况Dgalactose 刺激H9c2 细胞衰老9 d 后,取出细胞,弃掉培养液,用PBS 缓冲液冲洗细胞1遍后,加入1×半乳糖苷酶染色固定液,室温下孵育10~15 min,随即用PBS 缓冲液清洗2遍,每遍3 min。再加入1 mL 半乳糖苷酶染色液,37℃培养箱中过夜,第2 天于普通光学显微镜下观察并拍照。
1.4 透射电镜观察心肌细胞的自噬结构前固定:心肌细胞从培养箱中取出后,吸净培养液并用缓冲液清洗细胞两遍,随后加1.5 mL 固定液平放静置15 min。用细胞刮小心轻柔的将细胞收集到1.5 mL 离心管中,1 000 转离心10 min。弃上清,加入固定液后轻轻弹匀。4℃放置50 min后,1 000转离心10 min 并弃上清,再加入固定液。重复3次上述过程,最终放入4℃保存。后固定:1%锇酸浸泡1 h,0.1 M 二甲砷酸钠缓冲液冲洗两次。脱水:梯度酒精脱水后,环氧丙烷渗透。包埋:完全包埋液浸泡,制作超薄切片,透射电镜下观察。
1.5 Western Blot检测自噬相关蛋白的表达改变分别取正常心肌细胞及D-galactose 诱导的衰老心肌细胞,胰酶消化后接种于25 cm2的透气培养瓶中,每组各3 瓶。待细胞融合度达到80%时,使用全蛋白提取试剂盒提取细胞蛋白,12 000 转离心15 min 后,收集上清即为全蛋白。采用BCA 法进行蛋白定量,经SDS-PAGE 电泳后,以恒流0.3 A,2 h为湿转条件,转至PVDF 膜上。5%脱脂牛奶封闭2 h,PBST 洗膜后一抗4℃孵育过夜。二抗室温孵育2 h,加入显色底物进行曝光,最终结果为目的条带与β-actin的灰度值之比。
1.6 qRT-PCR检测HDAC2的mRNA表达在6孔板中接种正常心肌细胞及衰老心肌细胞,每组3孔。按照总RNA 提取试剂盒说明书提取总RNA,使用Takara的cDNA 第一链合成试剂盒逆转录为cDNA,采用Primer5.0 设计HDAC2 及GAPDH 引物(HDAC2 Forward:5′-GGGCTGCTTCAACCTAACTG-3′,Reverse:5′-TTCACAATCAAGGGCAACTG-3′;GAPDH Forward:5′-GGTGAAGGTCGGTGTGAACG-3′,Reverse:5′-CTCGCTCCTGGAAGATGGTG-3′),以cDNA为模版,采用Takara qRT-PCR检测试剂盒扩增HDAC2 基因。目的基因的相对量=2-△△Ct,△△Ct=[Ct(待测样品)-Ct GAPDH(待测样品)]-[Ct(校正样品)-Ct GAPDH(校正样品)]。
1.7 免疫荧光染色观察自噬相关基因LC3B的表达细胞爬片用PBS 洗涤,用4%多聚甲醛固定30 min 后,PBS 冲洗干净。H2O2处理10 min,PBS 洗净。山羊血清封闭1 h,LC3B抗体(兔来源,1∶200稀释液)4℃过夜,PBS 洗净后将样品与Cy3 偶联的山羊抗兔IgG(1∶200 稀释液)在37℃温育1 h,随后用PBS 洗涤3次。最后将细胞核用4,6-二脒基-2-苯基吲哚(DAPI)复染5 min,通过激光共聚焦显微镜检测荧光信号。
1.8 统计学方法用Prism 7.0 统计软件进行统计学分析,结果以表示,计量资料两组对比采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 衰老心肌细胞模型的建立H9c2 心肌细胞是贴壁细胞,细胞基本呈长梭形且包膜完整。心肌细胞经过D-半乳糖诱导9 d 后,通过β-半乳糖苷酶染色观察衰老心肌细胞形态学的改变。未经衰老诱导的细胞染色结果呈阴性,而衰老诱导9 d的心肌细胞明显呈现阳性(蓝色),由此,衰老心肌细胞模型建立成功。见图1。
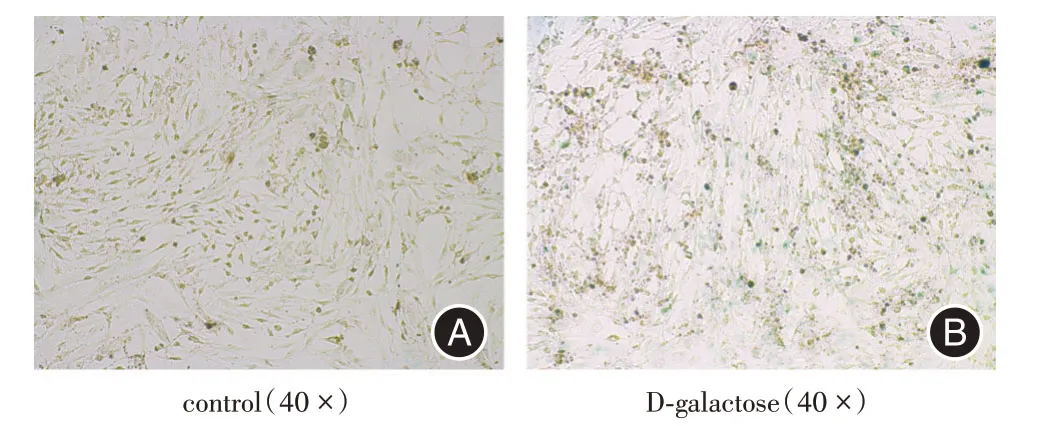
图1 衰老心肌细胞的培养及鉴定Fig.1 Culture and identification of aging cardiomyocytes
2.2 透射电镜观察衰老心肌细胞中的自噬结构透射电镜结果显示,正常心肌细胞中可见细胞器膜结构完整,多个自噬小泡包裹待降解底物形成自噬小体结构。而衰老诱导的心肌细胞中,线粒体数量明显增多,少有自噬结构形成,自噬水平降低。见图2。
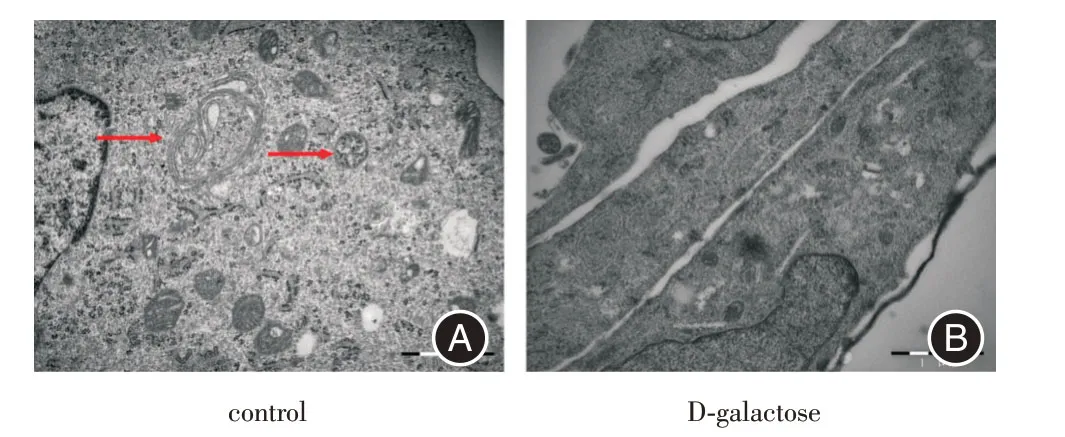
图2 电镜观察control与D-galactose组中自噬水平的改变Fig.2 The changes of autophagy levels in the control and Dgalactose groups was observed by electron microscopy
2.3 自噬相关基因在衰老心肌细胞中的表达采用Western Blot检测control及D-galactose组中,LC3BⅡ与LC3BⅠ的比值,及p62的表达。衰老心肌细胞与正常心肌细胞相比,LC3BⅡ/Ⅰ明显降低,p62表达水平明显升高(P<0.05),表明心肌细胞衰老后自噬水平降低。见图3。
2.4 HDAC2的mRNA及蛋白表达采用qRTPCR及Western Blot 分别检测control与D-galactose组中HDAC2的mRNA及蛋白表达情况,当正常心肌细胞给予衰老刺激后,HDAC2的mRNA 呈降低趋势,蛋白表达也明显降低,由此证实心肌细胞的衰老降低了HDAC2的表达情况。见图4。
2.5 干扰HDAC2后检测心肌细胞自噬水平的改变为进一步明确HDAC2在衰老心肌细胞自噬水平降低中的作用,将HDAC2 干扰病毒及对照病毒感染衰老心肌细胞后,Western Blot 首先验证了病毒感染效率,随后检测了LC3B及p62的蛋白表达,最后通过免疫荧光染色观察LC3B的表达情况。D-galactose组中的Ad-shHDAC2与Ad-shNC 相比,HDAC2 蛋白表达降低(P<0.05),证实病毒感染成功。同时,干扰HDAC2 后LC3BⅡ/Ⅰ明显降低,p62表达水平明显升高(P<0.05),与上述得出的HDAC2与自噬水平之间关系一致。LC3B 荧光强度更低,进一步证实了HDAC2的低表达能够促进衰老心肌细胞自噬水平的降低。见图5。

图3 Control与D-galactose组中自噬相关基因的表达Fig.3 The expression of autophagy-related genes in control and D-galactose groups

图4 control组与D-galactose组中HDAC2的mRNA及蛋白表达Fig.4 The mRNA and protein expressions of HDAC2 in control and D-galactose groups
2.6 H3K14ac的蛋白表达为探寻HDAC2在衰老心肌细胞自噬水平降低中的机制,采用Western Blot 检测control 及D-galactose组中,H3K14ac的表达。如图6A所示,衰老心肌细胞与正常心肌细胞相比,H3K14ac表达水平明显升高(P<0.05),表明心肌细胞衰老后H3K14的组蛋白乙酰化水平增加。为进一步证实HDAC2在其中发挥的作用,将HDAC2 干扰病毒及对照病毒感染衰老心肌细胞后,Western Blot 检测了H3K14ac的蛋白表达。如图6B所示,干扰HDAC2 后H3K14ac蛋白表达进一步增加,证实HDAC2在衰老心肌细胞中表达降低介导H3K14 高乙酰化水平。
3 讨论
衰老通常以机体各项功能衰退为特征。在哺乳动物中,衰老发生于多个器官系统并导致其逐渐恶化,最终引起组织细胞功能障碍[13]。随着老龄化社会的来临,人民生存质量的提高及心血管疾病危险因素的广泛流行,我国心血管疾病的发病率及病死率逐年增长,在年龄>80岁的受试者中,心力衰竭发病率高达20%[14],提示80岁以上的老年人是心血管疾病的高危人群。同时,心肌细胞随着年龄增长受到越来越多的损伤,发展成为衰老心肌细胞后最终可能导致心肌细胞出现结构和功能的变化,因此深入探讨老年心肌损伤成为亟待解决的重要课题。

图5 感染HDAC2 干扰腺病毒后观察自噬水平的改变。Fig.5 Changes in autophagy were observed after infection with Ad-shHDAC2
自噬是生物体内持续存在的一个动态的生物过程,衰老心肌细胞的自噬也参与了心血管疾病的发生发展[6]。临床研究表明,心肌细胞的衰老与自噬水平改变之间存在密不可分的关系[15],激活自噬可延缓心肌组织及细胞的衰老[16]。有文献报道,自噬激动剂雷帕霉素可改善衰老引起的心肌细胞收缩功能障碍和线粒体吞噬功能的丧失[17]。但心肌细胞衰老与自噬之间究竟存在何种调控机制目前尚不清楚。本课题培养大鼠心肌细胞H9c2,并给予D-半乳糖诱导为衰老心肌细胞,进而比较正常与衰老心肌细胞中自噬水平的差异。透射电镜可以清晰的看到,正常心肌细胞中线粒体结构完整,可见典型自噬结构存在,衰老心肌细胞中细胞膜及细胞器膜结构不完整。蛋白结果显示,衰老心肌组比正常心肌组的LC3Ⅱ/Ⅰ水平明显降低,p62水平明显升高。已知LC3是自噬体膜上的标记蛋白,在细胞内以LC3Ⅰ和LC3Ⅱ两种形式存在,伴随着自噬的激活,LC3Ⅰ转化为LC3Ⅱ并定位于自噬体膜,因此二者之比可以反映自噬水平的变化[18]。p62是选择性自噬最重要的货车蛋白,也被称之为选择性自噬受体,p62 结合泛素化蛋白进入到自噬体后最终与溶酶体融合形成自噬溶酶体从而得到清除[19]。因此,本研究结果提示心肌细胞衰老同时伴随着自噬水平的降低,这与已知文献[18]报道一致。有关心肌细胞衰老引起自噬水平降低的可能解释为,当心肌细胞衰老后,AMP 依赖性蛋白激酶(AMPK)活性被抑制,以及Ⅰ类磷脂酰肌醇3-激酶(PI-3K)/Akt 信号传导通路被激活,导致雷帕霉素(mTOR)信号传导的过度激活,自噬水平被抑制[20],但其具体机制还有待进一步研究。
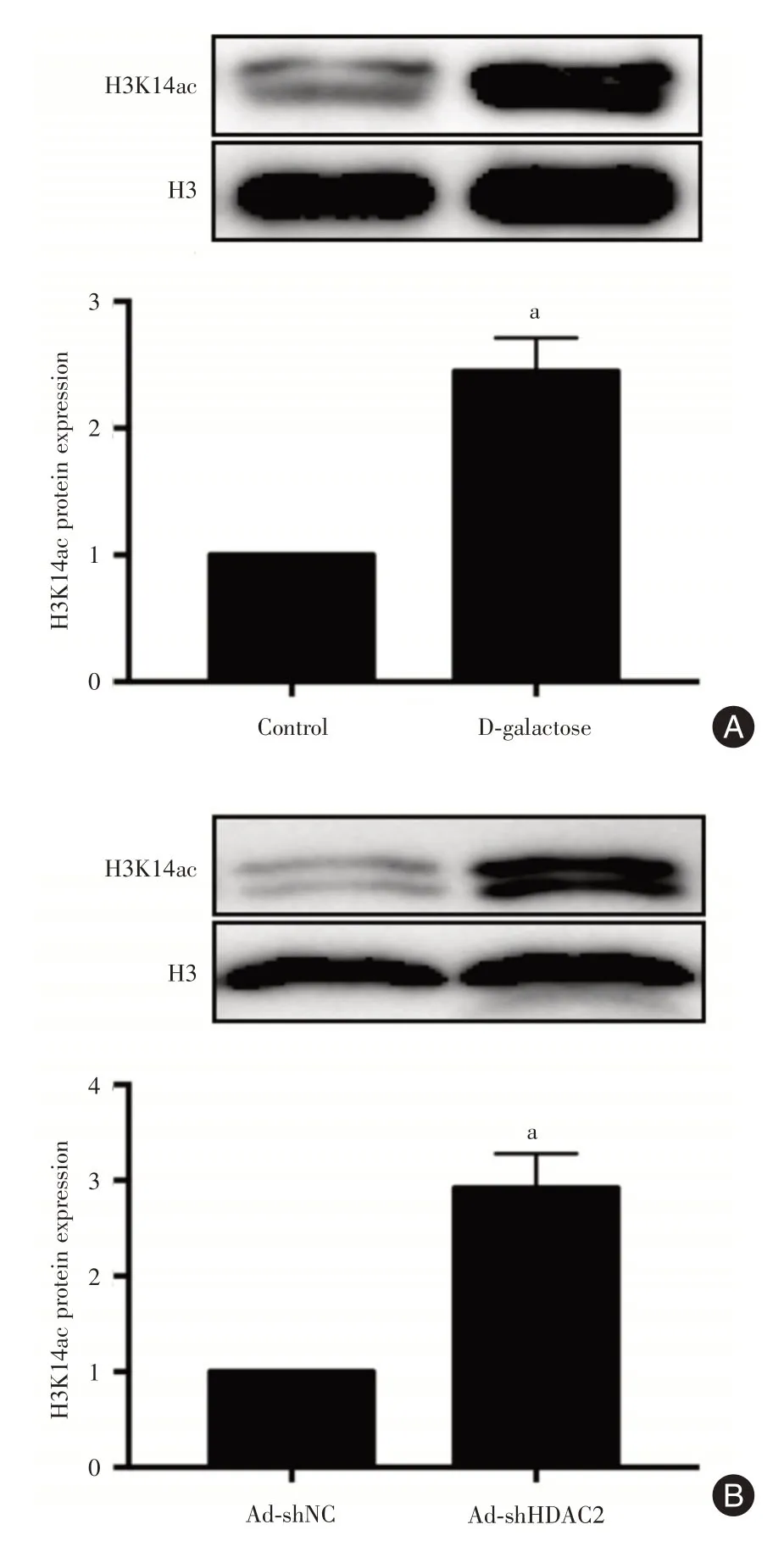
图6 H3K14ac的蛋白表达Fig.6 The protein expression of H3K14ac
HDAC2 属于HDACs 家族中的一员,其与组蛋白乙酰基转移酶(HAT)共同作用使得组蛋白的去乙酰化与乙酰化水平处于动态平衡状态。HDACs家族各成员主要定位于细胞核与细胞质中,另有少部分定位于胞质细胞器中,其在细胞的增殖,分化,凋亡中发挥重要的作用。在心血管系统疾病中,已证实HDACs 发挥了重要的调控作用。研究[21]表明,HDAC3是在破裂的动脉粥样硬化病变中唯一上调的HDACs,HDAC3 敲除的巨噬细胞具有更强的脂质流出能力,因此,HDAC3 能够促进脂质沉积进而增加斑块的不稳定性。另有研究[22]报道,抑制HDAC2的活性能够改善心脏肥大反应。以上证据为进一步探讨HDAC2在衰老心肌细胞自噬改变中的作用提供了可能。在本研究中,8 mg/mL D-半乳糖刺激心肌细胞后,Western Blot 及qRT-PCR检测HDAC2的蛋白及mRNA表达,均发现HDAC2的表达明显降低,提示HDAC2可能在衰老心肌细胞自噬水平降低中发挥了重要的作用,但目前尚无相关文献报道。为进一步明确HDAC2的作用效果,本研究构建了HDAC2的干扰腺病毒,转染衰老心肌细胞发现,干扰HDAC2后的衰老心肌细胞自噬水平进一步降低,证实HDAC2 确实在衰老心肌细胞自噬水平降低中发挥了重要的作用,同时提示HDAC2 能够促进衰老心肌细胞发生自噬。究竟有何种机制介导HDAC2促进心肌细胞衰老后自噬水平的升高呢?通过查阅有关文献得知,香烟烟雾能够降低小鼠肺细胞中的HDAC2的水平及活性,进而导致COPD患者肺部的持续炎症,DNA 损伤和随后的细胞衰老[23],证实了HDAC2 参与调控了衰老细胞行为学的改变。另外,印苦楝内酯(Nimbolide)通过调控HDAC2介导的表观遗传学修饰进而影响乳腺癌中自噬水平的变化[24]。有趣的是,本研究也同样发现在衰老心肌细胞中干扰HDAC2 后H3K14 乙酰化水平升高。由此笔者推测,HDAC2在衰老心肌细胞中表达降低介导H3K14 高乙酰化水平,使得乙酰化动态平衡被破坏,引起自噬相关基因表达降低,最终导致自噬水平的降低。
综上所述,D-半乳糖能够诱导H9c2 心肌细胞衰老,进而引起自噬水平的降低,与此同时,HDAC2 参与调控衰老心肌细胞自噬水平降低这一现象推断并证实了组蛋白乙酰化可能在其中发挥重要作用,这一发现暂无其它文献报道。并且有临床证据表明[25],与青年人相比,健康长寿老人中自噬相关蛋白Beclin1的水平较高,这也为本研究结果的准确性提供了临床支持。但是,本研究目前仅局限于细胞水平,未来还需要获取更多的实验结果来证明其在动物水平中的作用,探寻其他引起衰老心肌细胞自噬水平降低的机制,为临床应用提供更好的方案。
