Prader-Willi综合征患儿的临床症状分析及护理干预
2020-06-09欧阳海梅李娉饶珊珊曾静
欧阳海梅 李娉 饶珊珊 曾静
广东省妇幼保健院番禺院区1遗传代谢与内分泌科,2中药房,3内科,4门诊部(广州511446)
Prader-Willi综合征(Prader-Willi syndrome,PWS)是一种基因组印记遗传性疾病,由PRADER等[1]在1956年首先报道。国外研究显示,PWS 发病率约1/29 000,平均病死率3%[2]。目前我国尚缺乏相关统计资料。PWS临床表型因年龄不同而存在很大差异,虽然目前已有PWS临床筛查和诊断标准,但由于PWS临床表现非常不特异,尤其在婴幼儿期极容易与脑瘫、脊髓性肌萎缩、低体质量儿等相混淆,确诊仍依赖于分子遗传学方法。中国PWS的文献报道较少,且缺乏患儿的临床症状回顾性分析及护理干预方面的研究。本研究分析确诊为PWS的14例PWS 患儿的临床表型特征和护理干预措施,以期让临床医务人员对本病有更深层次的了解与认识[3-5],为PWS 患儿的早诊断、早治疗、个性化的护理干预提供依据,从而改善患儿的生存质量,延长生命。
1 资料与方法
1.1 PWS临床诊断及病例纳入标准分别参照由GUNAY-AYGUN 等[6]和HOLM 等[7]提出的PWS临床筛查及诊断标准,其主要诊断标准包括:(1)新生儿和婴儿出现中枢性肌张力低下,吸吮力差,但随年龄增加逐渐改善;(2)婴儿期喂养困难,常需特殊喂养工具,如鼻饲、胃管等;体质量增长缓慢;(3)12个月至6岁期间,体质量迅速增加(大于两个标准差);(4)婴儿期特征性面容,如长颅、窄脸、杏仁眼、小嘴、上唇薄、口角向下(应含上述特征≥3 点);(5)各年龄段出现相应的性腺功能减退,生殖器官发育不全,男性有阴囊发育不良、隐睾、小阴茎和(或)小睾丸(小于同龄人第5百分位);女性有生殖器官缺如或严重发育不良,小阴唇和(或)小阴蒂;若不治疗,16岁后仍有性腺成熟延迟和不完全,同时有青春期性征发育延迟;(6)6岁前患儿整体发育延迟,6岁以后有轻度到中度的神经发育延迟或学习障碍;(7)摄食过度/强迫摄食;(8)通过高分辨染色体分析或其他细胞或分子诊断方法确诊的15q11-q13 缺失或母源性UPD。次要诊断标准包括:(1)妊娠期胎动减少,婴儿期哭声低,可随年龄增长有所改善;(2)特征性行为问题:易怒、强迫行为、程序化行为等;(3)睡眠紊乱或睡眠呼吸暂停;(4)15岁时身材仍矮小(无遗传背景,未经生长激素干预);(5)色素减退,毛发、皮肤颜色较浅;(6)与同龄儿相比手小(<P25)和(或)足小(<P10);(7)上肢尺侧腕部缺乏弧度;(8)内斜视、近视;(9)唾液黏稠;(10)语言清晰度欠佳;(11)有白损皮肤的现象。本研究里,病例纳入标准是:(1)我院儿童内分泌遗传门诊确诊的PWS 患儿;(2)年龄<16岁。
1.2 排除标准未经PWS 基因确诊、合并其他代谢性疾病、单纯性肥胖、年龄>16 周岁等。
1.3 知情同意与伦理审查本研究中,所有患儿及家属的隐私都能得到充分的保护。对所有入组患儿的家长(或监护人),均进行充分知情告知,并签署知情同意书。本研究经广东省妇幼保健院医学伦理委员会审核批准,并遵守《赫尔辛基宣言》。
1.4 遗传学检查对纳入临床诊断标准的可疑PWS 病例,以甲基化特异性聚合酶链式反应(methylation-specific polymerase chain reaction,MS-PCR)方法进行初步筛查[8]。因MS-PCR 不能区分缺失型及单亲二体型PWS,故对MS-PCR 筛查阳性病例,进一步以甲基化特异性多重连接探针扩增(methylation-specific multiplex ligation dependent probe amplification,MS-MLPA)方法进行确诊和鉴别诊断[9-10]。MS-PCR和MS-MLPA 操作步骤分别严格按照CpGenome Turbo Bisulfite Modification Kit(Merckmillipore,Germany)和MS-MLPA reagents and kits(MRC-Holland,Amsterdam,the Netherlands)说明书进行。
1.5 纳入研究对象的PWS患儿观察指标 (1)基本情况:母亲怀孕年龄、父亲年龄、孕周、分娩方式、患儿性别、出生体质量。(2)就诊情况:初诊年龄、确诊年龄、体质量指数、临床症状、特征性行为、情绪、皮肤受损等。
1.6 护理干预护理干预的主要内容包括:医学营养干预、行为监督和心理护理等措施进行体质量管理、改善糖脂代谢,干预周期为入院后30 d。
1.6.1 医学营养干预(1)制定营养餐单。体质量控制是最为安全、有效、经济的措施,而饮食管理是体质量管理的重中之重。营养师根据PWS 患儿的能量需求以及患儿的性别和年龄、体质量、糖脂等代谢情况制定科学个性化的营养餐单,饮食结构主要包括富含膳食纤维、生糖指数低具有饱腹感的全粮:燕麦、荞麦、薏仁、小米等,选择优质蛋白质:鱼、奶、蛋以及大豆、豆腐、腐竹等[11];总能量按儿童不同年龄供给每日所需:儿童期(3~9岁)女孩700~884 kcal/d;男孩740~960 kcal/d[12],青春期按20~25 kcal/(kg·d),其中脂肪每日提供能量比例小于25%[13]。保证充足蔬菜、水果摄入。(2)饮食指导。专科护士通过参考各种文献资料,使用通俗易懂的语言向患儿和家长介绍本疾病的基本医学知识以及营养干预的重要性[14],详细介绍食品交换法、发送食品交换法的图文并茂的册子、达到食品选择的多样化;食品采用电子厨房秤秤重,达到科学、准确。发放体质量管理日记本,记录食物品种及摄入量、烹调方法、运动形式及时间、每日早晚净体质量;建立减重微信群和添加科室微信,定时收集、评估患儿体质量管理日记,专科护士给与一对一的指导,以增强患儿和家长的信心从而改善依从性。
1.6.2 行为监督(1)改善生活方式。PWS 患儿因摄食较多,食欲旺盛、强迫摄食等行为导致中心性肥胖,严重影响患儿生存质量及寿命。科学安排时间,制定每日生活清单,早晚各30 min 有氧运动,快走、单车、打球、散步、游泳等中低强度的运动形式,并佩戴计步器,每日步数6 000~80 000步[15]。减少零食饮料及油炸食物摄入、定时定量进餐,减少外出进餐次数;充分的培养学习兴趣、分散注意力、根据患儿不同的天赋安排跳舞、画画、搭积木、练字、手工、唱歌等。改善生活方式能够有效的控制体质量快速上升。(2)食品的保管。主要目标是缓解过度的觅食行为、降低过度食物摄入,避免摆放在患儿能目视到的地方,并要求所有的食品上锁管理;及时处理垃圾桶的食物;避免给患儿找到食品的机会从而降低患儿的觅食行为。逐渐养成良好的生活习惯,达到控制觅食行为、过度摄食的效果。
1.6.3 基础护理(1)口腔护理。PWS 患儿口腔唾液黏稠,高腭弓,易导致食物残留在口腔内。患儿进食后常规漱口清除残留在口腔及咽部的食物,给予常规每天刷牙两次,每日喝温开水1 700~2 000 mL 以达到清洁及湿润口腔的目的[16]。(2)皮肤护理。每日沐浴1次,及时更换汗湿衣服,并选择宽松棉质的衣物;针对重度肥胖者且易受压部位,采用软垫减压。每周修剪指甲一次,针对皮肤破损处的给予清洁消毒后止血贴外贴,可见脓点者给予百多邦外涂[17]。
1.6.4 心理护理(1)家属方面。PWS是罕见的遗传性疾病,家属缺乏对疾病的认识,笔者在接诊以及随访中需耐心讲解疾病的基本医学知识、不同年龄段的临床症状、家属照顾的重点等,让家属理解和接纳孩子的行为,配合治疗。(2)患儿方面。PWS的患儿容易没有安全感,易出现焦虑、孤独等负性心理[18]。在护理过程中,应主动靠近患儿,多与患儿握手、拉勾、拥抱,取得他们的依赖与信任,从而提高治疗依从性。鼓励患儿多接触同龄人、亲戚,让他们融入社会大家庭,以乐观心态生活,减轻心理负担。
1.7 监测指标比较入院时与治疗干预30 d 后,14例患儿的体质量、体质量指数、腰臀比,以及总胆固醇、空腹血糖、胰岛素、糖化血红蛋白等的变化情况[19-20]。
1.8 统计学方法所得监测数据指标,均采用SPSS 20.0 统计学软件进行处理。计量资料用均数±标准差表示,组间比较方法采用t检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 临床资料我院儿童内分泌遗传门诊从2012年12月至2016年12月共确诊14例PWS患儿,其中男11例、女3例,男女比例为4∶1。患儿出生孕周31~42周,其中足月儿10例,早产儿3例,过期产儿1例。患儿出生体质量1.55~3.80 kg,确诊年龄1.5~14.6岁。患儿首次入院体检体质量(63.13±27.89)kg;BMI(35.36±8.98)kg/m2;腰臀比(0.97±0.07),均诊断为肥胖症[5]。病史追问和回顾性分析发现,14例患儿婴儿期均存在中枢性肌张力低下和皮肤毛发色素减退,其他临床表现还包括:特殊面容10例(71%),吃奶吸吮缓慢12例(86%)和唾液黏稠12例(86%)。儿童期,14例患儿均出现肥胖和智能障碍,其他临床表现还包括:特征性行为(14例,100%)、皮肤损伤11例(79%)和外生殖器发育不良13例(93%)。见表1。
2.2 基因型14例临床诊断的PWS 患儿均经MSMLPA 确诊和分型。14例患儿基因型均为父源性15q11-q13 区域缺失型。
2.3 治疗结局14例PWS 患儿经过行为监督、饮食引导和护理干预30 d 后,情绪稳定,强迫行为得到有效改善,过度的觅食行为明显缓解。通过摄食入量限制和食品品种的优化选择,患儿体质量、体质量指数、腰臀比等数值均出现明显下降,糖、脂代谢紊乱得到较大改善(表2),组间比较差异具有统计学意义(P<0.05)。监测中未发现严重并发症。
3 讨论
PWS 属于遗传印迹性遗传病,其发病机制是:在父源15q11-13 区域存在SNRPN、MKRN3 等印记基因,他们仅在父源等位基因上表达。若这些基因失去功能,便导致PWS[21]。PWS 分子缺陷类型包括:父源性15q11-q13 区域缺失(占70%~75%),母源性单亲二倍体(UPD,占~25%),印记基因缺陷或基因突变(<1%)[22]。不同的缺陷类型所致临床表型和遗传风险存在一定差异。
PWS 发病率不低,根据国外研究报道,从1/5 000 到1/15 000 不等,平均病死率在3%[2]。但由于早期临床表现不典型,且临床医师缺乏对该病的认识,容易造成漏诊和误诊。因此,美国学者HOLM 等[7]于1993年总结提出了PWS的临床诊断标准,2001年GUNAY-AYGUN 等[6]对该诊断标准进行了进一步修订,同时提出了标准矫正建议方案,并沿用至今。本研究14例PWS 患儿主要临床表现方面,新生儿期肌张力低下及皮肤毛发色素减退、特征性行为、儿童期肥胖和智能障碍的发生率达100%,其后依次为性腺发育不良93%、吃奶吸吮缓慢和唾液黏稠86%、皮肤受损79%等。但需要指出的是,上述临床特点受临床医生主观判断因素影响较大,容易产生偏倚[23]。另外需要注意的是,某些临床诊断特征,如婴儿期中枢性肌张力低下和特殊面容,每例患儿肌张力低下程度不同,特殊面容的表现也并非每一项都一定具备,无量化标准,个体之间表现差别较大,亦存在诊断人员主观判断因素影响。本研究中,临床表型的发生率与国内外相关报道[24]基本一致,提示上述临床表型有助于PWS患儿的临床诊断。
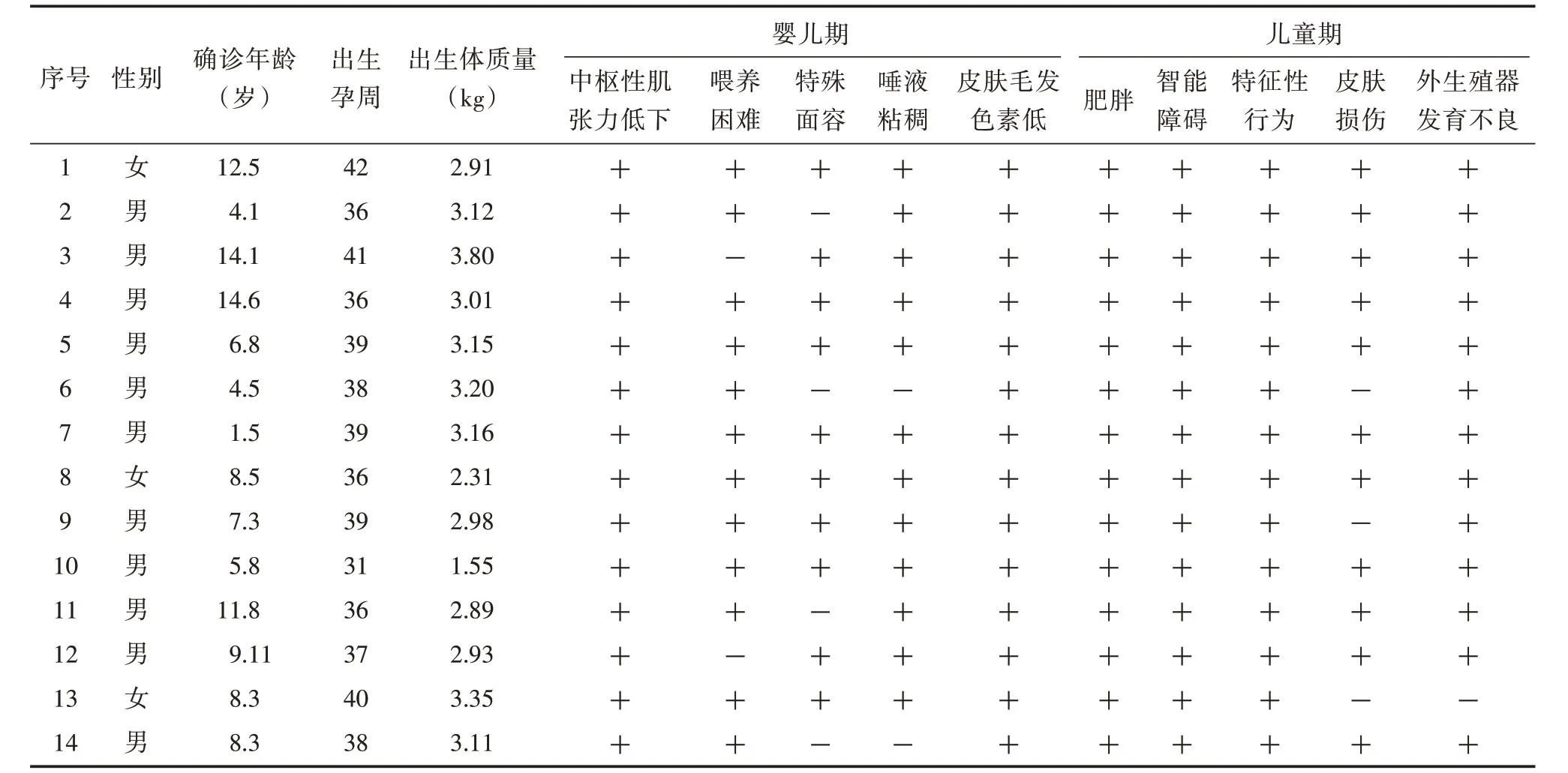
表1 14例PWS 患儿的临床资料Tab.1 Clinical data of 14 children with PWS
表2 14例PWS 患儿干预前后主要监测指标Tab.2 Main monitoring indicators before and after intervention ±s
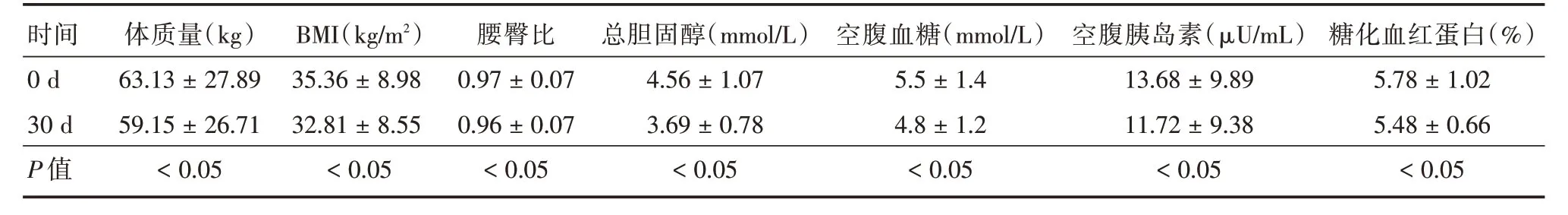
表2 14例PWS 患儿干预前后主要监测指标Tab.2 Main monitoring indicators before and after intervention ±s
时间0 d 30 d P 值体质量(kg)63.13±27.89 59.15±26.71<0.05 BMI(kg/m2)35.36±8.98 32.81±8.55<0.05腰臀比0.97±0.07 0.96±0.07<0.05总胆固醇(mmol/L)4.56±1.07 3.69±0.78<0.05空腹血糖(mmol/L)5.5±1.4 4.8±1.2<0.05空腹胰岛素(μU/mL)13.68±9.89 11.72±9.38<0.05糖化血红蛋白(%)5.78±1.02 5.48±0.66<0.05
从目前国内外关于PWS的研究内容来看,主要针对其临床特征与遗传学诊断,鲜有关于PWS患儿健康宣教、体质量管理及护理干预等综合管理的研究报道。随着年龄的增长,PWS 患儿超常的觅食行为更为显著,研究显示PWS 群体总体每日的能量消耗显著降低[25],故体质量管理更为艰辛,需要医务人员(包括临床医生、营养师、护理人员等)与家长、老师共同的配合。本文研究14例中最早的确诊年龄为1.5岁,最大为14.6岁;BMI(35.82±9.01)kg/m2,腰臀比0.79~1.03,确诊年龄普遍偏大,患儿体质量异常增加、代谢紊乱等对治疗产生较为不利影响。经过30 d的体质量控制、饮食引导、行为监督引导和心理护理,患儿情绪稳定,强迫行为得到有效改善,过度的觅食行为明显缓解,同时体质量、体质指数、腰臀比等数值均出现明显下降,糖、脂代谢紊乱得到较大改善,说明我们的综合治疗确实有效,值得推广。需要指出的是,目前研究的14例PWS 患儿中暂未发现母源性UPD 基因型和印记基因缺陷型,考虑可能与样本量不够大有关。未来准备在目前研究基础上,进一步继续收集PWS临床患儿,扩大研究样本量,以对该两型患儿的临床表型及治疗效果进行研究。
综上,临床医务人员尤其新生儿科、儿童康复科、儿保科、儿童内分泌科等科室需要加深对PWS的临床症状认识,尽早诊断,及时多学科综合模式管理干预,随访追踪,以改善婴幼儿患儿生长发育,预防学龄儿童、青少年以及成年期的体质量超重、糖脂代谢紊乱,从而提高患儿以及家属生存质量、延长患儿寿命。
