APP/PS1转基因小鼠脑内Aβ斑块沉积增多下调CA3和CA1区域神经元及细胞增殖导致学习和记忆损害
2020-06-08刘婉晴杨婧艺
刘婉晴,刘 航,杨婧艺,马 英
0 引言
阿尔茨海默病(Alzheimer′s disease,AD)是最常见的一种痴呆类型,约占痴呆病例的70%[1]。AD典型临床症状是认知功能障碍中所包含的记忆能力进行性下降,神经病理学标志是在脑组织神经元细胞外出现β淀粉样蛋白(Aβ)沉积形成的神经炎性淀粉斑块、tau蛋白异常磷酸化所形成的神经原纤维缠结,而Aβ沉积可引起脑实质的损伤,可能与学习、记忆和认知功能障碍过程中神经元丢失有关[2]。神经再生是神经干细胞产生神经元的过程,包括4个阶段:神经干细胞的增殖、分化、存活以及成熟[3]。有研究发现,Aβ沉积的AD转基因小鼠其海马区神经元的丢失可以引起学习和记忆能力的损害[4]。脑成像显示,在AD的发展过程中,海马最易受到影响,萎缩程度最为明显[5]。因此,AD发生的根本原因在于海马受到了损害。海马位于大脑颞叶中的双侧结构,不同区域的功能也不同,其中CA3和CA1区域在学习和记忆中担任重要作用[6]。有报道,AD海马CA3和CA1区域神经元丢失导致锥体层萎缩[7],也有研究发现,在AD大鼠海马CA1和CA3区域显示出神经元数目增加[8]。本研究主要目的是检测AD小鼠脑内Aβ斑块沉积增多对CA3和CA1区域神经元以及细胞增殖的影响,并探讨其损伤学习及记忆能力的机制。
1 材料与方法
1.1 动物模型与分组 将雄性12月龄小鼠(均在中国医科大学动物部购买)分为2组:APP/PS1小鼠5只作为实验组(AD组),是表达嵌合小鼠/人淀粉样前体蛋白(Mo/HuApp695swe)和突变型人早老蛋白(PS1)的Tg小鼠,Mo/HuApp695swe可使小鼠产生人类的Aβ沉积;C57BL/6J 野生型小鼠5只作为对照组(C57组)。在实验前至少10 d将小鼠转移到动物实验室以适应环境,在标准条件[12 h光照/黑暗循环,温度(21±2)℃]下饲养动物,使其自由获取食物和水。
1.2 水迷宫实验 检测小鼠行为学变化,采用Morris水迷宫恒温游泳池(淮北正华生物仪器设备有限公司)测试小鼠空间记忆能力,试验在装有23~26 ℃温水的圆形水池中进行,水池直径为160 cm,深70 cm,水深40 cm,分为4个象限,一个9 cm×9 cm圆形平台置于第4象限水平面下1 cm,摄像机位于水平面上方170 cm处,实验一共为6 d,前5.5 d为学习训练,最后1 d下午开始进行测试。迷宫分析软件记录小鼠游泳总路程、第4象限活动时间、站台穿越次数和周边活动时间等数据,以分析小鼠学习和记忆能力。水迷宫实验结束后多聚甲醛灌注,收集12月龄小鼠脑组织,随后石蜡包埋。
1.3 取材 在小鼠进行水迷宫检测后,麻醉,200 ml 4%多聚甲醛灌注后获得大脑,放置在70%乙醇内,随后用二甲苯处理,石蜡包埋,随后用于免疫组织化学检测。
1.4 免疫组化检测海马及皮质Aβ斑块沉积 将两组小鼠石蜡包埋的脑组织置于切片机上,获得厚度为5 mm的连续冠状切片,间隔为200 mm,将切下的组织置于载玻片上;进行常规脱蜡,抗原修复,然后磷酸盐缓冲液(PBS)冲洗3次;为阻断内源性过氧化物酶活性,将载玻片置于3%双氧水中,并在室温下孵育20 min,PBS冲洗;滴加山羊血清(1∶10,Solarbio,#SL038),37 ℃孵育30 min;然后在切片上滴加兔抗β淀粉样蛋白抗体(1∶400,Cell Signaling Technology,#9888S)放入4 ℃孵育过夜;室温复温30 min,PBS冲洗3次;加入二抗工作液:辣根过氧化物酶标记的羊抗兔IgG(1∶200,Solarbio,#SE134),37 ℃孵育30 min,PBS冲洗3次;用二氨基联苯胺(DAB)显色试剂盒显色,苏木素复染、盐酸酒精分化、脱水封片。通过连接至光学显微镜的相机捕获图像,使用Image J软件计数每只小鼠切片中×20显微镜获取的海马和皮质中Aβ斑块沉积的百分比。
1.5 免疫组化检测CA3以及CA1区域NeuN、ki-67表达 将石蜡包埋的两组小鼠脑组织置于切片机上,得厚度为5 mm的连续冠状切片,置于载玻片上。常规脱蜡后进行抗原修复,室温下用3%双氧水处理切片以阻断内源性过氧化物酶,PBS冲洗后孵育一抗:鼠抗NeuN(1∶100,Millipore,America,#MAB377),鼠抗ki-67(1∶200,abbkine,America,#ABM40064);4 ℃孵育过夜,PBS常规冲洗继而加入二抗:辣根过氧化物酶标记的羊抗小鼠IgG(1∶200,Solarbio,China,#SE131),DAB显色,苏木素复染,盐酸酒精分化,脱水封片。通过显微镜相机捕获图像,使用Image J软件计数每只小鼠切片中×40显微镜获取的海马CA3、CA1区域的NeuN阳性细胞百分比以及ki-67阳性细胞百分比。
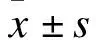
2 结果
2.1 两组小鼠的学习和记忆能力比较 两组小鼠总路程(图1A,F=0.788,P<0.05)、第4象限活动时间(图1B,F=2.333,P<0.05)、站台穿越次数(图1C,F=0.025,P<0.05)、周围活动时间比较差异有统计学意义(图1D,F=1.507,P=0.05);与C57组小鼠相比,AD组小鼠的行为学测试显示,学习和记忆能力明显损害。

图1 两组小鼠学习及记忆能力比较
2.2 两组小鼠海马及皮质Aβ斑块密集沉积比较 AD组小鼠Aβ斑块主要分布在海马以及皮质区域,呈深棕色,与C57组比较分布更为密集。计数两组小鼠海马与皮质Aβ斑块沉积数量,结果显示,在海马区,AD组斑块沉积数百分比为(5.019%±1.457%),而C57组为(0.176%±0.079%);在皮质区,AD组斑块沉积数百分比为(7.429%±2.002%),而C57组为(0.571%±0.159%)。两组比较差异有统计学意义(F=14.073,P<0.05;F=7.761,P<0.05)。见图2。
2.3 两组小鼠CA3和CA1区NeuN阳性细胞及ki-67阳性细胞表达比较 NeuN是成熟神经元特异性标记物,检测NeuN阳性细胞数可以评估CA3、CA1区神经元密度。图3显示,与C57组小鼠相比,AD组小鼠CA3和CA1区NeuN阳性细胞数量减少,AD小鼠CA3和CA1区域NeuN阳性细胞百分比分别为(4.769%±1.038%)、(5.029%±1.176%),C57小鼠CA3和CA1区域NeuN阳性细胞百分比为(16.161%±1.516%)、(13.121%±2.356%)(F=2.209,P<0.05;F=4.160,P<0.05),提示AD组小鼠CA3、CA1区神经元丢失较C57组严重。
Ki-67是细胞增殖标记物,检测ki-67阳性细胞数评估CA3、CA1区细胞增殖能力。图4显示,与C57组小鼠相比,AD组小鼠CA3和CA1区ki-67阳性细胞数量下降,AD小鼠CA3和CA1区域ki-67阳性细胞百分比分别为(4.872±1.029)%、(4.150±1.239)%,C57小鼠CA3和CA1区域ki-67阳性细胞百分比为(10.551±2.004)%、(8.354±1.458)%(F=3.656,P<0.05;F=0.005,P<0.05),提示AD组小鼠较C57组小鼠CA3、CA1区细胞增殖能力下降。

图2 两组小鼠海马及皮质Aβ斑块密集分布比较

图3 两组小鼠CA3和CA1区NeuN阳性细胞表达比较

图4 两组小鼠CA3和CA1区ki-67阳性细胞表达比较
3 讨论
大脑中的Aβ是由淀粉样前体蛋白(APP)经β-淀粉酶和γ-分泌酶的连续切割产生。β-分泌酶切割生成APP片段和C99肽,C99肽继而再由γ-分泌酶切割产生Aβ[9]。Aβ1-42和Aβ1-40是Aβ中最常见的亚型,在脑脊液和血浆中,Aβ1-40是Aβ1-42的10倍和1.5倍。Aβ1-42是AD病理学中的关键因素,能够形成Aβ斑块沉积的核心。此外,Aβ1-42具有神经毒性,因此,大脑中的Aβ沉积是AD发病机制的早期毒性事件[10-11]。本研究的Aβ斑块沉积及行为学检测提示,12月龄AD转基因小鼠较同月龄C57正常小鼠,Aβ斑块沉积在海马及皮质区域密集分布,并且小鼠的空间学习及记忆能力明显受损。这与Wirths[12]的实验结果相似,12~14月龄APP转基因小鼠的神经病理学显示,海马中存在大量的淀粉样沉积物,小鼠学习和记忆能力受损。Unger等[2]的研究结果也发现这一现象,Aβ斑块沉积在4月龄APP/PS1转基因小鼠海马中就可以检测到,随着月龄的增长,海马以及皮质中斑块负荷显著增加。我们既往研究发现,Aβ质粒免疫治疗可以促进Aβ清除,减轻神经炎症反应,从而缓解小鼠的空间学习和记忆损害[13],以上研究提示,Aβ斑块沉积的增多可以引起AD小鼠空间学习和记忆损害。
Aβ沉积可以引起脑实质的损伤,影响最为显著的是海马等与智能有关的区域,从而引起学习和记忆障碍[14]。海马DG、CA3和CA1紧密聚集的神经元构成单向神经回路,研究报道,神经退行性疾病过程中CA3、CA1区域与学习记忆功能息息相关[15]。在海马注射Aβ1-42可引起CA3区广泛的神经元变性,表现为CA3中神经元丢失及核收缩,神经元丢失导致AD小鼠脑中学习和记忆能力受损,因此,控制神经元丢失可能是延迟甚至逆转AD发展的潜在疗法[16]。Padurariu等[17]的研究证实,与年龄相匹配的对照组相比,AD患者海马区神经元密度显著降低,尤其是在CA3和CA1区域。在APP/PS1转基因小鼠的研究中发现,早期即出现神经元选择性丢失,而Aβ是引起神经元丢失的主要因素[18]。本研究表明,AD小鼠Aβ的沉积增多促进小鼠CA3和CA1神经元丢失,进而导致小鼠学习和记忆能力受损。导致神经元丢失的原因存在争议,体外实验证明,Aβ促进细胞外Ca2+内流,增加细胞对氧化应激和兴奋性毒性的易感性,从而加剧细胞死亡[19]。Aβ斑块具有毒性,可减少乙酰胆碱(Ach)的合成,合成受阻后导致神经元功能减退或者死亡[20],也有研究报道,在AD小鼠脑内,Aβ的沉积使星型胶质细胞被激活,产生神经炎症,使神经元数目显著丢失。
在成年期,神经再生主要发生在以下2个区域:海马齿状回的颗粒下层和侧脑室的室管膜下区,但是也不排除其他区域依旧存在神经再生情况[21]。增殖的神经干细胞(NSCs)(表达ki-67)分化为中间前体细胞D,D细胞迁移为成神经细胞,经历4~8周,其生理学和解剖学接近完全成熟的神经元(表达NeuN),接收来自内嗅皮层的信息并投射到CA3区域,进一步传递到CA1区域,神经再生过程增加了海马回路的可塑性以及复杂性[22-23]。Zeng等[24]在APP/PS1/Nestin-GFP三重转基因小鼠与正常小鼠比较的研究中发现,转基因小鼠神经干细胞数目减少,未成熟神经元的存活率下降。并且还有研究提示,APP/PS1转基因小鼠神经再生下调,其神经干细胞增殖下降,神经元减少导致小鼠学习和记忆障碍[25]。但是Jin等[26]发现,AD患者的海马组织与非AD患者的海马组织比较,AD患者海马区成熟神经元的存活数目有所增加,海马区神经再生上调,上调原因可能是因为机体的一种内源性代偿机制,在病理条件下开启对认知障碍的保护[27],但是随着时间的推移,这种代偿机制是否可以一直持续,尚不明确,有待于进一步研究不同时期的变化。有研究显示,AD患者海马的CA1区域ki-67阳性细胞数目增加[28],而本研究中ki-67数目减少,原因可能是检测ki-67的时间阶段不一致。当神经炎症加剧时,增殖细胞数目可能增加,并且其大部分增殖的细胞可能分化为胶质细胞,随后神经干细胞增殖能力远远低于正常小鼠,ki-67将会迅速下降。本实验研究检测CA3、CA1区域ki-67阳性细胞的表达,与C57组正常小鼠相比,AD小鼠ki-67阳性细胞数目下降,提示AD小鼠神经干细胞增殖能力下降,这也可能是相同区域NeuN阳性细胞代表的神经元数目减少的重要原因。神经元丢失是导致AD小鼠脑中学习和记忆受损的不可逆的过程,因此,操控神经再生以补偿神经元丢失可能是延迟甚至逆转AD进展的潜在疗法。
综上所述,与同月龄的C57正常小鼠相比,12月龄AD小鼠脑内有大量的Aβ斑块沉积,并且海马亚区CA3、CA1区出现神经元丢失明显及细胞增殖能力下降,提示下调此区域的神经再生,可导致小鼠学习和记忆能力明显损害。但是针对Aβ斑块沉积引发的神经元丢失及神经再生下降的机制尚不明确,是以后研究的方向,调节神经再生将成为缓解甚至逆转AD的崭新治疗靶点。
