mtDNA变异对中国冠心病患者血脂水平的影响
2020-06-08赖伟华李汉平钟诗龙
秦 敏,赖伟华,李汉平,钟诗龙*
0 引言
目前,冠心病(Coronary artery disease,CAD)的患病率和死亡率在全世界范围内居高不下[1-3],其引导因素有很多种,血管内斑块的形成与血脂胆固醇异常升高和聚集密不可分。临床诊断胆固醇异常主要通过检测血浆中低密度脂蛋白胆固醇(Low-density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(High-density lipoprotein cholesterol,HDL-C)和总胆固醇(Cholesterol,CHOL)等指标的含量。一项基于不同种族的前瞻性大规模队列研究显示,LDL-C是心血管事件有力且独立的预测因子[4]。此外,在没有主要心血管危险因素且LDL-C浓度处于正常水平的人群中,LDLC依然与早期系统性动脉粥样硬化的发生和严重程度独立相关[5]。总胆固醇含量过高本身不会引起症状,但会增加出现严重健康状况的风险[6]。因此,鉴别引起体内胆固醇水平异常的不良因素和潜在机制对改善冠心病患者的早期诊断和不良预后极为重要。
冠心病患者体内胆固醇水平个体差异极为显著,其血浆浓度受到遗传学、表观遗传学、种族和环境等因素的共同影响。单核苷酸多态性(SNP)是遗传变异最为常见的一种形式,在临床精准医疗方面有重要的指导意义。前期基于欧洲白种人的研究发现,3个位于常染色体的rs4420638、rs2954021和rs660240变异不仅与循环LDL-C浓度相关,还与冠心病发生风险显著相关[7]。此外,研究发现,ACE2基因上的多个SNP变异位点与血浆HDL-C浓度显著相关[8]。然而,目前发现的与血脂胆固醇浓度相关的变异位点主要存在于常染色体中,线粒体基因变异和LDL-C、HDL-C及CHOL之间的关系仍不清楚。因此,识别新的与胆固醇显著相关的线粒体DNA(Mitochondrial DNA,mtDNA)变异对解释冠心病潜在病理机制有重要意义。
线粒体DNA变异是冠心病患者胆固醇水平异常的潜在遗传学诱因之一。线粒体作为细胞的能量供应场所,在冠状动脉粥样硬化血管病变中发挥着重要的作用[9]。mtDNA呈裸露的环状双链状态,人线粒体基因组全长16.5 kb左右,共编码37个基因[10]。mtDNA分为D环区(Displacement loop)和编码区。D环区虽无编码功能,但参与复制与转录,其碱基处于高度可变状态。D环区以外的序列均为外显子并编码基因。因此,相对于常染色DNA变异,线粒体基因SNP变异更有可能发生在编码区并直接影响其所编码的基因所参与调控的生理学功能。研究显示,线粒体中的胆固醇过多会导致线粒体功能障碍,并通过线粒体膜顺序的改变而导致细胞谷胱甘肽的线粒体转运载体损伤[11-13]。此外,先前的研究发现,线粒体中胆固醇的过度积累与心血管组织中线粒体损伤和心肌缺血损伤具有重要联系[14],同时,线粒体的累积损伤又与动脉粥样硬化的发生发展有关[15]。由此可见,LDL-C等血脂伴随的胆固醇过度积累可能通过损伤线粒体功能而诱导动脉粥样硬化的产生。
目前发现的与循环胆固醇浓度相关的线粒体SNP变异位点较少。最早有研究发现,在白人运动员中,线粒体DNA单倍型类群HV与LDL-C的升高有关,而单倍型JT则与LDL-C的降低相关[16]。Honmyo等[17]发现,线粒体基于RNR2上的5178C→A多态性与血浆升高的HDL-C浓度显著相关。此外,一项基于中国高血压患者的研究也显示,线粒体tRNAMet突变与血浆CHOL和HDL-C显著相关[18]。然而,几乎没有研究关注中国冠心病患者线粒体基因组遗传变异与LDL-C、HDL-C和CHOL的关系。本研究拟采用基因芯片测序的方法,分析全部线粒体基因SNP位点与冠心病患者血浆LDL-C、HDL-C和CHOL浓度的相关性,找到新的影响血脂LDL-C、HDL-C和CHOL浓度的变异位点,为冠心病患者的精准降胆固醇治疗提供新的理论依据和潜在药物分子靶点。
1 材料和方法
1.1 研究对象及入排标准 本研究共入选857例确诊为稳定型冠心病的患者。所有患者均接受经皮冠状动脉介入手术(PCI)治疗并服用降胆固醇药物阿托伐他汀。这些患者均从广东省人民医院心内科入选,入选时间为2010年2月至2014年1月。入选病例的基线资料从广东省人民医院病历系统查询。所有患者均详细记录其年龄、性别、既往病史(糖尿病、心衰和高血压)、用药史[β受体阻滞剂(BB)、血管紧张素转换酶抑制剂(ACEI)、钙离子通道拮抗剂(CCB)和质子泵抑制剂(PPI)]和入院时的生化指标检测情况(肝功能、肌酐、血脂和血糖等)。本研究经广东省人民医院的医学研究伦理委员会批准,纳入研究的每位患者均签署了知情同意书。入选标准:年龄18~80岁的经冠状动脉造影术(CAG)确诊为稳定型冠心病并行PCI治疗的中国汉族人;排除标准(凡符合以下任意一条即被排除):伴随肾功能不全(血清肌酐水平>230 μmol/L)或肾移植、肝功能不全(血转氨酶水平>80 U/L)或肝硬化、处于孕期以及并发癌症等恶病的患者。
1.2 试剂与仪器 自动核酸提取仪(TGuide M16,天根生化科技有限公司,北京);血液基因组DNA提取试剂盒(OSR-M102,天根生化科技有限公司,北京);NanoDrop 2000(Thermo Scientific,美国);低速离心机(Eppendorf,美国);TAE缓冲液(广州威佳科技有限公司,中国);琼脂糖(9012-36-3,BIOWEST,美国);EB替代品GelRed(Biotium,美国);Gel Doc 1000凝胶成像系统(Bio-rad,美国);核酸电泳仪(JM-250,大连捷迈科技有限公司,中国),Syngo Dynamics心血管成像软系统(Siemens Medical Solutions,美国)。
1.3 血样采集 为降低食物或营养物质对血脂水平的影响,入选患者于每日凌晨空腹采集血样4 ml于EDTA抗凝管中。随后,4 ℃、3 000 r/min离心10 min,分离血细胞和血浆,-80 ℃保存备用。
1.4 血细胞基因组DNA提取 利用自动核酸提取仪以及配套的血液基因组DNA提取试剂盒从血细胞中提取基因组DNA。获得的基因组DNA采用超微量生物检测仪NanoDrop 2 000进行初步的纯度检测,要求1.8≤A260/A280<2.0,A260/A230>2.0。纯度符合要求的DNA随后进行琼脂糖凝胶电泳,以判断DNA分子的完整性,要求DNA样品条带清晰明亮,无拖尾或不规则迁移。
1.5 基因分型 经纯度和完整性质检合格后的DNA样品采用Illumina公司的GSA芯片[Infinium Global Screening Array-24 v1.0(GSA)Bead Chip]进行全基因组DNA分型。GSA芯片是一款先进的基因分型芯片,包含大量功能基因位点,被用于群体规模的遗传研究、编译筛选和精准医学研究。该芯片可成功分型700 078个SNP位点,其中140个SNP位点位于线粒体基因上。
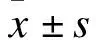
2 结果
2.1 基线资料 本研究共顺序入选857例经PCI术治疗的冠心病患者,其临床基线资料统计情况见表1。本队列人群LDL-C、HDL-C和CHOL的平均水平分别为(2.98±0.94)、(0.96±0.25)、(4.29±1.13)mmol/L。
2.2 mtDNA变异与LDL-C的相关性 线粒体基因和LDL-C关联性分析结果显示(图1),在51个线粒体SNP位点中,排除年龄、性别和肝肾功能对LDL-C的影响后,3个SNP位点与LDL-C显著相关(P<0.05),分别为G513A、G3010A和C1048T,而G513A在经过FDR校正后依然表现出与LDL-C显著相关(FDR=0.033,表2和图2)。在这3个位点中,携带G513A和1048T突变基因型患者体内LDL-C水平高于野生型,而携带3010A突变基因型患者体内LDL-C水平低于野生型,每个位点的基因型与具体LDL-C浓度的关系见表3。
2.3 mtDNA变异与HDL-C的相关性 全部线粒体SNP位点与HDL-C血浆水平的关联性分析结果见图1,结果显示,4个SNP位点与HDL-C水平显著相关(P<0.05),分别为G1438A、C11536T、G7853A和T14502C,所有位点FDR校正后差异均无统计学意义(表2)。在这4个位点中,携带11536T和7853A任意一种突变基因型的患者血浆HDL-C水平均高于野生型;而携带1438A和14502C任意一种突变基因型的患者血浆HDL-C水平均低于野生型(图3),具体结果见表3。

表1 857例冠心病患者临床基线资料统计情况
2.4 mtDNA变异与CHOL的相关性 与CHOL的关联性分析结果见表2。结果显示,4个SNP与血浆总胆固醇浓度显著相关(P<0.05),分别为G513A、G3010A、C8964T和G1438A,所有位点经FDR校正后差异均无统计学意义。这4个位点的基因型与血浆CHOL的对应关系如表3和图4所示,除G513A以外,携带其余3个位点中任意一个位点的患者体内总胆固醇水平均低于无突变者。此外,G513A和G3010A同时与LDL-C和CHOL显著相关,G1438A同时与HDL-C和CHOL显著相关(P<0.05)。
2.5 与胆固醇相关的mtDNA变异与BNP的关系 为了阐明这些与血浆胆固醇浓度显著相关的mtDNA变异位点与冠心病患者心功能的相关性,本研究进一步分析了上述8个位点与BNP浓度>500 ng/L和≤500 ng/L的相关性。结果如表4所示,在这8个位点中,与HDL-C显著相关的T14502C位点与BNP浓度升高显著相关,剩余7个位点差异均无统计学意义。这些结果表明,T14502C位点变异可能会引起冠心病患者体内有益脂质HDL-C降低,从而导致心功能紊乱。

表2 线粒体DNA变异和血浆各类胆固醇浓度的相关性

图1 51个线粒体SNP与血浆LDL-C、HDL-C和CHOL浓度关联性分析
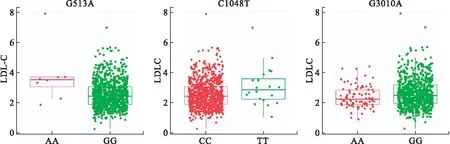
图2 线粒体变异位点G513A、C1048T和G3010A对血浆LDL-C浓度的影响

图3 线粒体变异位点G1438A、G7853A、T14502C和C11536T对血浆HDL-C浓度的影响
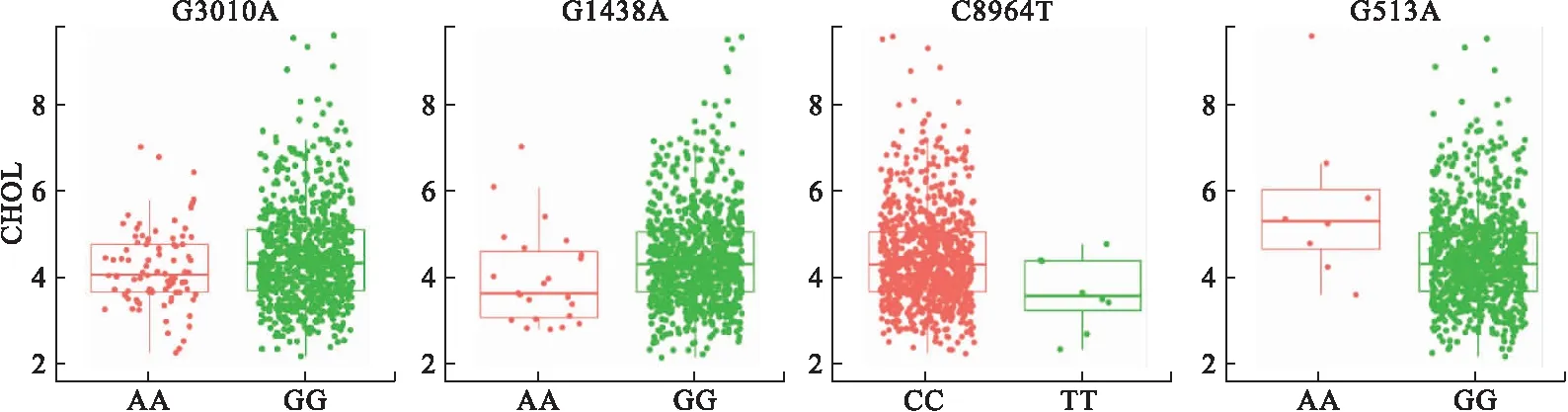
图4 线粒体变异位点G3010A、G1438A、C8964T和G513A对血浆CHOL浓度的影响
3 讨论
本文分析了857例冠心病患者mtDNA变异与血浆中各类胆固醇(LDL-C、HDL-C和CHOL)的相关性。结果发现,3、4、4个SNP位点分别与LDL-C、HDL-C、CHOL显著相关,并且G513A在经过FDR校正后依然与LDL-C显著相关。此外,进一步分析发现,G513A和G3010A同时与LDL-C和CHOL显著相关,G1438A同时与HDL-C和CHOL显著相关。进一步分析还发现,与HDL-C显著相关的位点T14502C还与冠心病患者心功能变差相关。这些研究结果为进一步解释冠心病患者体内胆固醇水平差异大和不良预后提供了潜在的理论基础,并为冠心病患者的精准医疗提供了潜在的药物干预靶点。

表3 8个候选SNP不同基因型间血浆LDL-C、HDL-C和CHOL浓度的差异

表4 与胆固醇相关的SNP变异与心功能的相关性
本研究发现的8个与LDL-C、HDL-C和CHOL水平显著相关的线粒体SNP变异中,G513A位于线粒体基因D环区,C1048T和G1438A位于MT-RNR1基因上,G3010A位于MT-RNR2基因上,C11536T和T14502C位于MT-ND基因家族,剩余2个位点G7853A和C8964T分别位于MT-CO2和MT-ATP6基因。
通过对线粒体基因变异和血浆胆固醇浓度的关联性分析发现,位于线粒体基因D环区的G513A变异位点与冠心病患者血浆LDL-C和CHOL水平的相关性最为显著,且携带513A碱基的患者血浆CHOL和LDL-C浓度均显著高于携带513G碱基的患者,表明该位点变异可能导致患者体内循环胆固醇浓度上升,从而加重动脉粥样硬化的进展。线粒体D环区虽然不编码任何功能性的蛋白质,但已确认D环区包含重链复制的初始位点以及轻链和重链的转录启动子序列。因此,D环区是线粒体DNA复制和转录的必要调控区域。此外,研究表明,线粒体DNA为了应对氧化应激,D环区的累计突变率显著高于mtDNA其他区域[19]。这种高突变率与多种病理生理表现相关,早期研究发现,D环区的mtDNA T16189C突变是诱导胰岛素抵抗的遗传因素,并可能与成年人心血管疾病和中风伴随的血管病变相关[20]。综上,线粒体基因D环区DNA变异可导致包括心血管疾病在内的多种疾病的发生,本研究发现,同时与LDL-C和CHOL显著相关的位于D环区的G513A位点可能是冠脉粥样硬化患者血管病变的潜在诱发因素。
本研究发现,MT-ND411536C→T和MT-ND614502T→C与血浆HDL-C显著相关,这2个位点所在基因编码线粒体NADH脱氢酶(MD-ND)家族,也称为复合物Ⅰ,分别构成复合物的亚基4和亚基6。进一步研究发现,MT-ND614502T→C属于错义突变,可导致原密码子所编码的异亮氨酸变为缬氨酸(Ile->Val)。NADH脱氢酶是呼吸系统电子传递链中最大的复合物[21],从糖和脂质氧化产生的NADH中获得能量,并将能量转化为横跨线粒体内膜的电位差,随后此电位差被用于合成ATP[22]。由于复合物Ⅰ对能量供应至关重要,当其功能发生紊乱时,多种疾病也随之而来。一项基于日本人的研究显示,MT-ND25178A→C多态性与血清HDL-C和TG水平显著相关[17]。此外,最近的一项研究发现,NADH脱氢酶亚基6基因P25L(ND6P25L)突变可显著增加心肌病的严重程度[23]。本研究也发现,MT-ND6基因上的14502T→C变异可以导致血浆有益胆固醇HDL-C浓度降低,从而导致心功能变差。然而,复合物Ⅰ调控HDL-C血浆浓度,继而引起心功能降低的潜在分子机制尚不清楚,亟待进一步的研究对本文所述位点进行多中心队列的验证和潜在分子机制的研究。
除了MT-ND基因家族与血脂水平显著相关以外,本研究发现,MT-CO2G7853A和HDL-C水平显著相关,该位点位于线粒体细胞色素C氧化酶亚基2(MT-CO2)基因外显子区,其突变引起原密码子所编码的缬氨酸被异亮氨酸替代(Val->Ile),从而阻止MT-CO2蛋白质正常生理学功能的发挥。MT-CO2编码的蛋白质共包含226个氨基酸,构成细胞色素C氧化酶(复合物Ⅳ)的第2个亚基,主要参与线粒体呼吸链中催化氧气还原为H2O的过程。MT-CO2突变将导致线粒体复合物Ⅳ合成不足[24],而复合物Ⅳ的缺乏与心肌肥厚[25]和肌张力低下[26-27]等多种临床表型相关。本文首次发现7853G→A突变可引起中国冠心病患者体内血脂HDL-C水平升高,这表明冠心病患者血脂HDL-C浓度水平个体差异大可部分归因于线粒体基因多态性。然而,该变异与HDL-C血浆浓度之间的分子机制理论基础还有待进一步观察。
MT-RNR11048C→T、MT-RNR11438G→A和MT-RNR2G3010A所在基因分别编码线粒体中12S核糖体RNA(12S rRNA)和16S核糖体RNA(16S rRNA)。12S rRNA主要参与胰岛素敏感性和代谢平衡调控过程。此外,该蛋白作为叶酸循环的抑制剂,可以减少嘌呤的从头合成,从而导致嘌呤从头合成通路中间体5-氨基咪唑-4-羧酰胺(AICAR)的积累和代谢调节剂5′-磷酸腺苷依赖的蛋白激酶(AMPK)的活化。研究发现,MT-RNR1基因A1555G变异与人类主动脉的动脉粥样硬化病变显著相关[10],该位点在其他队列的研究中同样被证实[28]。另外,MT-RNR1基因突变同样可以造成线粒体呼吸链复合物Ⅳ缺乏,从而对人体各个器官或组织造成不同程度的影响。流行病学研究显示,复合物Ⅳ缺乏患者常表现出心室肥厚这一临床表型[25]。这些研究表明,线粒体MT-RNR1基因变异在冠状动脉粥样硬化病变中起着重要的作用,而本研究发现,该基因与血浆胆固醇显著相关,提示该基因可能通过调控血浆中胆固醇的含量而参与动脉粥样硬化病变过程。
MT-ATP6C8964T位点所在基因编码线粒体中的ATP合成酶膜亚基6。该酶也被称为复合物Ⅴ,参与电子传递链中氧化磷酸化的最后一步。MT-ATP6基因突变可导致线粒体复合物Ⅴ缺乏,该复合物缺乏的常见的临床表现为肥厚型心肌病,并可导致心衰。当ATP合成酶生物合成被改变时,该酶在结构上被修饰且其生理学功能无法正常进行。此时,细胞能量供应受到损害,导致ROS生成失调[29]。此外,人肝细胞表面存在线粒体ATP合酶的2个主要蛋白,即α链和β链,与HDL分解代谢有关,可调控体内胆固醇的含量[30]。然而,细胞如何将这些蛋白质引导至细胞表面以及如何调节其细胞表面的表达尚不清楚,需要进一步研究。
本研究有针对性地分析了线粒体DNA变异与冠心病患者血浆各类胆固醇的相关性,结果初步发现了3、4、4个(8个唯一的)SNP位点分别与血浆LDL-C、HDL-C和CHOL显著相关,其中位于D环区的G513A经FDR校正之后依然与LDL-C显著相关,与HDL-C显著相关的T14502C变异与心功能变差相关。总之,本研究证实,冠心病患者体内胆固醇水平差异大可部分归因于线粒体基因的单核苷酸多态性,这为进一步解释动脉粥样硬化发生发展的机制提供了潜在的遗传学理论基础,并为冠心病患者的精准治疗提供了潜在的药物分子靶点。
