环孢素A调节自噬对人滋养细胞氧化应激损伤的影响
2020-06-08徐秋霞马燕琳
徐秋霞,马燕琳
0 引言
氧化应激是不良妊娠发生的关键因素,氧化应激状态下活性氧(ROS)大量产生,损伤滋养细胞,引起胎盘浅着床等异常,导致胎儿宫内生长受限,以及相关的胎盘病理改变,如先兆子痫、死产和胎盘早剥等[1-2]。环孢素A(Cyclosporine A,CsA)是一种免疫抑制药物,研究显示,CsA可以促进绒毛滋养细胞增殖、运动、迁移和侵袭,可以显著改善妊娠结局[3]。早孕期间滋养细胞处于生理缺氧和低营养状态,在这种压力环境下一种适应性线粒体自噬增强可以降低滋养细胞ROS水平,维持氧化和抗氧化平衡,保护细胞的完整性[4]。任何原因引起的这种平衡破坏都可以导致胎盘形成和发育异常,最终发生病理妊娠[5]。本研究使用永生化的人胎盘滋养细胞株HTR-8/SVneo,利用过氧化氢(Hydrogen peroxide,H2O2)构建氧化应激细胞模型,在此基础上探讨CsA对HTR-8/SVneo自噬的调节,以及CsA抗氧化对胎盘滋养细胞的保护作用。
1 材料与方法
1.1 主要试剂与仪器 人胎盘滋养细胞株HTR-8/SVneo购自中科院上海细胞生物科学研究所,DMEM/F12培养基、胎牛血清(Fetal bovine serum,FBS)购于美国Gibco公司,CsA购于美国Sigma公司,自噬体膜型(LC3-II)抗体和β-actin抗体购于美国Bioscience公司,丙二醛(MDA)、超氧化物歧化酶(SOD)和ROS检测试剂盒购自南京建成生物工程研究所,RIPA蛋白裂解液、细胞凋亡流式细胞仪检测试剂盒购自北京碧云天生物科技有限公司,细胞培养箱和全波长酶标仪购自美国Thermo公司,流式细胞仪为美国贝克曼库尔特公司产品。
1.2 细胞培养 HTR-8/SVneo细胞培养于10% FBS的DMEM/F12培养基中,置于5% CO2、37 ℃细胞培养箱。
1.3 氧化应激细胞模型构建 按照李美和等[6]的方法构建H2O2氧化应激HTR-8/SVneo细胞模型,方法简述如下:细胞接种于6孔板,2×105个细胞/孔,过夜培养细胞贴壁后,300 μmol/L H2O2处理HTR-8/SVneo细胞3 h,进行后续各项试验。实验分为对照组、氧化应激组、低剂量CsA组和高剂量CsA组,每组设置3个复孔。其中对照组不做任何处理,氧化应激组给予H2O2诱导氧化应激反应,低剂量CsA干预组在给予H2O2诱导氧化应激细胞模型前,使用2 μmol/L CsA预处理12 h,高剂量CsA干预组在给予H2O2诱导氧化应激细胞模型前,使用4 μmol/L CsA预处理12 h。
1.4 细胞凋亡检测 胰酶消化后,收集上述四组细胞,按照细胞凋亡流式细胞仪检测试剂盒说明书操作,加入荧光FITC标记的Annexin V和碘化丙啶(PI)避光染色1 h后,上流式细胞仪检测,仪器自带软件分析凋亡细胞所占的比例,为Annexin V+和Annexin V+PI+2个区域的细胞。
1.5 MDA、SOD和ROS的检测 MDA使用硫代巴比妥酸比色法检测,SOD使用化学比色法检测,ROS使用化学荧光法检测(DCFH-DA荧光探针,荧光激发波长500 nm,接收波长532 nm),按照试剂盒说明书操作加入相关试剂,MDA和SOD对照标准品计算表达水平和活性单位,ROS记录相对荧光光度值(Relative light units,RLU)。
1.6 自噬蛋白的Western blot检测 胰酶消化后,收集上述四组细胞,1 000 g离心10 min,细胞沉淀中加入200 μl蛋白裂解液,100 ℃水浴20 min后,10 000 g离心20 min,取上清即为细胞总蛋白,SDS-PAGE凝胶电泳,每孔加入10 μl总蛋白,80 V电泳2 h分离蛋白后,电转印至PVDF膜,5%脱脂牛奶封闭PVDF膜2 h后,按照抗体说明书加入LC3Ⅱ抗体(1∶1 000)或者β-actin抗体(1∶5 000)孵育过夜,加入辣根过氧化物酶标记二抗2 h后,显影X光片曝光,扫描X光片,BandScan5.0软件分析各条带灰度值,对照内参β-actin,计算各样品LC3Ⅱ的相对灰度值。
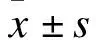
2 结果
2.1 CsA对氧化应激诱发滋养细胞凋亡的影响 对照组、氧化应激组、低剂量CsA组和高剂量CsA组HTR-8/SVneo细胞凋亡率分别为4.24%±0.72%、38.15%±4.63%、27.24%±3.16%、18.45%±2.28%,各组间比较差异有统计学意义(F=14.27,P<0.01)。其中低剂量CsA组和高剂量CsA组细胞凋亡率显著低于氧化应激组(P<0.01),高剂量CsA组细胞凋亡率显著低于低剂量CsA组(P<0.01)。见图1。
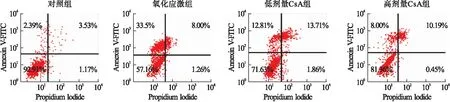
图1 细胞凋亡的流式细胞仪检测
2.2 CsA对滋养细胞氧化应激的影响 对照组、氧化应激组、低剂量CsA组和高剂量CsA组HTR-8/SVneo细胞MDA、SOD和ROS间比较差异有统计学意义(P<0.01)。其中低剂量CsA组和高剂量CsA组细胞MDA和ROS显著低于氧化应激组(P<0.01),高剂量CsA组细胞MDA和ROS低于低剂量CsA组(P<0.01),CsA组细胞SOD显著高于氧化应激组(P<0.01),高剂量CsA组细胞SOD显著高于低剂量CsA组(P<0.01)。见表1。

表1 四组MDA、SOD和ROS比较
注:与对照组比较,**P<0.01;与氧化应激组比较,△△P<0.01;与低剂量CsA组比较,##P<0.01
2.3 CsA对滋养细胞自噬蛋白的影响 对照组、氧化应激组、低剂量CsA组和高剂量CsA组HTR-8/SVneo细胞自噬蛋白LC3Ⅱ表达的相对灰度值分别0.23±0.05、0.11±0.02、0.38±0.07、0.75±0.13,各组间比较差异有统计学意义(F=15.11,P<0.01)。其中低剂量CsA组和高剂量CsA组细胞LC3Ⅱ蛋白相对灰度值显著低于氧化应激组(P<0.01),高剂量CsA组LC3Ⅱ蛋白相对灰度值显著低于低剂量CsA组(P<0.01)。见图2。

图2 LC3Ⅱ蛋白表达的Western blot检测
3 讨论
在早孕期间胎盘滋养细胞浸润子宫肌层,改建子宫螺旋动脉,重塑血管内皮,将胎盘血管的“低排高阻”逐渐转换为“低阻高排”状态。早期的“低排高阻”状态阻碍了母体血液进入胎盘,造成早孕期间生理性低氧和低糖环境,胎儿需要保持一个氧化与抗氧化平衡状态才能正常发育。氧化应激是一种氧化与抗氧化失衡状态,此时胎盘ROS生成过多,抗氧化物质产生减少,与流产、子痫前期等病理性妊娠的发生有密切关系[7]。
氧化应激损伤时ROS大量积累,ROS能氧化蛋白质、脂质和DNA,诱导细胞凋亡,本研究也观察到,H2O2处理滋养细胞诱发氧化应激损伤后滋养细胞凋亡率显著增加[8]。早孕期滋养细胞的生物学行为类似肿瘤细胞,研究显示,CsA可以促进肿瘤增殖,滋养细胞增殖方式与肿瘤相似,提示CsA有可能促进滋养细胞增殖。Yu等[9]研究发现,CsA可以促进滋养细胞增殖和侵袭。CsA能够与细胞浆内的环孢亲和素结合蛋白高亲和性结合,干扰和阻碍一些细胞因子的表达,调节免疫反应,有效抑制T细胞介导的细胞免疫应答,减弱机体对滋养细胞的排斥反应,促进细胞增殖和侵袭。Tang等[10]研究显示,CsA可以通过FAK-Src通路抑制滋养细胞的氧化应激反应。本研究显示,CsA干预后H2O2诱发的滋养细胞凋亡得到了显著抑制,说明CsA对滋养细胞氧化应激损伤可以发挥保护作用。MDA、SOD和ROS是监控氧化应激的常用指标,MDA是氧化应激反应的代谢产物,SOD是一种抗氧化应激活性酶,本研究观察到CsA干预后H2O2诱发的滋养细胞MDA和ROS升高得到了抑制,而SOD得到了显著提升,上述结果进一步说明CsA可以发挥抗氧化应激损伤作用。
自噬可以参与滋养细胞的凋亡调控。早孕期滋养细胞的生理性低氧状况下,自噬增强清除受损的线粒体和内质网,给细胞提供能量,保持细胞稳态[11]。研究显示,抑制自噬可以诱导滋养细胞凋亡[12]。LC3Ⅱ是一个自噬标志蛋白,在自噬增强时LC3Ⅱ表达增多[13]。本研究显示,CsA干预后LC3Ⅱ蛋白表达显著高于氧化应激组,说明CsA可以增强滋养细胞的自噬,对滋养细胞凋亡的抑制可能与此相关。
综上所述,本研究显示,CsA可以增强滋养细胞自噬,对氧化应激损伤诱发的滋养细胞凋亡起到抑制作用。
