基于PPK研究的癫痫患儿奥卡西平药动学参数分析
2020-06-08李惟滔王鸣璐陶玉瑛赵明明肇丽梅
李惟滔,王鸣璐,陶玉瑛,赵明明,肇丽梅
0 引言
奥卡西平(Oxcarbazepine,OXC)为第2代抗癫痫药物,是卡马西平的10-酮类衍生物,主要通过其羟基化衍生物(Monohydroxycarbamazepine,MHD)发挥药理作用,临床用于成人和儿童癫痫部分发作的单药或添加治疗[1]。OXC常见不良反应多与给药剂量相关[2]。关于儿童癫痫患者奥卡西平群体药代动力学(PPK)研究已有多项报道[3-13],但不同研究间存在差异。本文综述了儿童癫痫患者OXC PPK研究中纳入的协变量,最终模型及药动学参数信息,探讨影响癫痫患儿OXC PPK研究参数的因素,以期为OXC个体化治疗提供依据。
1 资料与方法
1.1 数据来源与检索策略 通过计算机检索CNKI、万方、维普、EMBASE和PubMed等中英文文献数据库,收集国内外公开发表的OXC的PPK研究,检索年限为2000年1月至2019年2月。通过检索关键词或其同义词完成文献检索。中文检索词为“奥卡西平”、“10-羟基卡马西平”、“群体”、“药动学”、“非线性混合效应模型”。英文检索词为“Oxcarbazepine”、“10-hydroxycarbazepine”、“Population”、“Pharmacokinetics”、“Nonlinear mixed effect”和“NONMEM”等。
1.2 纳入排除标准
1.2.1 纳入标准 根据以下标准纳入文献:①研究对象:0~18岁儿童癫痫患者;②研究药物:以OXC作为治疗药物;③研究类型:OXC的前瞻性或回顾性PPK研究;④研究方法采用非线性混合效应模型;⑤报道药动学参数群体典型值;⑥以中文或英文形式在国内外期刊上公开发表。
1.2.2 排除标准 排除以下文献类型:①对已发表的模型进行验证或应用;②采用除非线性混合效应模型以外的其他研究方法;③系统评价或Meta分析等综述类文章;④以其他语言形式发表。
1.3 数据提取 提取纳入分析研究的以下信息:①研究的基本信息(如研究的类型、患者人数、血药浓度样本数、给药方案等);②群体特征信息(如患者的年龄和体重均值及范围、性别、合并用药等);③群体药动学研究相关信息(如纳入分析的协变量、采用的模型、协变量的筛选方法、个体间变异和残差变异、最终模型及影响群体药动学参数的协变量、模型的验证方法等)。
2 结果
2.1 文献检索结果 通过计算机检索CNKI、万方、维普、EMBASE和PubMed等数据库和手工补充查找文献,共获得364篇研究,排除无关文献后,共获得18篇文献进行全文阅读并复筛。根据纳入排除标准,7篇研究因为以下原因被剔除:①3篇研究对象不包含儿童癫痫患者(1篇为动物研究,2篇为成人研究);②2篇文章为非公开发表在期刊的研究;③2篇研究对既往发表的群体药动学模型进行验证或应用。最终纳入11篇文献。
2.2 纳入研究的基本特征 纳入研究在2003-2019年发表,各研究的基本特征信息见表1。所有研究基于癫痫患者的血药浓度数据构建群体药动学模型,多采用稳态谷浓度数据,仅3项研究纳入了稳态峰浓度[11-13]。8项研究使用治疗药物监测数据[4-7,9,11-13],2项研究数据来源于临床试验[3,8],1项研究为药动学研究数据[10]。81.2%PPK研究采用高效液相色谱法(HPLC)测定OXC活性代谢物MHD血药浓度,2项研究分别使用液相色谱-质谱法(LC-MS)或酶增强免疫测定技术(EMIT)进行检测[8,11]。
2.3 群体药动学模型
2.3.1 模型构建 所纳入的研究主要通过协变量的分析、模型构建和验证,考察OXC活性代谢物MHD的群体药动学参数变化,定量分析个体间变异和残差变异,获得对MHD群体药动学参数清除率(CL)和表观分布容积(Vd)有显著影响的协变量。除1项研究报道采用二室模型外[10],其余研究采用一室模型构建药动学模型。个体间变异采用指数模型,残差变异采用比例和(或)加和的混合效应模型。7项研究采用内部验证法(如自举法、可视化预测检验等)评价最终模型的稳定性和预测性能,仅4项研究同时采用了外部验证法[3-4,7,9]。除3项研究使用Phoenix NLME软件进行模型构建和数据分析[5-6,9],其余研究均使用NONMEM软件。
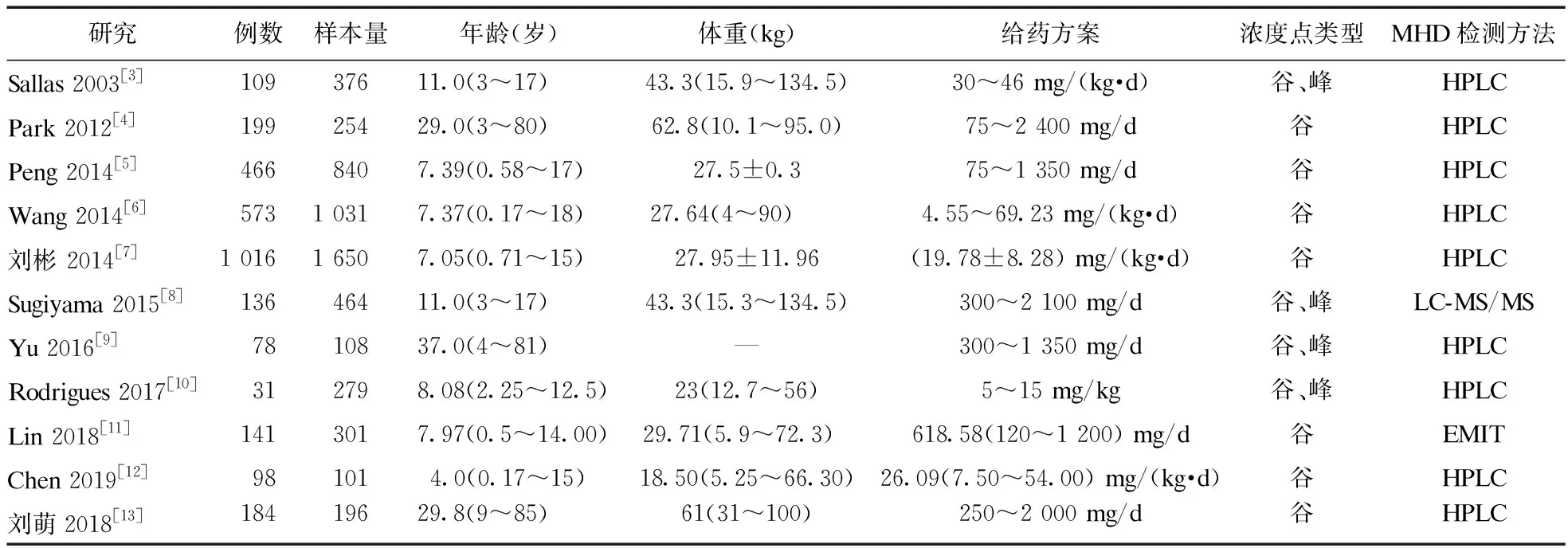
表1 纳入研究基本信息
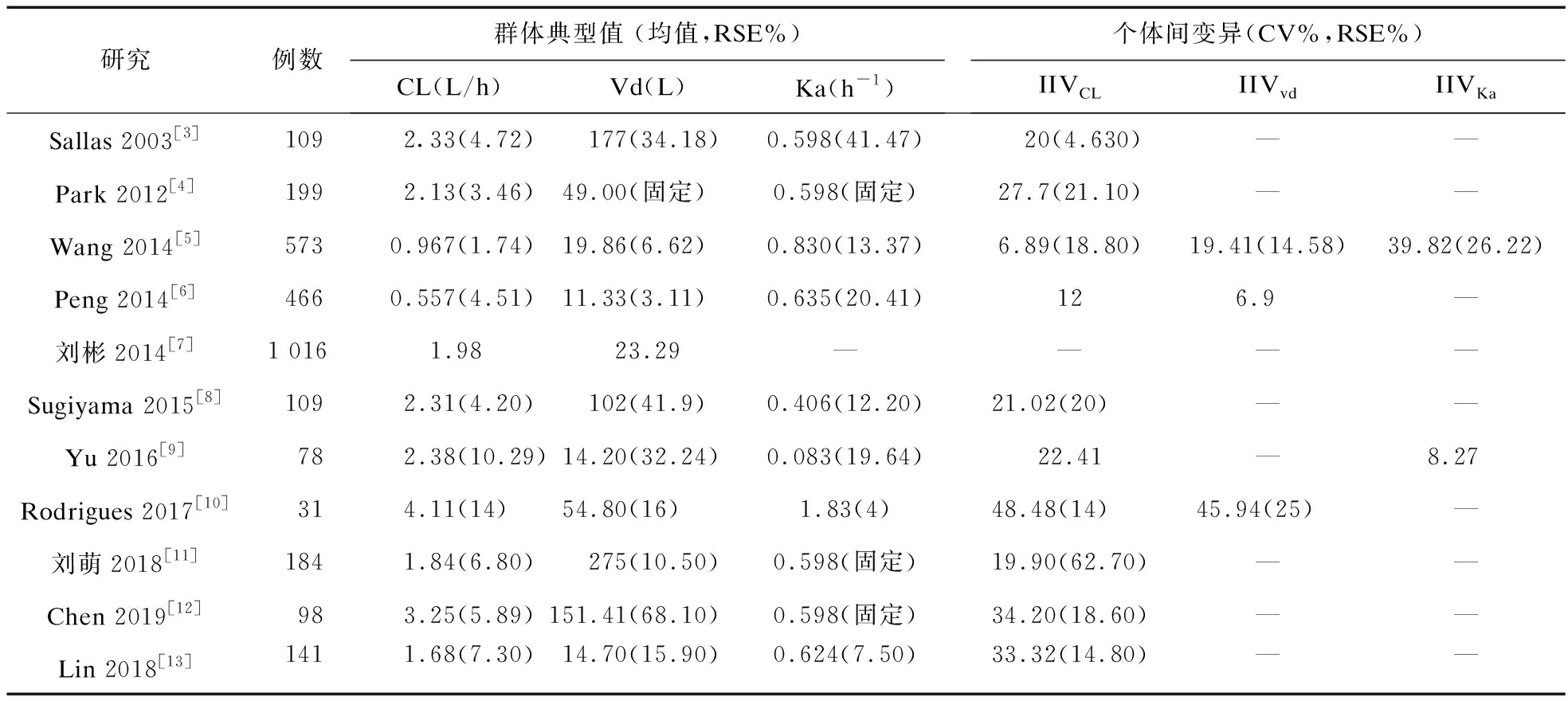
表2 儿童癫痫患者OXC群体药动学参数信息
注:RSE%:相对标准误%,CV%:变异系数,IIVCL:清除率个体间变异,IIVVd:表观分布容积个体间变异,IIVKa:吸收速率常数个体间变异
2.3.2 OXC群体药动学参数信息 各研究的OXC药动学参数信息见表2。在已发表的PPK研究中,药动学参数群体典型值存在差异且有不同程度的变异。在构建的一级吸收和消除的一室模型中,Ka群体典型值为0.645~0.83/h,个体间变异为8.27%~39.82%;Vd群体典型值为11.33~177 L,个体间变异为6.9%~19.41%;CL群体典型值为0.557~3.25 L/h,个体间变异为6.89%~34.2%。Rodrigues等[10]基于二室模型构建药动学模型,与一室模型PPK研究参数估算结果相比,该项研究MHD的Ka和CL群体典型值偏高且个体间变异较大。
2.4 影响奥卡西平群体药动学参数的因素 奥卡西平在体内的吸收、分布、代谢和排泄等药动学过程受多种药动学因素影响,不同的协变量选择影响PPK模型的建立,常见的协变量因素有:人口学特征(年龄、性别、体重等)、血液生化指标、遗传因素、合并用药和剂量等,这些因素不同程度地影响奥卡西平群体药动学参数的估算。
2.4.1 人口学特征因素 儿童患者因其自身生理特点,药物体内过程与成人存在差异。年龄可在一定程度上反映体重、脂肪分布、肝重、肝药酶活性及局部血液灌流情况[14]。刘彬等[7]基于1 016例中国儿童患者建立的OXC群体药动学模型显示,年龄为显著影响MHD体内清除率的协变量。Sallas等[3-4]研究发现,MHD的体重校正清除率随年龄的增加而减小,2~5岁癫痫儿童的MHD标准化药时曲线下面积比6~12岁儿童小30%。OXC及其代谢产物MHD均为亲脂性,受体内脂肪总量及身体总含水量变化影响,在已发表的研究中,体重和体表面积对PPK模型影响显著。
2.4.2 肝肾功能因素 OXC口服吸收后,在肝脏经肝细胞溶质芳基酮还原酶代谢转化为MHD发挥药理作用。OXC、MHD主要经肾脏排出体外,有报道,在肾功能不全的患者中,当肌酐清除率小于30 ml/min时,MHD的体内半衰期延长,药时曲线下面积增大2倍[15]。Yu等[9]基于78例癫痫患者的PPK研究发现,血液尿素氮(BUN)为显著影响Vd的协变量,丙氨酸氨基转移酶(ALT)为显著影响CL的协变量,随着ALT水平升高,MHD清除率逐渐降低,最终模型纳入ALT和BUN用于药动学参数的估算。
2.4.3 合并用药因素 癫痫患者常存在合用多种抗癫痫药或其他药物,而合并用药易发生药物相互作用,导致药代动力学参数改变,不良反应的发生率增加[16]。PPK法可定量分析药物间的相互作用,预测其对药动学参数的影响[17]。已发表的研究主要考察合用酶诱导剂(卡马西平、苯巴比妥和苯妥英钠)、酶抑制剂(丙戊酸)和新一代抗癫痫药(托吡酯和拉莫三嗪等)对MHD药动学参数的影响。Sallas等[3,5,7-8,10]研究显示,合用以上3种类型药物显著影响MHD药动学参数,并将其纳入最终模型用于患儿MHD体内药动学参数估算。Sallas等[3]研究结果显示,合用酶诱导剂可使MHD清除率增加约31%~35%。在Wang等[5]的研究中,分析合用酶诱导剂(16例)、酶抑制剂(36例)和新一代抗癫痫药(49例)的患者血药浓度数据,结果显示,合用酶诱导剂和新一代抗癫痫药可分别使 MHD体重校正清除率增加约17.4%和10.5%,而合用酶抑制剂可使MHD体重校正清除率降低约3%。但在Peng等其他3项PPK研究中[6,12-13],未发现合并用药对MHD药动学参数的影响。
2.4.4 基因多态性因素 MHD主要经鸟苷二磷酸葡萄糖醛酸转移酶(UDP-glucuronosyltransferase,UGTs)转化为无活性的葡糖苷酸复合物经肾排除体外[18-19]。UGTs和ATP结合盒式蛋白(ABC)分别为MHD和OXC代谢过程中最重要的代谢酶和转运体。代谢酶和转运体的基因多态性可影响药物的体内过程,导致药动学参数个体间变异。刘萌等[11]用184例癫痫患者的血药浓度数据建立的一级吸收和消除的一室模型中,考察了单核苷酸基因多态性(UGT2B7c.802T>C、ABCC2c.1249G>A、ABCC23972C>T)对MHD血药浓度的影响,结果将UGT2B7基因型纳入最终模型。该项研究报道UGT2B7(c.802T>C)基因多态性与MHD清除率显著相关,携带UGT2B7突变纯合子CC患者的MHD清除率较野生纯合子TT和杂合子TC患者MHD清除率增加17.9%。
2.4.5 给药剂量 药物体内暴露量与剂量相关。Peng等[6]基于466例儿童患者的血药浓度数据建立的一级吸收和消除的一室模型中,将每日公斤体重给药剂量(DDPW)纳入最终模型,该研究报道MHD体内清除率随DDPW的增加呈非线性增大,DDPW更能准确预测儿童患者服药后MHD的血药浓度。刘彬等[7]纳入1 016例癫痫儿童患者的血药浓度数据进行PPK研究,结果显示DDPW影响儿童患者体内分布容积的估算。在临床应用中,儿童癫痫患者多根据体重计算给药剂量,将每日公斤体重给药剂量纳入OXC儿童群体药动学参数的估算,有助于临床治疗方案的制定与调整。
3 讨论
奥卡西平临床主要应用于成人和儿童的部分发作性癫痫,也有应用于双相障碍及其他精神类疾病的相关报道[20]。目前国内外已有多项OXC药动学的相关研究,但由于不同实验组所建立的PPK模型中药动学参数的影响因素各异,缺乏对各个模型影响因素的分析。本文综述了基于非线性混合效应模型的PPK研究,分析各研究特点,探讨OXC群体药动学参数的影响因素,以期为后续OXC的PPK研究和个体化治疗提供参考。
临床应用OXC单药治疗无效时,常会考虑合并使用其他抗癫痫药物以提高临床疗效。研究表明,OXC和MHD为CYP3A4和CYP3A5的底物,合用酶诱导抗癫痫药如卡马西平、苯妥英钠和苯巴比妥等可加快OXC的体内代谢,导致MHD血药浓度下降约20%~40%;而合用酶抑制抗癫痫药如丙戊酸等可导致MHD血药浓度升高约20%~30%[21-22]。在已发表的PPK研究中,仅4项研究[3,5,7-8]将合并用药纳入最终模型,各研究报道结果存在差异。为获得更加准确的药动学参数,在后续研究中有必要进一步考察合并用药对OXC体内药动学的影响,同时应加强模型外部验证,建立稳定性好、普适性强的药动学模型。
近年来,遗传因素对药物动力学参数及药物效应的影响备受关注。UGT1A9、UGT2B7和ABC分别为MHD患者体内代谢过程中最主要的代谢酶和转运体。UGT1A9、UGT2B7和ABCC2基因多态性及表达水平可影响OXC和MHD的体内药动学参数,基于患者基因携带和其表达水平不同,药物治疗方案也需进行相应调整[19,23-24]。而在已发表的儿童PPK研究中,仅一项研究将遗传因素纳入最终模型用于药动学参数的估算。当前考察遗传因素对儿童OXC药动学参数影响的PPK研究较少,会限制已发表药动学模型在给药方案优化中的应用,故有必要重点考察药物代谢酶UGT1A9和UGT2B7、转运体ABC等的基因多态性对OXC和MHD体内药动学参数的影响。
综上,各研究报道的OXC和MHD药动学参数存在差异,在儿童癫痫患者中存在个体间变异。在未来的OXC群体药动学研究中,可纳入更多的病例数,进一步考察肝肾功指标、合用其他类AEDs和基因多态性等对OXC药动学参数的影响,探索建立稳定适用的药动学模型,并将其更好地应用于临床个体化治疗中。
