IDO小分子抑制剂的研究进展
2020-06-08毛耀南任敬慧
毛耀南,于 萍,任敬慧,蔡 进*
0 引言
吲哚胺2,3-双加氧酶(Indoleamine 2,3-dioxygenase,IDO)是肿瘤免疫治疗的关键靶点之一。近年来,IDO小分子抑制剂引起了研究者的广泛关注。本文主要针对IDO抑制剂的作用机制和进展进行阐述,总结其研究现状。
1 IDO简介
吲哚胺2,3-双加氧酶1 (Indoleamine 2,3-dioxygenase,IDO1)是一种含有血红素的酶,在人体的大多器官和细胞中均有表达,在胎盘、肺的内皮细胞以及女性生殖道上皮细胞中较多[1]。IDO1有2个同工酶,分别是色氨酸双加氧酶(Tryptophan 2,3-dioxygenase,TDO)和吲哚胺2,3-双加氧酶2 (Indoleamine 2,3-dioxygenase2,IDO2),TDO在肿瘤免疫逃逸中发挥一定作用,而IDO2在免疫耐受中的机制还有待探究[2](除特殊说明,本文的IDO均指IDO1)。IDO催化色氨酸(Tryptophan,trp)降解为犬尿氨酸(Knurenine,kyn)途径的第一步以及限速步[3],在分解色氨酸的代谢途径中起到重要作用。其中犬尿氨酸可直接抑制效应T细胞的功能并促进调节性T细胞(tregs)分化;而通过消耗色氨酸,IDO阻断T淋巴细胞的增殖[4],通过多种途径发挥免疫抑制的作用,保护癌细胞免受免疫系统的识别和攻击,其作用机制见图1。肿瘤细胞的免疫逃逸是肿瘤生存的一个重要机制。有报道,IDO表达水平的增加与几种癌症类型的生存预后不良相关[5],表明IDO通路阻断是一种抗肿瘤的重要策略,因此,IDO是肿瘤免疫治疗的关键靶点之一。
IDO结构分2个区域。大区域中的4条长螺旋平行于血红素平面,并通过疏水作用与相邻的螺旋相互作用,其中某一长螺旋为血红素铁提供内源性配体。血红素的近端仅被来自大区域的侧链占据;血红素远端口袋由大小2个区域及连接2个区域的环路组成[6]。由于分子氧在该位点结合,因此,远端血红素袋的结构特征应该与IDO催化的双加氧酶反应有关。
2 IDO小分子抑制剂作用机制
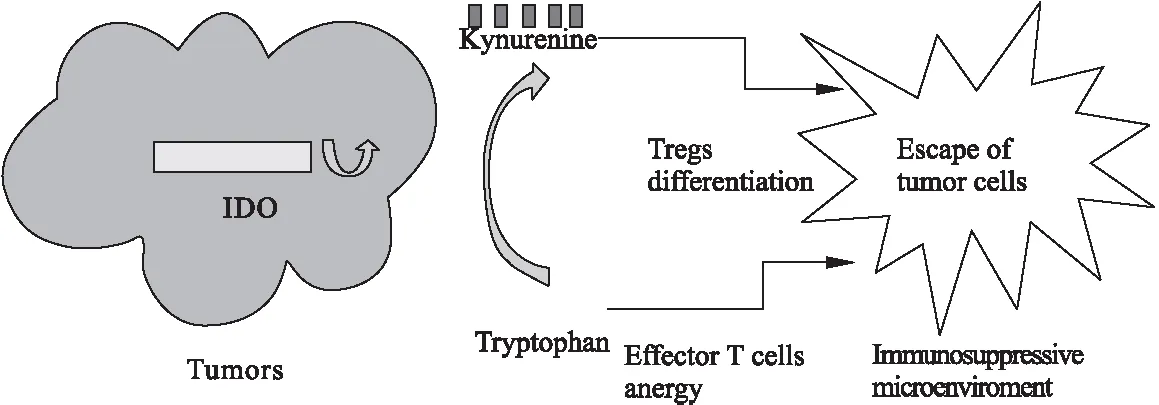
图1 IDO发挥免疫抑制的机制
目前,研究已经鉴定了部分IDO抑制剂的结构,但是可提供与IDO结合机制有关见解的比较有限。下面对几种目前研究较多的IDO抑制剂的作用机制进行论述。
2.1 充当色氨酸模拟物 上个世纪研究者已开始对IDO抑制剂作为色氨酸模拟物机制的研究[7]。Cady等[8]在研究中发现,3种色氨酸类似物抑制剂能够有效抑制IDO。与色氨酸类似,这些抑制剂可与IDO的催化位点结合。Metz等[9]提出,IDO抑制剂在调节mTOR(哺乳动物雷帕霉素靶蛋白)中作为有效的色氨酸模拟物。IDO分别通过GCN2(一种反应激酶)和mTOR影响必需氨基酸缺乏,控制炎症反应和免疫耐受,而Indoximod(代表性IDO抑制剂)可能通过控制许可mTOR所需的色氨酸信号,从而减轻免疫抑制,在体外细胞实验中,明显减轻了IDO介导的抑制T细胞增殖,并具有很好的体内抗肿瘤效应。最近开发的具有微摩尔抑制IDO活性的色氨酸衍生物有四氢-β-咔啉类衍生物[10]、色胺衍生物[11]等。但其没有色氨酸类似物达到亚微摩尔活性,可能是因为色氨酸本身对IDO1仅有中等亲和力,因此,开发IDO1抑制剂更好的方法是模拟转变酶反应的状态,即需要考虑铁结合的分子氧[4]。
2.2 与IDO中血红素铁相互作用 Kumar等[12]通过IDO活性部位区域,探索基于结构的药物设计,并探讨了苯基咪唑型化合物;随后Kumar 进入NewLink 公司并开发了咪唑异吲哚系列IDO抑制剂。Sugimoto等[6]发现了一种有效的IDO抑制剂,其结构中的4-苯基咪唑与血红素口袋A(血红素的主要结合位点)结合,苯环插入亲脂性空腔中,并且咪唑环的1个氮原子与血红素铁相互作用,并且结合位点可以延伸至邻近的疏水口袋B。此外,Peng等[13]研究了IDO抑制剂类似物结构,结构信息表明,苯基咪唑和咪唑并吲哚类的环平面在活性位点上的取向稍有不同,但抑制剂中咪唑氮与血红素铁原子配位并与周围残基发生疏水相互作用,并且通过几种类似化合物的对比,发现具有较好IDO抑制作用的化合物与血红素也形成强分子间氢键。若没有与血红素基团的氢键相互作用,就没有IDO1的抑制作用,表明IDO抑制剂在发挥作用时与IDO建立氢键的重要性。
2.3 氧化还原作用 Röhrig等[4]研究显示,具有醌或亚氨基醌官能团的化合物在酶促IDO抑制测定中显示出高活性。醌类化合物可通过还原辅因子进行氧化还原循环,或通过对亲核氨基酸侧链的化学反应来抑制IDO,如甲萘醌抑制IDO的机制源于其氧化还原活性。但是氧化还原循环化合物不仅会影响色氨酸降解的犬尿氨酸途径,还会干扰许多其他细胞途径,因此,应该避免使用醌类化合物来抑制IDO。
2.4 其他作用机制 根据结合部位的不同,IDO抑制剂可分为竞争性抑制剂和非竞争性抑制剂。Liu等[14]研究显示,Epacadostat不影响IDO蛋白质水平,表明此抑制剂抑制了IDO酶活性而未抑制其在细胞中的表达。通过人类异同种异基因淋巴细胞与树突细胞或肿瘤细胞的共培养,结果显示,Epacadostat促进效应T细胞和机体重要免疫细胞——自然杀伤细胞的生长,且减少tregs分化。另外,在人类树突细胞中,高浓度的Epacadostat可完全抑制色氨酸到犬尿氨酸的降解。
此外,研究表明,IDO非竞争性抑制剂具有微摩尔范围的抑制效力[15]。非竞争性抑制剂是与双加氧酶活性必要的分子氧竞争,从而发挥抑制IDO的作用。最近,也有关于此类IDO抑制剂化合物的探究。
2.5 IDO小分子抑制剂的研究现状 目前,研究者发现并合成了大量具有IDO抑制作用的小分子化合物,但是国内外还没有IDO抑制剂上市,研究较快的为Incyte公司的Epacadostat、BMS公司的BMS-986205,在美国均处于临床Ⅲ期[16]。表1为处于临床阶段的代表性抑制剂,其中已知的结构式如图2。
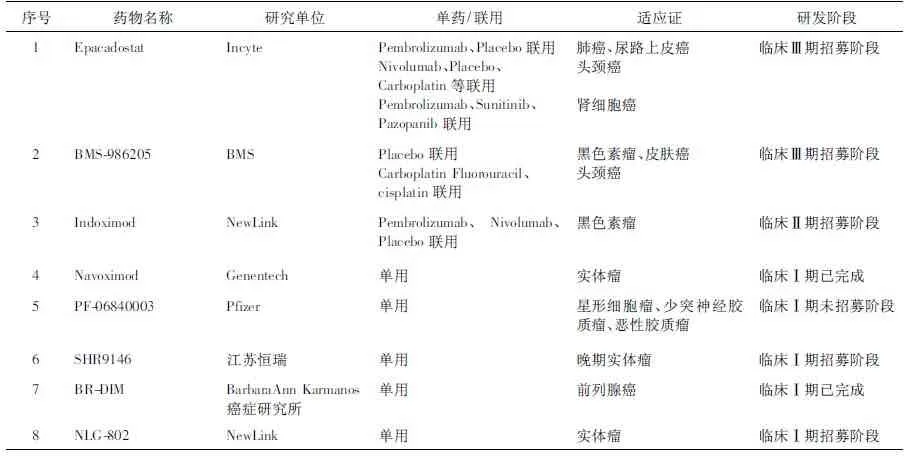
表1 临床阶段IDO抑制剂
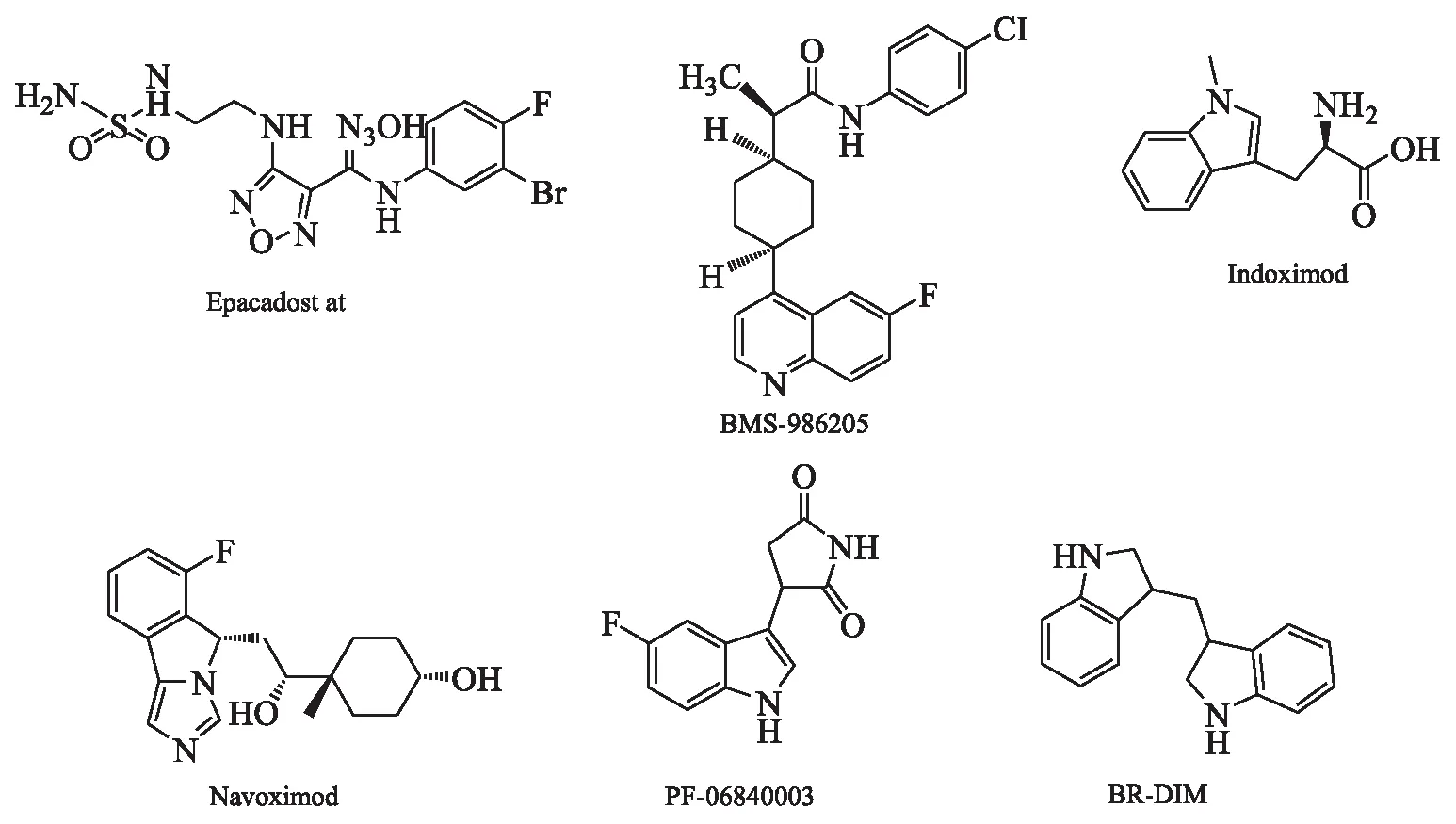
图2 临床IDO抑制剂结构
IDO抑制剂的作用机制及构效关系表明,理想的IDO抑制剂应包含以下特征:①1双环片段填充口袋A;②带有电子对的原子(如S、O、N)与血红素铁结合;③大配体中的基团能够与口袋B形成起范德华作用力;④与IDO上特定结构建立起氢键的片段[12]。目前,选择性好、活性高且比较受关注的IDO抑制剂见表1。
3 IDO抑制剂
3.1 吲哚类 吲哚类IDO抑制剂一般作为色氨酸的类似物,也是IDO 抑制剂中最先开发的一类化合物。目前开发中的吲哚类化合物大多以色氨酸为主体进行结构修饰,修饰范围几乎覆盖了所有可修饰的基团[17]。其中有代表性的化合物见图3。1-methyl-tryptophan(1-MT)即indoximod(图3A)是较早报道的一种IDO抑制剂,目前处于NewLink公司研究的临床Ⅱ期阶段。研究显示,indoximod具有良好的药代动力学特征及口服利用度、低清除率、低蛋白结合率的特点,可与多种化疗药物如环磷酰胺、顺铂、阿霉素或紫杉醇显示协同作用[18]。Hatem等[19]在对晚期癌症患者的indoximod剂量递增研究中,给患者施以2次/d大于1 200 mg剂量,结果显示,其具有良好的耐受性。
Tanaka等[10]等合成了一系列色氨酸类似物,并评估其对IDO抑制的活性,发现了几个有效的化合物(图3D),其IC50均为40~70 μmol/L。为探索新型IDO抑制剂,Gaspari等[20]通过筛选带有吲哚基团的分子,最终发现一种中等活性的竞争抑制剂天然产物brassinin(图3E)。其将brassinin分为4个部分,并分别合成4个组分的类似物,通过构效关系评价brassinin的4个部分,发现吲哚环并不是IDO抑制剂所必需的;同时,在S-甲基用较大芳香基取代得到活性较好的抑制剂,其体外效力比1-MT强3倍,但其疏水性太高。其结构式见图3F。
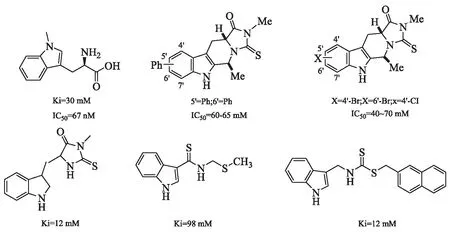
图3 吲哚类IDO抑制剂结构
3.2 芳基咪唑类 芳基咪唑类的典型代表即Genentech公司的Navoximod(图2D),目前,临床Ⅰ期研究已完成。在咪唑系列抑制剂中,navoximod具有口服生物利用度和优越的药代动力学特性。在临床前模型中,其极大地增强了针对B16黑素瘤的免疫应答,在接种后4 d内肿瘤的大小减少了约95%[21]。作为单一疗法,其在21/28 d周期内以2次/d高达600 mg给药,耐受性良好,17例患者中,有7例患者病情稳定。
芳基咪唑系列抑制剂起源于1989年确定的4-苯基咪唑(4-PI)(图4A),作为IDO1酶活性的弱非竞争性抑制剂,后经晶体学分析证实4-PI与IDO活性位点的血红素铁作用[6],引起了研究者对于芳基咪唑类IDO抑制剂及其作用机制的关注。Kumar等[12]探讨了4-PI及其一系列衍生物,发现3种比4-PI高效的化合物,其结构见图4B。对于苯环上的羟基或巯基取代,确定对设计的芳基咪唑类似物的亲和力增加来自特定的蛋白质-配体相互作用,而不是配体电子效应。这也是首个基于IDO晶体结构开发酶抑制剂的报道。
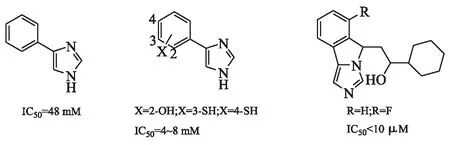
图4 芳基咪唑类IDO抑制剂结构
近期研究显示,一系列稠合的苯基咪唑衍生物(图4C)作为IDO抑制剂,在5H-咪唑并异吲哚核心上,具有环己基-乙醇官能团并显示较好活性(IC50低于10 μmol/L)[22]。
3.3 羟基脒类 目前,羟基脒类IDO抑制剂研究最快的为epacadostat,处于临床Ⅲ期阶段,其结构见图2A。作为临床先导药物,在临床Ι期的药代动力学、药效学和抗肿瘤活性研究中发现其具有良好的耐受性,可使血浆中犬尿氨酸水平正常化[23]。近期Ⅱ期临床研究表明,在骨髓增生异常综合征患者中,epacadostat能够稳定患者(12/15)病情达12个月。
此临床药物的开发源于2009年,Incyte公司将羟基脒化学构型作为IDO抑制剂中的关键药效团设计了一系列此类化合物[24]。图5A、图5B显示了其他活性较高的几种化合物。最近Incyte公司根据构效关系,在图5A基础上设计了一系列新的化学型IDO抑制剂,化合物结构包含了羟基脒和以前未充分认识的呋咱等,活性较好的化合物见图5C、图5D。已证明图5D的化合物在啮齿动物黑色素瘤模型中有效,且在临床前毒理学研究中具有良好的耐受性[16]。
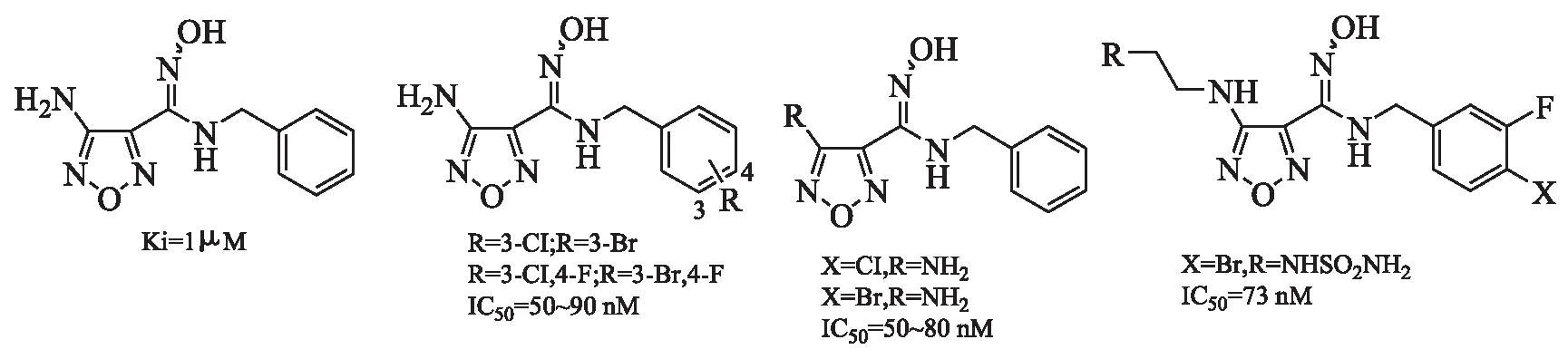
图5 羟基脒类IDO抑制剂结构
3.4 醌类 2008年,受天然产物annulin B(图6A)的启发,Kumar等[25]将萘醌作为关键药效团,通过小鼠肿瘤模型证明萘醌天然产物中甲萘醌具有通过IDO抑制介导的抗肿瘤活性,并合成和表征了系列基于萘醌的IDO抑制剂,其中活性较好的见图6B、图6C。2013年,Eduard等[26]研究一种海洋生物碱tsitsikammamine衍生物对IDO1的抑制活性,效果较好的系列化合物见图6D、图6E,化合物图6E已显示亚微摩尔效能。
虽然有不少关于醌类化合物的研究,但这系列抑制剂中没有进入临床试验,因为醌的抑制效力在体内具有总体衰减倾向,且在基于细胞的测试中这些化合物的毒性太高。
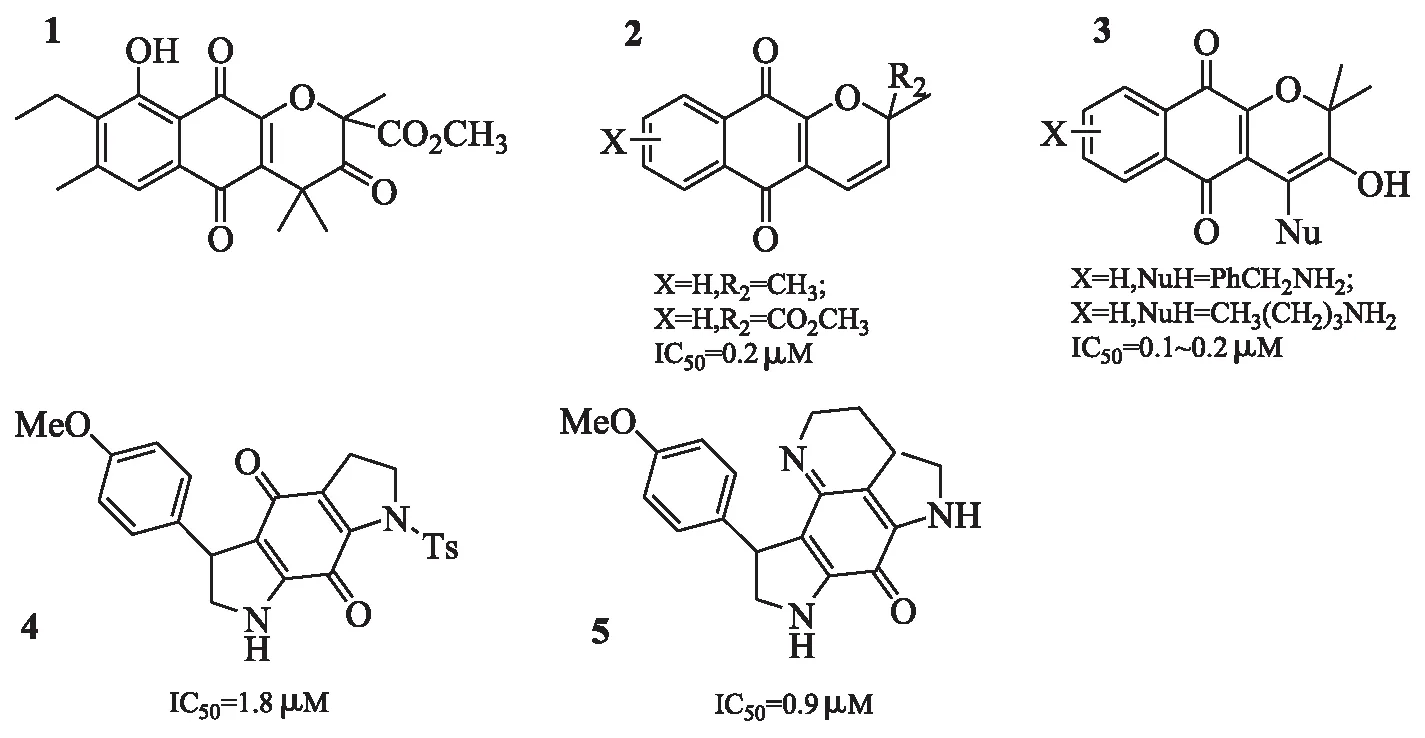
图6 醌类IDO抑制剂结构
3.5 其他类 Lin等[27]开发了一系列基于磺酰肼核心结构的IDO抑制剂,并公开了一种强有效IDO抑制剂(图7A)的研究进展,在小鼠模型中2次/d经口给药100 mg/kg,肿瘤重量减少30%。药效学试验发现,其使血浆和肿瘤中kyn/trp分别降低25%和21%。Matsuno等[28]发现,S-苄基异硫脲(图7B)具有抑制IDO的效力,随后对其结构进行优化,发现了抑制作用的2种化合物(图7C),两者均抑制A431细胞中犬尿氨酸的产生。基于红花叶子提取物除治疗冠状动脉疾病、血栓等疾病外,还用于癌症的治疗,其化合物对于IDO降解色氨酸有一定的影响,Kuehnl等[29]提取并分离出3种化合物(图7D),对IDO有一定的抑制活性。
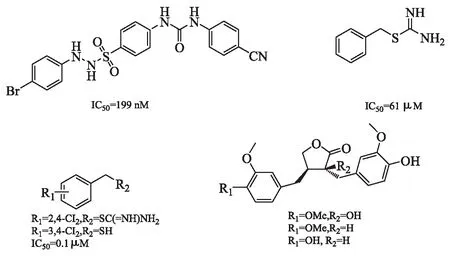
图7 其他类IDO抑制剂结构
4 结语
自从IDO被鉴定为癌症治疗的有效靶点以来,许多团队和研究人员致力于发现新的IDO抑制剂。近年来,通过基于结构的设计、高通量筛选以及天然产物筛选等方法,研究者发现了几种新的IDO抑制剂骨架。在这些结构中,羟基脒和奎宁类似物对IDO具有抑制活性[23],值得进一步修饰,以在临床试验中获得更有效的抑制剂,并有助于探究IDO抑制剂的更多结构。除了IDO单药治疗的安全性外,临床前数据显示,IDO抑制剂有助于克服化疗耐药性[30],且IDO在肿瘤细胞中普遍表达促使人们研究IDO抑制剂与其他化疗药物的组合治疗。此外,也可考虑靶向IDO及其同工酶的组合,开发新的治疗方案。但是2019年4月,Incyte公司和BMS公司停掉的一部分临床研究说明IDO抑制剂研究领域仍然存在很大的挑战性。此外,IDO抑制剂的药效团有限且明确的作用机制不多。随着对IDO抑制剂结构、作用机制及临床适应证研究的增加,IDO抑制剂在免疫疗法和抗肿瘤方面可能发挥越来越重要的作用。
