丁苯酞软胶囊对颈动脉狭窄大鼠大脑缺血再灌注后Smac蛋白的影响
2020-06-08陈海云何超明庞明武李华坚高唯一
黄 优,陈海云,何超明,庞明武,颜 博,王 景,李华坚,高唯一
0 引言
脑梗死是最常见的缺血性脑血管疾病,颈动脉狭窄是缺血性脑血管病的重要危险因素,流行病学统计显示,颈动脉狭窄是进行性脑梗死的重要危险因素[1],其同侧脑梗死的发病率可以达到90%以上。丁苯酞(Butyphthalide)是从芹菜籽中提取的天然产物,可以发挥神经保护功能[2],次级线粒体源性Caspase激活因子(Smac,又称低等电点的IAP直接结合蛋白)是决定脑缺血后脑细胞凋亡的关键蛋白[3]。本研究构建颈动脉狭窄大鼠模型,在此基础上探讨丁苯酞对模型大鼠脑组织缺血再灌注后Smac蛋白的影响以及神经保护作用,为丁苯酞的临床应用提供更多的理论依据。
1 材料与方法
1.1 实验动物、试剂和仪器 SPF级健康雄性SD 大鼠,8周龄,体重260~310 g,购自海南医学院动物实验中心,动物许可证号:SCXK(琼)2018-0004。丁苯酞胶囊购自石药集团恩必普药业有限公司(批号:20180216),Smac和β-actin多克隆抗体购自美国Santa公司,HRP标记二抗购自北京中杉生物科技股份有限公司,Bradford蛋白定量试剂盒和TUNEL细胞凋亡检测试剂盒购自北京碧云天生物技术有限公司,显微镜和HPIAS-1000图像分析系统为德国Leica公司产品,电泳仪为美国Bio-Rad公司产品。
1.2 大鼠动物模型的建立 SD大鼠适应性喂养1周后建模,随机分为假手术组(15只)和颈动脉狭窄模型组(60只),参照郑文婧等[4]的方法,造模简述如下:10%水合氯醛1 ml腹腔注射,大鼠麻醉后沿颈部正中切开,分离右颈总动脉后平行放置5 ml注射器针头,6-0号尼龙线扎紧针头和颈总动脉,抽出针头,见血流恢复后间断缝合肌肉和皮肤,假手术组只分离右颈总动脉,不做尼龙线结扎,术后注射青霉素钠防止感染。喂养6周后,血管超声显示,手术侧右颈总动脉峰值血流速度155~170 cm/s、舒张末血流速度60~100 cm/s为颈动脉狭窄造模成功。随后参照Han等[5]的方法,使用颈动脉狭窄模型大鼠构建大脑中动脉缺血(MCAO)模型。颈动脉狭窄模型大鼠随机分为对照组、低剂量丁苯酞(20 mg/kg)组、中剂量丁苯酞(40 mg/kg)组和高剂量丁苯酞(80 mg/kg)组,每组15只。丁苯酞组在建模前3 d,每天给予20、40、80 mg/kg丁苯酞灌胃,对照组和丁苯酞组水合氯醛麻醉后,分离狭窄侧右颈总动脉,插入尖端涂有硅橡胶的尼龙单丝缝合线,进入约2 cm达大脑中动脉处,阻塞1.5 h后取出缝线恢复血供,缝合皮肤,术后注射青霉素钠防止感染。假手术组仅分离血管,不插入尼龙线。
1.3 神经功能评分[5]MCAO造模后24 h使用平衡木实验(Beam balance test,BBT)进行神经功能评分,把小鼠置于1.5 cm的平板上,站稳无摇晃持续2 min记1分,站稳有摇晃但可以持续2 min记2分,滑至一侧但2 min内未掉下记3分,2 min内掉下记4分,数秒内掉下记5分,无法站立记6分。
1.4 HE、TUNEL染色 各组SD大鼠造模24 h后,麻醉断头取缺血脑组织固定于4%甲醛,24 h后包埋于石蜡中,切成5 μm冠状切片。常规HE染色显微镜下观察神经元细胞变化,TUNEL染色严格按照试剂盒说明书操作,TUNEL染色阳性细胞为神经元胞体萎缩,深褐染细胞,是凋亡细胞。显微镜下随机选择5个缺血半暗带区的高倍视野(200×),计算每个样品的凋亡指数(Apoptotic index,AI)=阳性凋亡细胞数/总细胞数。
1.5 Smac蛋白的Western blot检测 各组SD大鼠造模24 h后,麻醉断头取缺血脑组织100 mg加入蛋白裂解液,提取细胞总蛋白,Bradford法蛋白定量后,取50 μg总蛋白进行SDS-PAGE凝胶电泳,转印蛋白至PVDF膜,然后加入Smac (1∶1 000)或β-actin一抗(1∶5 000),4 ℃过夜后加入二抗(1∶5 000) 2 h,化学发光法扫描条带,用Bandscan5.0软件计算Smac的相对灰度值。
1.6 统计学分析 采用SPSS 17.0统计软件。对于符合正态分布的计量资料,多组均数间比较采用方差分析,组间两两比较采用 LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 丁苯酞对模型SD大鼠神经功能的影响 假手术组、对照组、低剂量丁苯酞组、中剂量丁苯酞组和高剂量丁苯酞组SD大鼠BBT评分分别为1.07±0.12、5.64±1.06、4.84±0.82、4.13±0.65、3.76±0.52,各组间差异有统计学意义(F=8.71,P<0.05)。
2.2 丁苯酞对模型SD大鼠缺血区神经元细胞形态以及凋亡的影响 HE染色显示,正常神经元细胞染色清晰,胞浆丰富,核居中,核仁清晰,排列整齐,见图1细黑箭头所指;缺血再灌注模型组见神经元丢失,退行性变,神经元细胞收缩、核固缩、细胞间隙增大,见图1粗黑箭头所指。给予丁苯酞干预后,这种损伤神经元显著减少。经TUNEL染色后显示,假手术组、对照组、低剂量丁苯酞组、中剂量丁苯酞组和高剂量丁苯酞组SD凋亡指数分别为0.00±0.00、0.75±0.18、0.62±0.14、0.47±0.10、0.32±0.07,各组间差异有统计学意义(F=9.684,P<0.05)。凋亡细胞见图2中黑箭头所指。
2.3 丁苯酞对模型SD大鼠缺血区Smac蛋白表达的影响 从图3可见,缺血再灌注模型大鼠Smac蛋白表达升高,给予丁苯酞干预后,缺血再灌注导致的Smac蛋白升高得到了抑制。经灰度扫描,假手术组、对照组、低剂量丁苯酞组、中剂量丁苯酞组和高剂量丁苯酞组Smac蛋白的相对灰度值分别为0.076±0.012、0.852±0.143、0.705±0.127、0.382±0.073、0.115±0.024,各组间差异有统计学意义(F=12.71,P<0.05)。
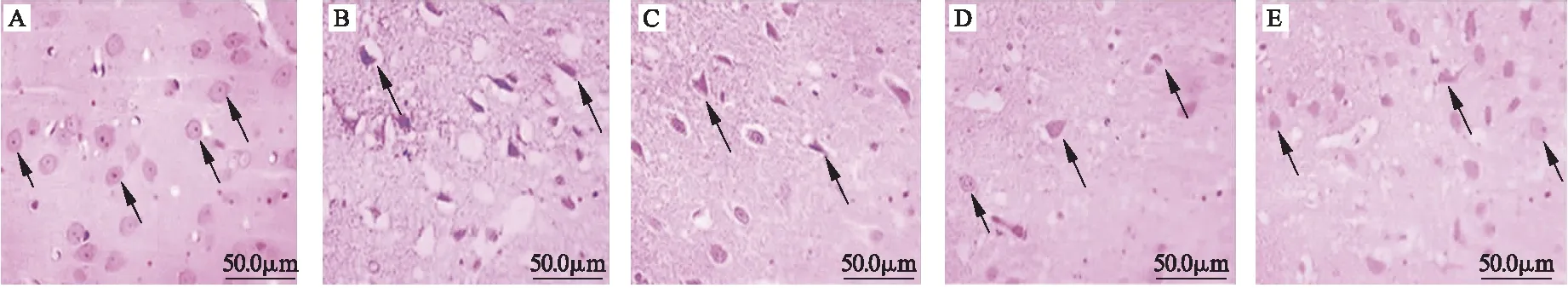
图1 缺血区脑组织的HE染色(200×)

图2 缺血区脑组织的TUNEL染色(200×)

图3 Smac蛋白表达的Western blot检测
注:A.假手术组,B.对照组,C.低剂量丁苯酞组,D.中剂量丁苯酞组,E.高剂量丁苯酞组.
3 讨论
流行病学调查显示,60%左右的脑梗死患者存在颈动脉狭窄,快速恢复血供是脑梗死患者临床治疗的关键[6],但恢复血供再灌注后,有时脑组织的损伤更加严重,缺血再灌注损伤成为影响脑梗死患者临床疗效的重要因素[7]。丁苯酞是我国自主研发的药物,动物实验和临床治疗研究均显示了其可以发挥神经保护功能[8-9],而且对颅内动脉狭窄患者也可以发挥治疗作用[10]。本研究结果显示,模型组神经功能受损,镜下神经元退行性变,说明造模成功,提前给予丁苯酞干预后神经功能评分显著减低,呈剂量依赖性,镜下退行性变的神经元减少。袁齐宏等[11]采用大鼠脑中动脉栓塞模型,发现丁苯酞可以对脑缺血再灌注大鼠神经功能起到保护作用,但未对其机制进行深入探讨。
凋亡通路是神经元细胞死亡的一条主要通路,Smac蛋白含有184个氨基酸,是凋亡通路中的重要蛋白,Smac蛋白表达升高后可以竞争性结合XIAP、Apaf-1凋亡复合体,解除凋亡复合体对Caspase-9和Caspase-3的抑制,促进细胞凋亡的发生[12]。在缺血再灌注脑组织中已经发现了致凋亡蛋白Smac的表达显著增高。李国前等[13]研究显示,抑制Smac信号通路可以显著减少脑缺血再灌注模型大鼠的神经细胞凋亡,发挥神经保护作用。本研究结果显示,缺血再灌注模型组大鼠脑组织Smac蛋白显著升高,丁苯酞可以剂量依赖性地缓解缺血再灌注模型组大鼠脑组织Smac蛋白的升高。本研究也发现了缺血再灌注模型组大鼠脑组织神经元细胞凋亡显著增加,而丁苯酞可以剂量依赖性地减低缺血再灌注模型组大鼠神经元的凋亡,提示丁苯酞下调Smac蛋白表达,可能是其发挥神经保护作用的主要机制。
综上所述,本研究显示,丁苯酞可以显著减低Smac蛋白表达,抑制颈动脉狭窄大鼠缺血再灌注损伤诱发的神经元凋亡,发挥神经功能保护作用。
