基于肿瘤微环境的CAR-T细胞疗法研究现状①
2020-06-05武少贤蒋敬庭苏州大学附属第三医院肿瘤生物诊疗中心江苏省肿瘤免疫治疗工程技术研究中心苏州大学细胞治疗研究院常州213003
武少贤 蒋敬庭 (苏州大学附属第三医院肿瘤生物诊疗中心,江苏省肿瘤免疫治疗工程技术研究中心,苏州大学细胞治疗研究院,常州 213003)
嵌合型抗原受体T细胞(chimeric antigen receptor T cells,CAR-T)是经过基因工程改造的T细胞,可以激活对肿瘤特异性抗原的免疫应答。肿瘤通过破坏TCR活性来逃避肿瘤杀伤,但CAR采用了一种靶向方法,从而“避免了逃避机制”,使肿瘤再次易受T细胞介导的攻击。CAR-T细胞疗法在血液系统肿瘤治疗方面已显示出显著效果。特别是在急性淋巴细胞白血病(ALL)中有较高的抗肿瘤效应[1]。然而,CAR-T细胞疗法在实体肿瘤中疗效欠佳。在肿瘤进展过程中,肿瘤细胞会改变正常的发育过程,形成抑制性的肿瘤微环境(tumor microenvironment,TME),其中包括免疫细胞、成纤维细胞和内皮细胞以及多种抑制分子[2]。从最早的浸润前病变形成到转移扩散,TME可以支持血管生成、肿瘤进展和免疫逃逸,并决定对肿瘤治疗的反应。尽管实体肿瘤中的肿瘤反应性T淋巴细胞面临各种各样的困难,但越来越多的证据表明,对癌症患者的自体免疫系统进行诱导和工程改造可以显著改变临床疗效,特别是在黑色素瘤、胰腺癌等恶性肿瘤中[3]。对TME复杂成分与免疫功能之间关系的研究将为CAR-T细胞疗法攻克实体肿瘤提供新的依据。
1 CAR-T细胞的结构及优化设计
CAR由胞外、跨膜和胞内结构域组成。胞外结构域由衍生自抗体轻链和重链区的单链可变片段(scFv)组成,不需MHC分子参与即可与特定的肿瘤相关抗原(TAA)结合。跨膜间隔子也称为铰链结构域,由CD8和IgG4分子组成,起到连接胞内和胞外的作用。细胞内结构域也称为激活或信号结构域,由CD3ζ组成。基于细胞内信号传导域,CAR受体具有4代。CD3ζ在第一代中只是细胞内结构域,产生的治疗反应有限[4]。为增强T细胞的活化、增殖和持久性,添加了其他共刺激分子,如CD27、CD28、4-1BB或OX-40。第二代由一个共刺激分子组成,第三代由两个共刺激分子组成。除了CD3ζ和共刺激分子外,第四代还增加了抗肿瘤细胞因子基因(IL-12、IL-15),从而增强了CAR-T细胞的抗肿瘤作用[5,6]。
目前,CAR-T的临床研究主要集中在以CD19为靶点的血液系统肿瘤中,包括非霍奇金淋巴瘤以及急性B淋巴细胞白血病(B-cell acute lymphocytic leukemia,B-ALL)、慢性淋巴细胞白血病(chronic lymphocytic leukemia,CLL)[7]。CD19靶抗原仅在B细胞上表达,因此为CAR-T细胞治疗提供了良好的靶点。然而,实体瘤缺乏合适的肿瘤相关抗原且具有异质性,即常用的靶标通常在肿瘤细胞上过表达,但在非恶性组织上也低表达,这意味着正常组织也可能受到攻击。目前,已经开发三类双特异性CAR来解决此类问题,即双重CAR[8]、串联CAR(Tan CAR)[9]和抑制性CAR(iCAR)[10],当肿瘤细胞表面同时存在两种靶抗原时,该类型CAR-T细胞才能被激活,显著增强特异性,从而使旁观者细胞不受影响。如Feng等[11]在晚期胆管癌患者中连续输注抗EGFR和抗CD133 CAR-T细胞,导致抗肿瘤功效增强。此外,Roybal等[12]利用syn Notch(synthetic Notch)对双重CAR进行了升级,该类型CAR与第一种抗原结合,然后通过合成的Notch受体响应于指定抗原的识别而诱导转录激活,可以调节CAR-T细胞的活性。最近,Cho等[13]开发了一种分离、通用、可编程式(split,universal and programmable,SUPRA)CAR,将T细胞与抗体分离,增强了T细胞转换追踪目标的能力,该种CAR必须同时识别肿瘤细胞上的两个靶点才能激活,降低了CAR-T带来的毒副作用。
2 肿瘤微环境对CAR-T治疗的影响
2.1血管障碍 从最早的浸润前病变形成到转移扩散,TME可以支持血管生成,血管生成是肿瘤生长和转移的重要标志[14]。脉管系统与正常血管相比具有异常的结构和功能特性,异常脉管系统的形成导致支持肿瘤生长的低氧和酸性环境的产生。血管生成需要癌症相关的成纤维细胞(CAF)和多种生长因子的调控,如血管内皮生长因子(VEGF)、转化生长因子(TGF)、血小板衍生生长因子(PDGF)等。VEGF在内皮细胞中表达,低氧和酸性环境有助于血管生成,被认为是恶性肿瘤的主要血管生成因子[15]。这些血管屏障导致CAR-T细胞很难进入肿瘤内部。
2.2基质障碍 TME的基质屏障由结缔组织形成,对免疫系统重塑以及肿瘤的生物学行为具有重要影响。胞外基质(ECM)包含多种成分,包括胶原蛋白、蛋白聚糖、纤连蛋白、层黏连蛋白等。在实体瘤中,胶原蛋白和纤连蛋白提供细胞结构支撑,而蛋白聚糖则有助于生长因子和细胞因子结合特性[16]。然而有研究报道ECM中的非结构性基质蛋白,如硫酸乙酰肝素蛋白聚糖(HSPG),能够促进肿瘤细胞的增殖与迁移[17]。因此需要增加CAR-T细胞降解富含基质的ECM的能力。
2.3免疫抑制细胞及其分泌的细胞因子 调节性T细胞(Tregs)通过其抑制功能来防止由于过度或不必要的免疫激活而导致的自身免疫和组织损伤,在维持自我耐受和免疫稳态中具有重要作用[18]。然而,在肿瘤微环境中,Treg细胞通过其高亲和力IL-2受体从周围摄取IL-2,使其无法用于反应性T细胞。它们还组成性表达细胞毒性T淋巴细胞相关抗原4(CTLA-4),下调抗原呈递细胞(APC)的CD80/CD86表达,从而抑制反应性T细胞的活化。Treg细胞还产生免疫抑制性细胞因子,例如IL-10,也可下调APC功能。这种IL-2/IL-2受体依赖性和CTLA-4依赖性机制是Treg介导的包括肿瘤在内的各种组织抑制作用的核心基础[19]。
骨髓来源的抑制性细胞(myeloid-derived suppressor cells,MDSCs)起源于骨髓生成过程中骨髓(也包括小鼠脾脏)的普通髓样祖细胞(CMP)。MDSC有两种亚型:单核(M-MDSC)和多形核或粒细胞MDSC(PMN-MDSC)。MDSC由骨髓经血液循环,流向炎症部位和实体瘤。在TME的炎性环境中,多种因素促进MDSC抑制活性[20]。在外周淋巴器官中,PMN-MDSC会保留大量的各种活性氧(ROS),并会导致抗原特异性T细胞抑制/耐受。M-MDSC产生大量不同的因子,可使自身细胞抑制抗原特异性和非特异性T细胞应答,M-MDSC维持STAT3的高活性,阻止了他们向树突状细胞(DC)或巨噬细胞的快速分化。
在TME中由于缺氧的影响,MDSC中的STAT3活性大大降低。这导致M-MDSC快速分化为肿瘤相关巨噬细胞(tumor associated macrophages,TAM)。PMN-MDSC中的ROS水平显著降低,但精氨酸酶1(ARG1)的上调和其他引起非特异性T细胞抑制的因素增加。M-MDSC也会发生同样的情况。同时垂死的MDSC细胞释放的因子可以促进免疫抑制机制[21]。自然杀伤(NK)细胞是从骨髓中常见的淋巴祖细胞发育而来的固有淋巴细胞,是抵抗外来病原体感染和清除恶变细胞的第一道防线。然而Bruno等[22]指出NK细胞在子宫脉管系统中具有重要的促血管生成作用,NK细胞介导的肿瘤免疫监视所需的Stat5基因失活会上调NK细胞中的VEGFA并增强小鼠淋巴瘤模型中的血管生成[23]。
巨噬细胞被募集到与TME的基质中,朝着与癌症进展有关的M2巨噬细胞极化。TAM通过产生生长因子(如EGF、VEGF)来维持肿瘤的生长,通过释放蛋白酶(例如组织蛋白酶、MMP-2、MMP-9)和可溶性介质(例如TGF-β、IL-37)来促进胞外基质的重塑。通过释放MMP-9或其他可溶性因子(例如VEGF、PDGF、胸苷磷酸化酶、CXCL8)促进血管生成和淋巴管生成,并通过释放可溶性介质(如IL-10、IDO、TGF-β)抑制抗肿瘤免疫应答[24]。除此之外,肿瘤相关的中性粒细胞(tumor associated neutrophils,TAN)在肿瘤的生长和进展中也展现出双重作用,TAN可以通过释放ROS和中性粒细胞弹性蛋白酶来介导肿瘤细胞杀伤,通过释放ROS抑制肿瘤细胞转移,并在抑制TGF-β后增强抗肿瘤T细胞反应。相反,TAN可通过释放ROS促进遗传不稳定,通过弹性蛋白酶促进肿瘤细胞增殖,通过释放VEGF、MMP-9或Bv8维持血管生成,通过可溶性介质增强肿瘤细胞的侵袭性,通过表达由TGF-β驱动的精氨酸酶,有效地抑制抗肿瘤CD8+T细胞免疫反应[24]。
2.4免疫抑制性分子 TME可以促进免疫抑制受体在T细胞上的表达,如淋巴细胞激活蛋白3(LAG-3)、T细胞免疫球蛋白及黏蛋白域蛋白分子3(TIM-3)、CTLA-4、程序性死亡受体1(PD-1)等。CTLA-4主要在辅助T细胞和Treg细胞上表达,是CD28的同源物。当CTLA-4与APC上的配体B7分子结合后导致T细胞活化受到抑制。因此,CTLA-4阻断可以放大针对肿瘤的T细胞反应[25]。PD-1是另一个关键的免疫检查点受体,作为T细胞功能的负调节剂,其表达比CTLA-4广泛。TME中活化的CD8+T细胞和Treg以及非淋巴细胞均可诱导PD-1的表达。其作用机制是和肿瘤细胞表面的PD-L1结合后抑制T细胞的活化和增殖,促进肿瘤发生免疫逃逸[26]。因此,PD-1抗体和CTLA-4抗体的联合使用成为抗肿瘤的有效治疗方法[27,28]。目前针对这些检查点开展了一系列临床试验[29]。除此之外,TME中氧气和营养供应不足,缺氧诱导因子1(HIF1)诱导各种促血管生成基因的表达。并且在低氧条件下,肿瘤细胞消耗葡萄糖并分泌乳酸,产生酸性肿瘤微环境[15]。同时,肿瘤也会分泌一些趋化因子,如CXCL12和CXCL15,不利于T细胞浸润到肿瘤部位[30](图1)。
3 实体瘤肿瘤微环境的CAR-T细胞治疗策略
3.1增强CAR-T细胞向实体瘤部位的运输 CAR-T细胞治疗在实体瘤中效果不佳的一个因素就是其向肿瘤部位运输的低效率。在血液肿瘤中,输注CAR-T细胞之后可以直接杀伤在血液中的肿瘤细胞。因此Brown等[31]采用局部递送的方法将CAR-T细胞颅内递送至3例复发性胶质母细胞瘤患者切除腔中,有两名患者在切除切缘未见肿瘤复发。接着Brown等[32]对一名患有复发性多灶性胶质母细胞瘤的患者通过两条途径(鼻腔内和脑室内)递送靶向与肿瘤相关的抗原白介素13受体α2(IL13Rα2)CAR-T细胞,与腔内相比,脑室内途径在控制远期复发方面具有更好的反应。在一项临床前试验中Murad等[33]构建了靶向肿瘤相关糖蛋白72(TAG72)的CAR-T细胞,通过向卵巢肿瘤异种移植模型中腹膜内递送该种CAR-T细胞能够显著延缓肿瘤生长,提高了小鼠的整体存活率。在一项Ⅰ期临床试验中,Katz等[34]在具有肝转移的大肠癌中,通过肝动脉局部输注靶向CEA的CAR-T细胞疗法已显示出显著效果。

图1 CAR-T细胞治疗与肿瘤微环境Fig.1 CAR-T cell therapy and tumor microenvironmentNote:A.CAR-T cell bind to tumor antigens through CAR receptors to produce antitumor effects;B.The solid tumor tumor microenviron-ment consists of a complex vasculature,matrix barrier,and a variety of immunosupp-ressive cells.At the same time,immuno-suppressive cells and tumor cells secrete various cytokines and chemokines.These factors make it difficult for T cells to infiltrate solid tumor tissues and inhibit the function of T cells.
T细胞会表达各种趋化因子受体来向肿瘤部位迁移,然而肿瘤细胞表达的趋化因子往往与其不匹配,限制了CAR-T细胞向肿瘤部位的运输。Whilding等[35]在靶向肿瘤相关αvβ6整联蛋白的CAR-T细胞中共表达了其同源受体(CXCR1或CXCR2)。结果显示,表达CXCR2的CAR-T细胞显示出针对已建立的表达αvβ6的卵巢或胰腺肿瘤异种移植物的优异的抗肿瘤活性。在神经母细胞瘤中,利用其产生趋化因子CCL2,设计了针对靶向GD2的CAR-T细胞,通过强制共表达趋化因子受体CCR2b可以增强这种作用,因为该受体指导向CCL2的迁移,并且在小鼠模型中证实该种CAR-T细胞具有较好的归巢能力及抗肿瘤效应[36]。此外,T细胞区成纤维网状细胞产生的IL-7和CCL19对于淋巴器官中T细胞区的形成和维持至关重要,因此Adachi等[37]构建了能够产生IL-7和CCL19的CAR-T细胞,能够将T细胞和DC募集到肿瘤微环境中,增强了CAR-T细胞的抗肿瘤作用。
3.2中和肿瘤微环境中的免疫抑制介质 当CAR-T细胞进入实体瘤后,会受到各种抑制性分子的影响,通过改造CAR的结构,使其产生能够重塑TME的分子,增强对实体瘤的抗肿瘤作用。通过将CAR-T细胞与免疫检查点封锁抑制剂联合使用,可增强CAR-T细胞疗法对反应不良肿瘤的疗效。Rafiq等[38]构建了能够分泌PD-1阻断单链可变片段(scFv)的CAR-T细胞,起到与CAR-T细胞和检查点抑制剂联合治疗所达到的效果。这种方法保护CAR-T细胞免受PD-1抑制,从而可以避免与系统检查点抑制相关的毒性。TGF-β是上皮细胞中重要的调节性肿瘤抑制因子,它在早期抑制增殖并诱导凋亡。然而,肿瘤细胞发展出克服TGF-β诱导的抑制作用的机制。一旦发生这种情况,细胞可能会对这种细胞因子产生反应,从而诱导其他有助于肿瘤进展的作用[39]。Zhang等[40]在前列腺癌中构建了前列腺特异性膜抗原(PSMA)特异和对免疫抑制剂分子TGF-β不敏感的CAR-T细胞,可抵抗TGF-β介导的细胞毒性T细胞功能的抑制。在小鼠异种移植模型中发现输入该种CAR-T细胞的小鼠肿瘤得到显著抑制,并且小鼠的血清IFN-γ和IL-2水平升高,表明其激活了机体抗肿瘤免疫力。
除此之外,还可以利用CAR-T细胞作为生产媒介物将促炎细胞因子(比如IL-12、IL-15、IL-18)分泌到肿瘤组织中,增强T细胞的效应能力。Hu等[41]构建了两种分泌IL-18的CAR,体外实验均证实IL-18可以增强靶向CD19和靶向MSLN的CAR-T细胞增殖,增强了靶向CD19的CAR-T细胞小鼠体内抗肿瘤活性。在神经母细胞瘤中,Chen等[42]优化了靶向GD2的CAR-T细胞,使其分泌IL-15,结果显示产生IL-15的GD2 CAR-T细胞在体外反复暴露于肿瘤细胞后具有增强的细胞毒活性,并产生Th1细胞因子,同时降低CAR-T细胞表面PD-1的表达,在异种神经母细胞瘤小鼠模型中显著抑制肿瘤生长。同样在卵巢癌中,Yeku等[43]设计了一种能够组成性分泌IL-12的靶向Muc16的CAR-T细胞,在腹水微环境中增殖更好,保留细胞毒性并抵抗凋亡。该种CAR-T细胞能够介导TAM细胞耗竭和抵抗内源性PD-L1诱导的抑制作用。在卵巢腹膜癌的同基因模型中提高了小鼠生存率。这些发现显示了抑制性微环境的作用以及如何进一步改造CAR-T细胞以维持功效。
表1 针对实体瘤肿瘤微环境开展的CAR-T临床前和临床研究
Tab.1 CAR-T preclinical and clinical studies on solid tumor microenvironment
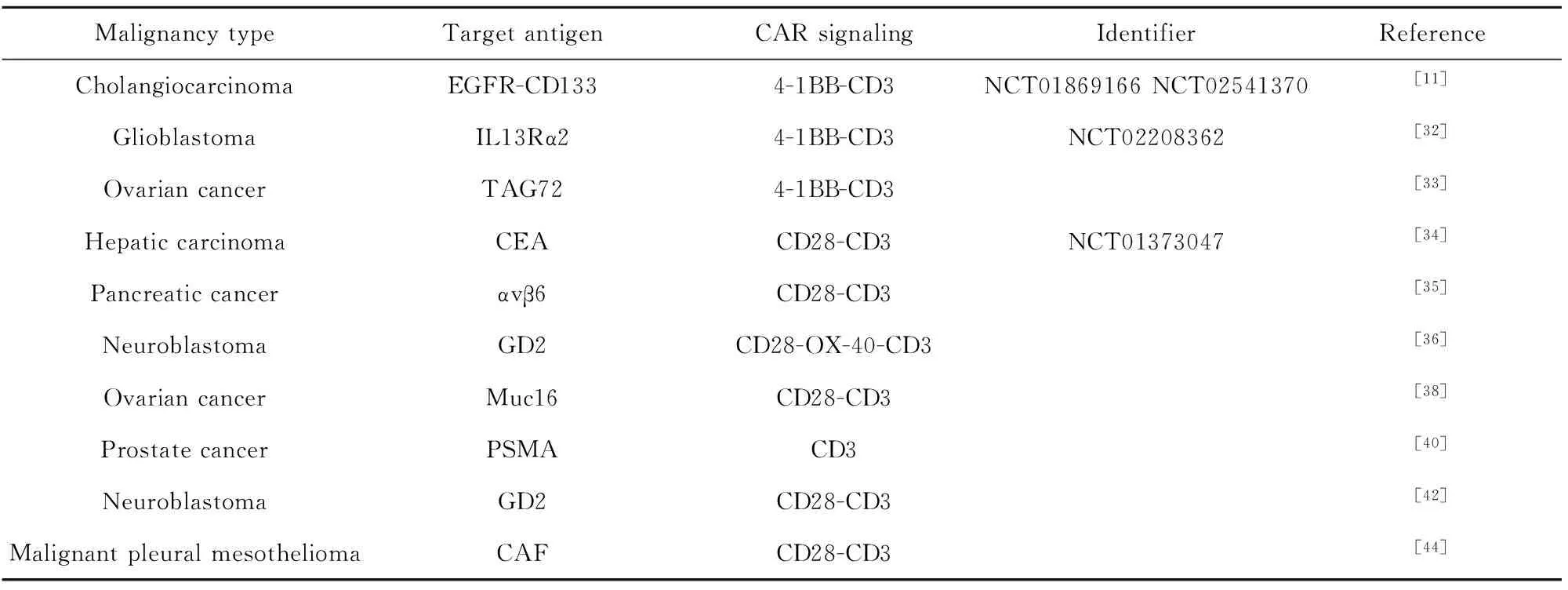
Malignancy typeTarget antigenCAR signalingIdentifierReferenceCholangiocarcinomaEGFR-CD1334-1BB-CD3NCT01869166 NCT02541370[11]GlioblastomaIL13Rα24-1BB-CD3NCT02208362[32]Ovarian cancerTAG724-1BB-CD3[33]Hepatic carcinomaCEACD28-CD3NCT01373047[34]Pancreatic cancerαvβ6CD28-CD3[35]NeuroblastomaGD2CD28-OX-40-CD3[36]Ovarian cancerMuc16CD28-CD3[38]Prostate cancerPSMACD3[40]NeuroblastomaGD2CD28-CD3[42]Malignant pleural mesotheliomaCAFCD28-CD3[44]
3.3增强肿瘤微环境中CAR-T细胞疗效的其他方法 癌症相关的成纤维细胞(CAF)促进血管生成,有助于实体瘤的进展和转移,因此Schuberth等[44]构建了靶向成纤维细胞活化蛋白(FAP)的CAR-T细胞,在体外以抗原特异性方式裂解FAP阳性间皮瘤细胞和炎性成纤维细胞,并且抑制了FAP阳性人类间皮瘤细胞在小鼠腹膜腔的生长,并显著延长了小鼠的生存期。此外,T细胞代谢途径的修饰也为抵消免疫抑制性TME提供另一种思路。T细胞的活化增殖以及发挥效应功能需要糖酵解提供能量,然而肿瘤细胞扩张需要更多的能量,对T细胞的有效活化具有竞争性抑制作用。可以通过在体外培养时限制糖酵解代谢来保留其抗肿瘤活性,如外源精氨酸补充体外培养基抑制T细胞糖酵解代谢,同时促进氧化途径,导致体内细胞持久性和抗肿瘤活性增加(表1)[45,46]。
4 展望
CAR-T细胞疗法在血液系统肿瘤中已经展示了令人满意的临床效果,但针对实体瘤的CAR-T细胞疗效欠佳。主要原因在于实体瘤具有复杂的免疫抑制微环境,限制了CAR-T细胞的运输并降低了其活性。近年来,开发新方法来破解实体瘤引起的障碍,并针对这些特定适应症优化CAR-T细胞治疗,包括寻找新的肿瘤特异性抗原和CAR-T在肿瘤部位的浸润,中和或调节免疫抑制性TME,优化CAR-T功能减轻潜在的毒性等,在一定程度上揭示了CAR-T细胞治疗在实体瘤中的作用机理,使实体瘤的治疗取得较好疗效,也为肿瘤患者带来福音。
