scFv亲和力对CAR-T细胞抗肿瘤能力的影响①
2020-06-05张代群王淑敏石晓娟
张代群 李 峰 王淑敏 张 凯 石晓娟 张 毅
(郑州大学第一附属医院生物细胞治疗中心,郑州大学生命科学学院,郑州 450052)
嵌合抗原受体T(CAR-T)细胞已经在血液恶性肿瘤临床应用中取得了较好的临床效果[1]。但是,CAR-T细胞在治疗实体瘤方面并没有取得预期的疗效,其中CAR-T细胞在应用过程中产生的脱靶效应是主要原因之一[2]。人类表皮生长因子受体2(HER2,也称为Her-2/neu或ErbB2)是跨膜表皮生长因子受体家族的成员,在多种肿瘤细胞表面呈高水平表达,可被用作CAR-T细胞治疗的靶点[3,4]。然而,2010年Morgan等[5]报道了一名ErbB2高表达的结肠癌患者接受ErbB2-CAR-T细胞治疗的病例,患者在接受细胞回输15 min后出现呼吸困难,最终在5 d后死亡,可能是因为患者肺部存在低水平的ErbB2表达,使CAR-T细胞产生脱靶效应,从而攻击正常的肺部组织。为了消除这种脱靶效应,通过改变单链可变区(scFv)降低CAR结合域对靶标的亲和力已成为一种流行的策略[6,7],但是,降低CAR亲和力也可能会减弱抗肿瘤功能的效力[8]。因此,关键是要确定能够达到最好的抗肿瘤效果并且不会产生脱靶效应的条件。本课题组应用靶向ErbB2的两种低亲和力的scFv——FRP5(KD=30 nmol/L)和chA21(KD=11 nmol/L)作为CAR的细胞外结合域[9,10],其中chA21的亲和力高于FRP5,通过对比两种CAR-T细胞对肿瘤细胞的杀伤作用、细胞因子分泌以及形成免疫突触的能力,证明chA21-CAR-T能够产生更强的抗肿瘤效应,并且不会产生脱靶效应。
1 材料与方法
1.1材料 MCF-7、MRC-5和293T细胞均购自上海中国科学院细胞所,DMEM高糖培养基、RPMI1640培养基购自Sigma公司(美国),胎牛血清购自HyClone公司(美国),青链霉素混合溶液购自Gibco公司(美国),人外周血淋巴细胞分离液购自天津灏洋生物制品有限公司,Human CD8 microbeads购自美天旎公司(德国),Dynabeads Human T-Activator CD3/CD28、Lipofectamine 3000、eBioscienceTMCell Proliferation Dye eFluorTM670购自Thermo Fisher Scientific公司(美国),ELISA试剂盒和流式细胞术所用荧光抗体均购自Biolegend公司(美国),重组人白介素2购自北京双鹭药业股份有限公司。
1.2方法
1.2.1分离外周血单个核细胞 采集20 ml健康志愿者的外周血于无菌的肝素抗凝采血管中,1 500 r/min 离心10 min后弃上层血浆,将下层细胞转移至50 ml无菌离心管,加入无菌PBS稀释至30 ml 后轻晃混匀,另取一个50 ml无菌离心管,加入15 ml外周血淋巴细胞分离液。将稀释后的血液倾倒于淋巴细胞分离液的液面上。2 500 r/min离心25 min;用无菌移液管吸取中间白膜层至另一无菌50 ml离心管中,加无菌PBS至50 ml,1 500 r/min离心10 min,外周血单个核细胞(peripheral blood mononuclear cells,PBMC)在沉淀中。
1.2.2分选及培养CD8+T细胞 通过细胞免疫磁珠分选法获得CD8+T细胞。用磁珠分选缓冲液重悬PBMC,1 500 r/min离心5 min后弃上清。显微镜下计数后,每1×107个细胞避光加入20 μl人CD8磁珠和80 μl磁分选缓冲液,混匀后置于4℃避光孵育20 min。1 500 r/min离心5 min后弃上清,加入适量磁分选缓冲液重悬细胞。在磁分选磁场中固定磁分选柱子,用磁分选缓冲液润洗柱子后缓慢加入细胞悬液,待全部细胞通过柱子后,用磁分选缓冲液清洗柱子2次。将柱子从磁场中取出,用活塞快速加压将细胞收集至离心管内,离心弃上清,沉淀即为CD8+T细胞。用加了人IL-2重组蛋白的含10%胎牛血清的RPMI1640重悬后,将细胞铺于12孔板中,同时加入CD3/CD28 beads活化。
1.2.3制备及培养FRP5-CAR-T与chA21-CAR-T细胞 合成FRP5-4-1BB-CAR与chA21-4-1BB-CAR的序列,CAR结构包括CD8α导肽、FRP5或chA21的单链可变区序列(scFv)、CD8α铰链区与跨膜区、4-1BB、CD3ζ信号及2A剪切肽(P2A),并连接绿色荧光蛋白(green fluorescent protein,GFP),将其亚克隆入慢病毒载体中,获得质粒,测序鉴定正确后,通过转染293T细胞获得病毒上清,感染CD8+T细胞获得CAR-T细胞。
1.2.4流式细胞术检测转染效率 收集对照组(UTD)T细胞及CAR-T细胞各1×105个,1 500 r/min离心5 min后弃上清,用PBS清洗后用200 μl的PBS重悬细胞,以UTD组的T细胞为对照,流式细胞术检测GFP表达效率。
1.2.5血球计数法检测T细胞增殖能力 将CAR-T细胞各5×106个/孔的初始数量铺于12孔板中,置于37℃,5%CO2培养箱中培养,在培养的第3天、第6天、第9天和第12天收取细胞,混匀后吸取10 μl于血球计数板上计数,比较CAR-T细胞的增殖能力。
1.2.6流式细胞术检测T细胞的分化状态 收取T细胞1×105个于1.5 ml EP管,避光加入CD8-APC-Cy7、CD45RA-APC、CD62L-PE,4℃孵育20 min后在流式细胞仪检测。CD45RA+CD62L+为初始T细胞(naïve T cells,Tn),CD45RA+CD62L-为效应T细胞(effector T cells,Teff),CD45RA-CD62L+为中心记忆性T细胞(center memory T cells,Tcm),CD45RA-CD62L-为效应记忆性T细胞(effector memory T cells,Tem)。
1.2.7流式细胞术检测细胞ErbB2的表达水平 收集MRC-5和MCF-7两种细胞各1×105个于1.5 ml EP管,Flow buffer洗涤后避光加入流式抗体ErbB2-APC,以同型对照为参考,4℃避光孵育 20 min 后于流式细胞仪检测。
1.2.8ELISA检测功能性分子的分泌水平 分别用UTD组T细胞、FRP5-CAR-T细胞、chA21-CAR-T细胞与MRC-5、MCF-7细胞共孵育24 h,1 500 r/min离心5 min后收集上清,用酶联免疫吸附实验(ELISA)检测上清中T细胞效应分子IL-2、IFN-γ分泌量的差异。
1.2.9CAR-T细胞杀伤能力的检测 用转染空载体的T细胞、FRP5-CAR-T细胞和chA21-CAR-T细胞分别与荧光素酶转基因的MRC-5和MCF-7细胞按照0∶1、1∶1、5∶1和20∶1 的效靶比共孵育24 h后,加入荧光素底物后在活体成像仪下检测肿瘤细胞的荧光强度变化,以荧光强度代表肿瘤细胞的数量。
1.2.10成像流式细胞仪检测免疫突触 肿瘤细胞用eBioscienceTMCell Proliferation Dye eFluorTM670染料,再用F-actin染料分别标记肿瘤细胞和CAR-T细胞,最后将两种细胞在37℃共孵育30 min,用成像流式细胞仪检测免疫突触的形成,用Image J分析形成突触的荧光强度。

2 结果
2.1构建FRP5-CAR-T和chA21-CAR-T细胞 根据实验设计,分别构建了靶向ErbB-2抗原的FRP5 4-1BB-CAR(KD=30 nmol/L)[11]和chA21 4-1BB-CAR(KD=11 nmol/L)[12](图1A);利用慢病毒转染的方法,成功构建两种CAR-T细胞,并通过流式细胞仪检测转染效率,FRP5:44.2%,chA21:44.5%(图1B);用Fab染色的方法证明CAR分子在细胞表面的表达差异无统计学意义(图1C)。
2.2检测CAR-T细胞的增殖能力和分化情况 FRP5-CAR-T细胞及chA21-CAR-T细胞增殖能力和分化情况差异均无统计学意义(图2A~C),证明不同亲和力的scFv不会对CAR-T细胞的增殖和表型有影响。
2.3CAR-T细胞对ErbB2low细胞和ErbB2hi细胞的杀伤能力 分别检测人胚肺成纤维细胞MRC-5和肿瘤细胞系MCF-7表达ErbB2的情况,MRC-5为ErbB2low,MCF-7为ErbB2high(图3A),统计平均荧光强度发现MRC-5表面ErbB2表达密度远低于MCF-7(P<0.05,图3B)。随后将两种CAR-T细胞分别与转入荧光素酶的MRC-5和MCF-7以不同效靶比共孵育24 h,以检测CAR-T细胞的杀伤能力,当效靶比为5∶1和10∶1时可以看出,chA21-CAR-T细胞的杀伤能力显著高于FRP5-CAR-T细胞(P<0.05,图3C~F),差异具有统计学意义,而且没有产生脱靶效应。

图1 CAR-T细胞构建Fig.1 Construction of CAR-T cellsNote:A.Schematics of CAR molecule;B.GFP positive efficiency were detected by FACS day 4 after transduction;C.Fab staining for detection of CAR expression density.

图2 CAR-T细胞的增殖和分化Fig.2 Proliferation and differentiation of CAR-T cellsNote:A.Expansion curve of CAR-T cells;B,C.Phenotypes of CAR-T cells were detected using CD62L and CD45RA antibodies by FACS.
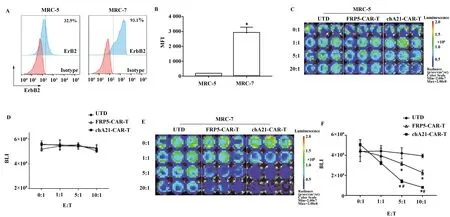
图3 scFv亲和力对CAR-T细胞抗肿瘤能力的影响Fig.3 Effect of scFv affinity on anti-tumor ability of CAR-T cellsNote:A,B.Detected cell surface ErbB2 expression levels by FACS,data were analyzed by student t test,*.P<0.05 vs MRC-5 group;C-F.Co-culture CAR-T cells with MRC-5 and MCF-7 cells with E∶T=0∶1,1∶1,5∶1,20∶1,and determined antitumor efficiency by IVIS imaging;*.P<0.05 vs UTD group;#.P<0.05 vs FRP5-CAR-T group.
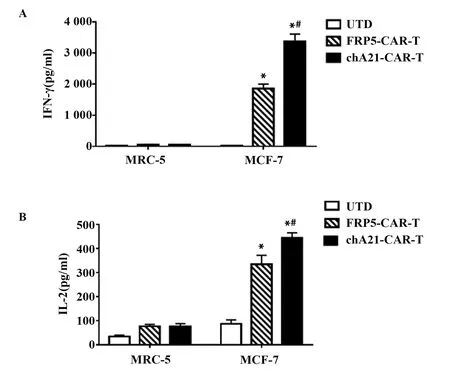
图4 scFv亲和力对CAR-T细胞分泌细胞因子的影响Fig.4 Effect of scFv affinity on secretion of cytokines by CAR-T cellsNote:A,B.Determination of IFN-γ and IL-2 concentrations in co-incubated supernatants.*.P<0.05 vs UTD group;#.P<0.05 vs FRP5-CAR-T group.

图5 scFv亲和力对CAR-T细胞长期抗肿瘤能力的影响Fig.5 Effect of scFv affinity on long-term anti-tumor ability of CAR-T cellsNote:A.Co-culture CAR-T cells with MCF-7 cells with E∶T=1∶1,and determined antitumor efficiency by IVIS imaging;B.Fluorescence intensity chart.*.P<0.05 vs UTD group;#.P<0.05 vs FRP5-CAR-T group.
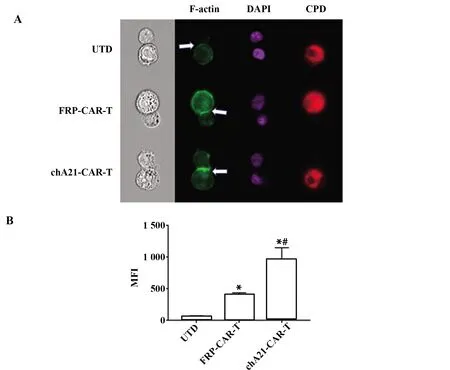
图6 scFv亲和力对CAR-T细胞形成免疫突触的影响Fig.6 scFv affects ability of CAR-T cells to form imm-une synapsesNote:A.Co-culture CAR-T cells with MCF-7 cells,and detected immune synapses by imaging flow;B.Statistical analysis of immune synaptic MFI using image J software;*.P<0.05 vs UTD group;#.P<0.05 vs FRP5-CAR-T group.
2.4scFv亲和力对CAR-T细胞分泌细胞因子能力的影响 收取CAR-T和肿瘤细胞共孵育的上清,用ELISA方法检测CAR-T细胞分泌细胞因子的情况,发现chA21-CAR-T细胞比FRP5-CAR-T细胞分泌更多的IL-2和IFN-γ(P<0.05,图4)。
2.5scFv亲和力对CAR-T细胞长期抗肿瘤能力的影响 将CAR-T细胞与肿瘤细胞按1∶1的效靶比以每种细胞1×105个/孔的密度铺到12孔板中,持续观察发现,chA21-CAR-T细胞对肿瘤细胞生长的抑制作用明显强于FRP5-CAR-T细胞(P<0.05,图5)。
2.6scFv亲和力对CAR-T细胞形成免疫突触的影响 细胞毒性T淋巴细胞(CTL)通过与靶细胞形成免疫突触并向细胞间隙分泌颗粒酶和疏水性蛋白穿孔素而诱导细胞凋亡[11]。检测不同亲和力scFv对CAR-T细胞形成免疫突触能力的影响,首先标记肿瘤细胞,再用F-actin对CAR-T细胞和肿瘤细胞分别染色,共孵育后,用成像流式细胞仪检测形成免疫突触的情况,结果显示chA21-CAR-T形成免疫突触的能力更强(P<0.05,图6)。
3 讨论
由于CAR-T细胞在靶向肿瘤相关抗原时会产生脱靶效应,这很大程度上限制了CAR-T疗法在实体瘤中的应用。脱靶效应产生的主要原因是缺少理想靶点[12,13],因此,调节CAR-T细胞对靶抗原的亲和力来避免脱靶效应是一种可行的策略[14],降低CAR对靶标的亲和力会提高CAR-T细胞活化的阈值,避免过度活化从而保持记忆表型[15,16],使CAR-T细胞能够长期存活,但同时也会一定程度阻碍抗肿瘤效力[9,10],因此提高CAR-T治疗效率和安全性的关键是平衡抗原识别和脱靶效应。
ErbB2是目前研究最多的肿瘤相关抗原之一,本研究成功构建了靶向ErbB2的两种不同亲和力scFv的CAR-T细胞,结果显示,两种CAR-T细胞均不会靶向低水平表达靶抗原的正常成纤维细胞,同时,更高亲和力的chA21-CAR-T细胞的肿瘤杀伤效果和细胞因子分泌水平更高,且具有更强的长期抗肿瘤能力。
预防CAR-T细胞治疗所产生的脱靶效应有很多途径,如在降低scFv亲和力的同时增强细胞内共刺激信号,降低CAR-T细胞活化的阈值,使CAR-T细胞更容易被活化[10]。本课题提出调节scFv亲和力使其在抗肿瘤效力与防止脱靶效应之间保持平衡,为CAR-T细胞治疗的临床应用提供新的思路。
