瑞芬太尼对内毒素诱导的急性肺损伤大鼠氧自由基、炎症因子及肺纤维化的影响①
2020-06-05万永灵四川省人民医院麻醉科成都610031
刘 宇 李 耀 万永灵 (四川省人民医院麻醉科,成都 610031)
急性肺损伤(acute lung injury,ALI)是败血症最常见的并发症之一,同时也是全身炎症反应综合征最易出现的一种器官组织损伤[1]。临床上表现为肺水肿或低氧血症[2]。ALI 常见的病理生理机制包括炎症反应和氧化应激[3]。目前治疗ALI的药物较多,但ALI 的死亡率仍较高[4]。瑞芬太尼是新型超短效μ阿片受体激动剂,这种药物具有起效快、易代谢等特点。Zhang等[5]研究表明:瑞芬太尼具有抑制氧化应激反应和炎症反应的效果。目前对于瑞芬太尼对心肌缺血-再灌注损伤保护的研究较多[6],但对于ALI研究较少。本文旨在探究瑞芬太尼对内毒素诱导的ALI大鼠氧自由基、炎症因子及肺纤维化的影响,以期了解瑞芬太尼对内毒素诱导的ALI大鼠氧自由基、炎症因子及肺纤维化的作用机理,从而为ALI提供一定的理论依据。
1 材料与方法
1.1材料
1.1.1动物 3周龄SPF级SD大鼠75只,购自广东医学院实验动物中心,粤监证字 2004A029号。所有大鼠均在本院动物中心实验室饲养。该实验经过动物伦理委员会批准同意。
1.1.2试剂 TRIzol 试剂购自Thermo Fisher公司;IL-6、IL-1β、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)试剂盒购自美国Sigma 公司;活性氧基团(reactive oxygen species,ROS)、超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialde-hyde,MDA)、乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒均购自上海恒远生物科技有限公司;Caspase-3抗体购自武汉华联科有限公司;中性福尔马林、酒精、 二甲苯购自天津科密欧有限公司;Masson染色试剂盒购自美国Bio-Red公司。
1.1.3仪器 光学显微镜购自东莞市同创仪器有限公司;BS-124s型电子天平购自北京赛多斯仪器系统有限公司;TDL-5 型台式离心机购自上海安亭科学仪器厂;低温离心机购自湖南恒诺离心机有限公司;蛋白电泳及转膜仪购自美国Bio-Rad公司;凝胶成像系统购自以色列DNR公司;切片机购自德国Leica公司。
1.2方法
1.2.1分组及建立模型 将75只大鼠适应性喂养 1 周,随机选15只为空白对照组,其余60只大鼠采用内毒素诱导制作ALI模型,制作方法及判断模型是否成功参考陶振钢等[7]的研究。具体操作如下:腹腔内注射氯氨酮麻醉动物后,腹腔注射内毒素10 mg/kg,注射量为:2 ml,注射完毕后置动物于实验室内喂养,空白对照组使用同样的方法腹腔内注入同体积的0.9%NaCl溶液。
1.2.2药物干预 低剂量瑞芬太尼组于术后静脉输注0.2 μg/(kg·min)瑞芬太尼,持续30 min;中剂量瑞芬太尼组于术后静脉输注0.6 μg/(kg·min)瑞芬太尼,持续30 min;高剂量瑞芬太尼组于术后静脉输注1.2 μg/(kg·min)瑞芬太尼,持续30 min;模型组静脉输注与高剂量实验组等量的0.9%NaCl,空白对照组不做任何处理。
1.2.3检测项目
1.2.3.1肺损伤评分及肺组织W/D值 肺损伤评分项目包括:支气管内出血和碎屑、充血、水肿、中性粒细胞浸润、细胞增生,按损伤程度分为0、1、2和3分。取大鼠左下叶肺组织,使用生理盐水充分漂洗后使用滤纸吸干多余水分,称湿重,80℃烘干24 h 称干重,计算肺组织湿/干重比值(W/D)。
1.2.3.2RT-PCR 用TRIzol试剂提取各组细胞总RNA,测定RNA浓度和纯度后,用反转录试剂盒合成cDNA,用PCR仪进行扩增,用SYBR PCR Master Mix试剂盒对Caspase-3表达水平进行检测,以GAPDH为内参。
1.2.3.3Western blot 检测蛋白表达水平 用10%SDS-聚丙烯酰胺凝胶电泳提取总蛋白,半干法将蛋白转移到PVDF膜,置于5%脱脂奶粉室温封闭2 h后加入各检测需要蛋白的一抗、二抗,孵育2 h,TBS洗净,以β-actin为内参蛋白,采用显色液显色后行吸光度分析,计算各蛋白相对表达量。
1.2.3.4氧自由基检测 使用10%水合氯醛(350 mg/kg)麻醉大鼠,腹主动脉取血分离血清0.5 ml,严格按照试剂盒说明书检测ROS、MDA、TNF-α、IL-1β含量水平。
1.2.3.5炎症因子检测 从大鼠颈总动脉插管接取0.5 ml血液,按照IL-6、IL-1β及TNF-α试剂盒子上的操作方法使用酶联免疫吸附试验(ELISA)检测大鼠血清中的IL-6、IL-1β及TNF-α含量。
1.2.3.6Masson染色 将各组大鼠部分肺组织用石蜡包埋做成石蜡切片,按照Masson染色试剂盒方法,将切片用蒸馏水冲洗,依次浸入二甲苯和不同浓度梯度的乙醇溶液,并用无水乙醇脱水处理,按照说明书依次用试剂盒中的A、B染色液染色,清洗;最后加入E染液,用乙醇和二甲苯进行透明处理,中性树脂封片,在光镜下分析。
1.3统计学方法 本研究数据分析和作图采用的软件为SPSS22.0和GraphPad Prism5,使用单因素方差分析,若P<0.05则表明差异有统计学意义,本研究所有检验均为双侧检验。
2 结果
2.1Caspase-3表达检测结果 由图1可见,相比空白对照组,模型组大鼠Caspase-3 mRNA及Caspase-3蛋白表达量显著升高(P<0.05);相比模型组,低剂量瑞芬太尼组大鼠Caspase-3 mRNA及Caspase-3蛋白表达量显著降低(P<0.05);相比低剂量瑞芬太尼组,中剂量瑞芬太尼组大鼠Caspase-3 mRNA及Caspase-3蛋白表达量显著降低(P<0.05);相比中剂量瑞芬太尼组,高剂量瑞芬太尼组大鼠Caspase-3 mRNA及Caspase-3蛋白表达量显著降低(P<0.05)。
2.2大鼠肺部损伤检查结果 由图2可以看出,相比空白对照组,模型组大鼠肺损伤评分、湿/干重比值显著升高(P<0.05);相比模型组,低剂量瑞芬太尼组大鼠肺损伤评分、湿/干重比值显著降低(P<0.05);相比低剂量瑞芬太尼组,中剂量瑞芬太尼组大鼠肺损伤评分、湿/干重比值显著降低(P<0.05);相比中剂量瑞芬太尼组,高剂量瑞芬太尼组大鼠肺损伤评分、湿/干重比值显著降低(P<0.05)。
2.3氧自由基检测结果 由图3可以看出,相比空白对照组,模型组大鼠SOD水平显著降低,ROS、LDH、MDA水平显著升高(P<0.05);相比模型组,低剂量瑞芬太尼组大鼠SOD水平显著升高,ROS、LDH、MDA水平显著降低(P<0.05);相比低剂量瑞芬太尼组,中剂量瑞芬太尼组大鼠SOD水平显著升高,ROS、LDH、MDA水平显著降低(P<0.05);相比中剂量瑞芬太尼组,高剂量瑞芬太尼组大鼠SOD水平显著升高,ROS、LDH、MDA水平显著降低(P<0.05)。
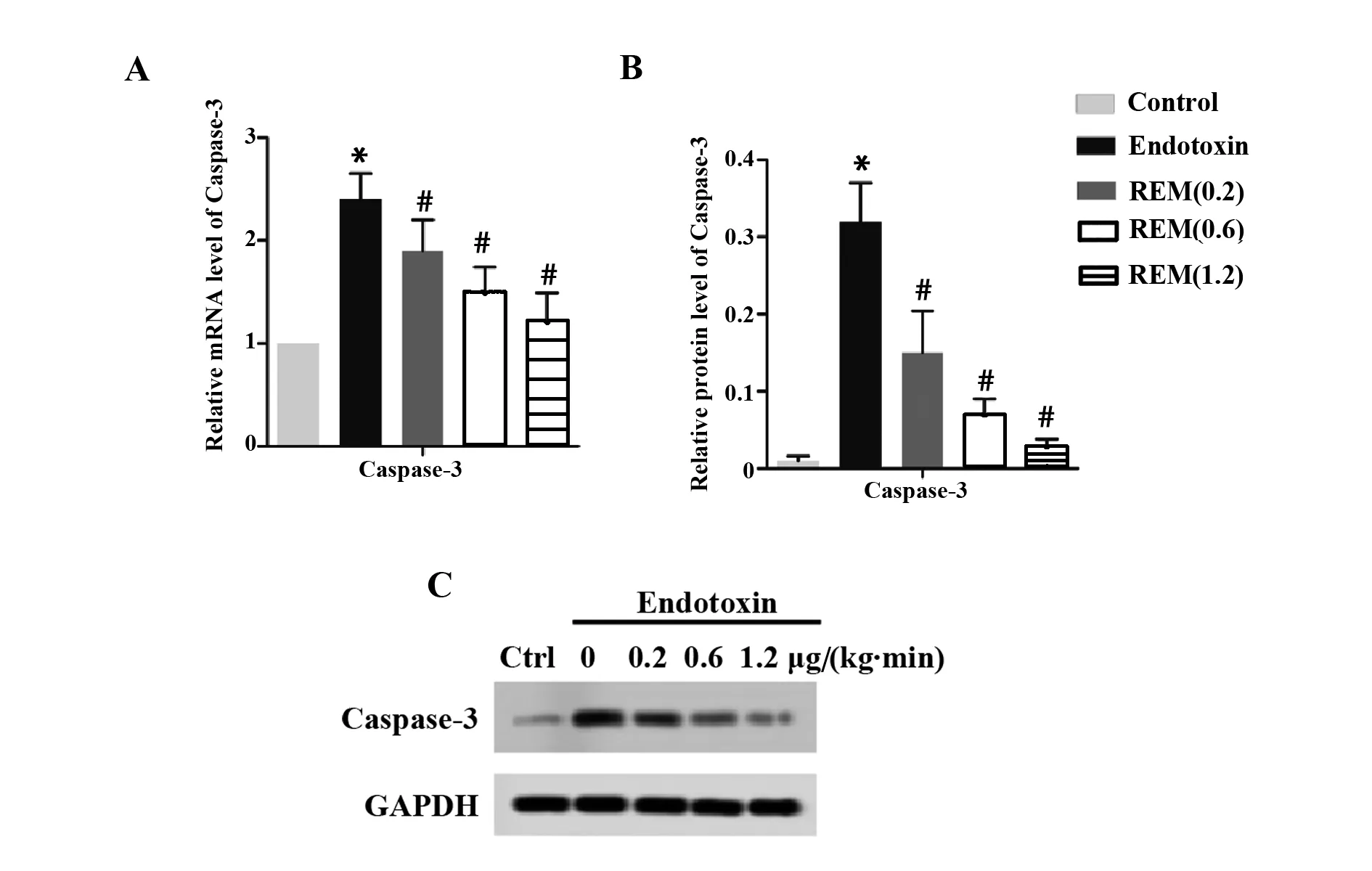
图1 Caspase-3表达检测结果Fig.1 Test results of Caspase-3 expressionNote:A.The expression of Caspase-3 mRNA in each group;B.The relative expression quantity of Caspase-3 protein;C.Western blot picture of Caspase-3 protein.Compared with control group,*.P<0.05;compared with Endotoxin group,#.P<0. 05.
2.4炎症因子检测结果 由图4可以看出,相比空白对照组,模型组大鼠TNF-α、IL-6、IL-1β水平显著升高(P<0.05);相比模型组,低剂量瑞芬太尼组大鼠TNF-α、IL-6、IL-1β水平显著降低(P<0.05);相比低剂量瑞芬太尼组,中剂量瑞芬太尼组大鼠TNF-α、IL-6、IL-1β水平显著降低(P<0.05);相比中剂量瑞芬太尼组,高剂量瑞芬太尼组大鼠TNF-α、IL-6、IL-1β水平显著降低(P<0.05)。
2.5Masson染色观察纤维化及α-SMA表达检测结果 由图5A可以看出,空白对照组的大鼠肺组织细胞排列紧密有序;模型组大鼠肺组织出现明显的组织纤维化,并伴随有组织损伤;使用瑞芬太尼处理的各组大鼠肺组织也出现组织纤维化,与模型组相比,肺组织的纤维化和损伤明显得到改善。由图5B可以看出,相比空白对照组,模型组大鼠α-SMA表达水平显著升高(P<0.05);相比模型组,低剂量瑞芬太尼组大鼠α-SMA表达水平显著降低(P<0.05);相比低剂量瑞芬太尼组,中剂量瑞芬太尼组大鼠α-SMA表达水平显著降低(P<0.05);相比中剂量瑞芬太尼组,高剂量瑞芬太尼组大鼠α-SMA表达水平显著降低(P<0.05)。

图2 大鼠肺部损伤检查结果Fig.2 Test results of lung injury in ratsNote:A.The lung injury scores;B.Wet/dry weight of lung tissue. Compared with control group,*.P<0.05;compared with Endotoxin group,#.P<0.05.

图3 氧自由基检测结果Fig.3 Test results of oxygen radicalsNote:A.The SOD content;B.The ROS content;C.The LDH content;D.The MDA content. Compared with control group,*.P<0.05;compared with Endotoxin group,#.P<0.05.

图4 炎症因子检测结果Fig.4 Test results of inflammatory factorsNote:A.The TNF-α content;B.The IL-β content;C.The IL-6 content.Compared with control group,*.P<0.05;compared with Endotoxin group,#.P<0.05.

图5 Masson染色观察纤维化及α-SMA表达检测结果Fig.5 Test results of fibrosis and α-SMA expression observed by Masson stainingNote:A.The results of Masson staining;B.The results of α-SMA expression. Compared with control group,*.P<0.05;compared with Endotoxin group,#.P<0.05.
3 讨论
细胞凋亡是一种有序或程序性的细胞死亡,这种程序性死亡是受相关基因调控的细胞主动性死亡过程[8]。其中Caspase是细胞凋亡的核心,Caspase-3、Caspase-9等是Caspase家族的凋亡因子[9]。Caspase-9基因处于Caspase 家族激活基因的顶端,是Caspase家族中最常见的凋亡启动子,通过自身的裂解使得 proCaspase-3 产生有活性的 Caspase-3。这种有活性的 Caspase-3是执行凋亡的基因,主要作用机理是通过剪切另外的 Caspase 底物引起级联反应,最终导致细胞凋亡[10]。本研究发现,相比模型组,使用瑞芬太尼处理各组大鼠Caspase-3 mRNA及Caspase-3蛋白表达量显著降低,说明瑞芬太尼可抑制细胞的凋亡,保护大鼠肺组织。金小雪等[11]研究表明:瑞芬太尼可抑制细胞的凋亡,与本研究得出的结论相一致。
目前对ROS的研究越来越成熟,实验证实了 ROS 的堆积过量是导致氧化应激损伤的重要机制之一[12]。高婷等[13]研究表明,在健康的细胞内ROS的水平是一定的,但若体内存在氧化应激,则细胞会产生大量的ROS并破坏线粒体膜和细胞膜的完整性对细胞膜造成损伤,同时还会导致上皮细胞膜的通透性增加,导致细胞内SOD、GPX 等酶的大量释放至细胞外。因此,ROS损伤被认为是引起细胞氧化损伤的主要机制。目前在机体内源性抗氧化体系中,关于抗氧化酶体系的研究较为深入,但最常见的一组抗氧化酶体系为:SOD/GPX/CAT 反应系统是主要的一组抗氧化酶体系。SOD/GPX/CAT它们分工合作共同抵御机体受到外源或内生的氧化应激损伤。SOD分为3 种亚型SOD1、SOD2、SOD3,主要将活性氧转换成 H2O2,然后 GPX 和 CAT 将 H2O2解离成水[14]。崔笑梅等[15]研究表明:上调 SOD 基因的表达将增强机体清除氧自由基的能力,导致严重的氧化损伤。本研究可以看出,相比模型组,使用瑞芬太尼处理各组大鼠,SOD含量水平显著升高,ROS、LDH、MDA水平显著降低,且随着使用瑞芬太尼剂量的增加效果越显著,说明瑞芬太尼可以显著抑制大鼠体内的氧化应激反应,且呈剂量依赖性。研究表明:瑞芬太尼可以抑制体内的氧化应激反应,与本研究得出的结论相一致。张静[16]研究表明:细胞因子主要可分为促炎性细胞因子和抗炎性细胞因子两种。目前研究较多的促炎性细胞因子包括:TNF-α、IL-1β、IL-6 和IL-8 等;抗炎性细胞因子则包括:IL-4、IL-10、白介素-1受体拮抗剂(IL-1ra)、TNF结合蛋白(TNF-BP)和可溶性TNF 受体(TNF-sr)等,本研究中主要研究TNF-α、IL-1β、IL-6这几种炎症因子。Cen等[17]研究表明:IL-1β、IL-6、TNF-α是重要的促炎性细胞因子,它们主要由单核细胞和巨噬细胞等免疫细胞和非免疫细胞等分泌,是炎症的重要介导物质。本研究可以看出,相比模型组,使用瑞芬太尼处理各组大鼠,TNF-α、IL-6、IL-1β含量水平显著降低,且随着使用瑞芬太尼剂量增加下降更为显著。说明瑞芬太尼可以有效降低大鼠体内炎症反应,且呈剂量依赖性。杜成等[18]研究表明:瑞芬太尼可以抑制炎症反应,与本研究得出的结论相一致。
综上所述,瑞芬太尼可以有效减轻大鼠因内毒素诱导的急性肺损伤,其作用机制可能与抑制氧化应激反应和炎症反应并抑制肺组织细胞的凋亡有关。但本实验仅在大鼠上进行有关实验,在后续的实验中将扩大在临床上检测瑞芬太尼的作用效果。
