基质细胞衍生因子-1与碱性成纤维细胞因子对体外骨髓间充质干细胞增殖、分化和趋化的影响
2020-06-03曾麟雅曾英杰
曾麟雅,赖 爽,曾英杰,肖 力
(四川省医学科学院·四川省人民医院口腔科,四川 成都 610072)
牙再生是口腔科学中的研究热点,其中牙周膜再生作为牙再生中的难点和重点受到广泛关注。大量研究表明[1,2],保持或者重新获得牙周膜细胞(periodontal ligament cells,PDLCs)的活性,是牙周膜成功再生的关键。基质细胞衍生因子-1(stromal cell derived factor-1,SDF-1)是一类具有趋化作用的小分子蛋白,对BMSCs和PDLSCs都有趋化作用[3]。最新研究发现[4],碱性成纤维细胞因子(basic fibroblast growth factor,bFGF)可以促进再植牙形成新的牙周膜纤维,并在防止再植牙骨性粘连和牙根吸收方面有一定作用。2018年6月至2019年5月本实验采用MTT法,初步研究SDF-1和bFGF对比格犬BMSCs增殖的影响,探讨两种因子对比格犬BMSCs增殖影响的最佳浓度,并利用RT-PCR检测成骨、成纤维相关因子以及趋化相关基因的表达,为进一步研究利用BMSCs促进牙周膜再生提供理论依据。
1 材料与方法
1.1 试剂及仪器α-MEM培养基(Hyclone,USA);胎牛血清(Hyclone,USA);MTT溶液(Sigma,USA);CO2恒温孵箱(MCO-15AC型,Sanyo electric,Japan);倒置相差显微镜及照像系统(IX70-S8F2型,Olympus optical,Japan);全自动定量绘图酶标仪(Varioskanflash3001-1275,Thermo,USA;BestarTM qPCR RT kit(DBI Bioscience,China)。
1.2 方法
1.2.1比格犬BMSCs的分离培养、鉴定和分化原代培养及纯化 选取18~24个月龄雄性体健比格犬,全麻下行骨髓穿刺,获得比格犬髂骨骨髓,并以差别贴壁法加以纯化;传代培养待原代P0细胞贴壁融合达80%~90%时,以1∶2的比例传代培养得到第一代(P1)细胞。用P2~P4细胞进行实验。消化收集P2~P4比格犬BMSCs,制成5×106/ml的单细胞悬液,分为100 μl每管,加入抗犬CD29、CD34、CD44、CD45抗体并充分混匀,鉴定流式细胞学检测表面抗原标志物CD34、CD29 、CD44及CD45的表达。同时,消化收集P2~P4比格犬骨髓干细胞,将细胞密度调整为6×104/ml,用微量加样枪小心滴加细胞悬液于6孔板上,每孔接种500 μl,分为成骨诱导组,成脂诱导组和对照组;接种24 h后,成骨诱导组每孔加入2 ml成骨诱导培养基,对照组仍加完全培养基,继续孵箱培养,诱导20 d后茜素红染液,倒置相差显微镜下观察并采图。成脂诱导为接种72 h后加入2 ml成脂诱导培养基,对照组仍加完全培养基,诱导14天后油红O染色,倒置相差显微镜下观察并采图。
1.2.2MTT检测不同浓度SDF-1和bFGF分别对BMSCs的增殖作用 收集P2~P4比格犬BMSCs,调整细胞密度为1×107/ml,滴加细胞悬液于96孔板上,每孔接种2 μl,于CO2孵箱培养,分别加入不同浓度的SDF-1 (100、200、300 ng/ml)与bFGF(20、50、100 ng/ml)进行干预。于培养的1、3、5、7 d,每天同一时间收集样本(n=10)进行MTT比色实验。选570 nm波长,在全自动酶标仪上测定各孔光吸收(OD)值。以时间为横轴,OD值为纵轴绘制细胞生长曲线。
1.2.3MTT检测最佳浓度时SDF-1和bFGF对BMSCs增殖作用 实验步骤同上,实验分组为空白对照组(未加入任何细胞因子)和实验组(加入最佳浓度的SDF-1和bFGF)。
1.2.4RT-PCR检测成骨、成纤维相关因子以及趋化相关基因的表达 取生长状态良好的P2~P4代比格犬BMSCs,将细胞分为三组,即空白对照组、SDF-1组(培养基中加入最佳浓度SDF-1)和bFGF组(培养基中加入最佳浓度bFGF),培养5天后,提取细胞的总RNA,逆转录为cDNA,然后进行实时定量PCR反应,检测碱性磷酸酶(ALP)、I型胶原、Ⅲ型胶原蛋白、C-X-C家族趋化因子受体4(CXCR4)以及S100A4等基因表达的差异。
1.3 统计学方法采用SPSS 17.0统计软件进行数据处理。计量资料以均数±标准差表示,两组间比较采用t检验,多组间的比较采用方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 细胞形态学观察原代培养24小时后可见贴壁细胞数量较少,细胞成集落样生长,部分细胞贴壁呈多角形或类圆形。5天以后,细胞成片生长并相互融合。见图1。
图1 BMSCs形态(×40) a:1天后;b:5天后
2.2 细胞表型鉴定流式细胞仪检测结果显示原代培养的P3代比格犬BMSCs表面抗原表达CD29(+)(84.33%),CD44(+)(57.11%),CD34(-)(2.87%),CD45(-)(0.96%),见图2。
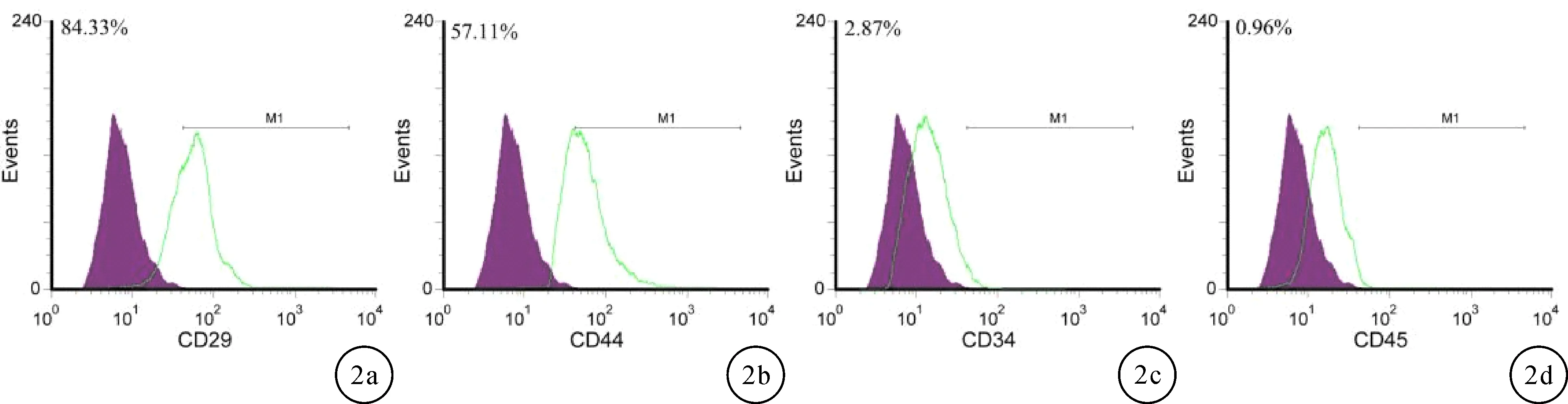
图2 比格犬BMSCs表面标记流式鉴定图 a:CD29抗原;b:CD44抗原;c:CD34抗原;d:CD45抗原
2.3 成骨成脂诱导染色成骨诱导20 d后,显微镜下观察,可见诱导组的贴壁细胞形成网状结构,生长密集,局部细胞放射状聚集成团,形成多个大小不等的圆形矿化结节。茜素红染色后,见矿化结节呈红色,不透明,部分矿化结节之间相互融合成片。成脂诱导10 d后便可发现部分细胞变得肥大且胞浆内出现脂滴,为折光度较强的圆形小泡。14 d时,大部分细胞变形,内含脂滴。油红O染色可见,脂滴红染。见图3。

图3 BMSCs成骨成脂诱导染色结果(×100) a:茜素红染色;b:油红O染色
2.4 不同浓度SDF-1和bFGF分别对BMSC的增殖作用bFGF在20、50、100 ng/ml时对BMSCs均有促进作用,在50 ng/ml时,达到峰值,在100 ng/ml时,对细胞增殖的促进作用降低。所以我们选择50 ng/ml作为最佳浓度。100、200、300 ng/ml的SDF-1对BMSCs均有促进作用,且200、300 ng/ml的效果更为显著,达一定浓度后,SDF-1浓度的增加对于细胞的增殖不具有显著效果。因此,选择200 ng/ml作为最佳浓度。见图4、图5。
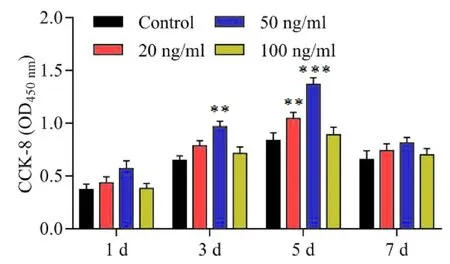
图4 不同浓度bFGF对BMSCs的增殖作用 *P < 0.5,**P < 0.01,***P < 0.001)

图5 不同浓度SDF-1对BMSCs的增殖作用 *P < 0.5,**P < 0.01,***P < 0.001)
2.5 最佳浓度时SDF-1和bFGF对BMSCs增殖作用在加入了最佳浓度SDF-1和bFGF的组别中,相对于空白对照组来说,细胞增殖明显,但是细胞的生长周期类似。见图6。

图6 SDF-1和bFGF最佳浓度时对BMSCs增殖作用
2.6 SDF-1和bFGF对目的基因表达的影响SDF-1和bFGF都可以显著增加Ⅰ型胶原的表达;而对于Ⅲ型胶原来说,bFGF对其的表达上升比SDF-1的作用更为明显;bFGF可以抑制ALP的表达,而SDF-1对ALP的表达没有影响;SDF-1和bFGF都可以增加S100A4的表达,但bFGF对其的影响更为显著;SDF-能够增加CXCR4的表达,但是bFGF对其没有作用。见图7。

图7 SDF-1和bFGF对目的基因表达的影响 a:Ⅰ型胶原;b:Ⅲ型胶原;c:S100A4;d:ALP;e:CXCR4 *P < 0.5,**P < 0.01,***P < 0.001)
3 讨论
牙齿再生是口腔科学中的研究热点,大量研究表明,牙周膜被破坏后极易丧失抗感染以及自我修复和更新的能力,这也是牙周膜再生异常困难的重要原因。近年来,牙周膜干细胞(PDLSCs)修复牙周缺损的作用已被证实[5],但距离真正的临床推广应用仍有一定差距,其主要原因是PDLSCs的获取相对困难,难以满足临床治疗需求;而BMSCs的获得相对更加便捷,培养方法也简单成熟。近年来,关于BMSCs的研究越发成熟,大量体内外实验表明[6,7],部分细胞因子可以通过影响BMSCs移植的微环境,进一步影响BMSCs的动员、迁移及分化。近期研究发现[8,9],通过局部直接注射、动静脉移植等途径植入同种异体或异种MSCs后,受者体内并未发生免疫排斥,这一结果提示BMSCs可能具有特殊的免疫学特征。
SDF-1是一类对细胞有趋化作用的小分子蛋白质,可促进细胞Ⅰ型胶原基因表达上调,刺激BMSCs的增殖。此外,Kim的团队利用SDF-1的趋化作用,在未植入种子细胞的小鼠牙槽窝内,植入了具有牙齿外形并复合SDF-1的生物材料,结果显示有类似牙齿的结构再生[10]。bFGF是一种应用广泛、功能多样的细胞因子,对细胞生长、增殖、分化等都有着重要的调节作用。目前大多数学者认为[11],bFGF作用于骨髓基质细胞分化增殖的早期,促进骨髓基质细胞分裂增殖,增加细胞数量,此外,bFGF能在提高BMSCs增殖速度和寿命的同时,保持其多分化潜能。本实验结果提示,在一定浓度内,SDF-1和bFGF浓度的增加有助于细胞的增殖,但到达一定浓度后,其浓度的增加对于细胞的增殖无显著效果,这一现象可能与受体减少或细胞转化通道的阻滞有关[12]。
一系列研究显示,存在的一些蛋白分子包括S100A4、以及Ⅲ型胶原等生物活性物质均具有抑制矿化的作用,可能参与维持牙周膜结构和功能的稳定[13]。CXCR4是SDF-1唯一作用的趋化受体,如果表达增加,那么SDF-1对该细胞的趋化作用增强。从结果看来,SDF-1和bFGF能够不同程度的刺激Ⅰ型胶原、Ⅲ型胶原和S100A4的表达。我们知道,Ⅰ型胶原是牙周膜纤维中最主要的成分之一,而Ⅲ型胶原与S100A4能阻止矿化基质的沉积,可能对维持正常牙周膜间隙不被矿化有一定的作用,因此体外实验可以证明BMSCs在SDF-1和bFGF的刺激下,可能朝着牙周膜纤维细胞方向分化并且使相关的抑制矿化的基因和蛋白表达增加,这就为我们下一步在体内实验中使用SDF-1和bFGF来促进BMSCs向牙周膜成纤维细胞分化、从而促进牙周再生提供了一个有力的支持和证据。综上所述,我们推测,SDF-1和bFGF将会对BMSCs介导的牙周膜组织再生工程产生积极作用,而对于两种因子作用下分子机制的研究还需要更深入细致的探讨。
