细菌M19降解黄曲霉毒素B1降解产物的毒性分析
2020-05-25王佳兴谢岩黎
王佳兴 谢岩黎 宋 娟
(河南工业大学 粮油食品学院1,郑州 450001) (河南省粮油食品安全检测与控制重点实验室2,郑州 450001)

1 材料与方法
1.1 材料与试剂
1.1.1 试剂及培养基配置
细胞培养液的配制:在90 mL培养基(RPMI 1640培养基)中加入10 mL胎牛血清,必要时加入1%的双抗(青链霉素混合液),配制成RPMI 1640完全培养基。
2-氨基芴、大鼠肝S9活化系统、二甲基亚砜(DMSO)、胎牛血清(FBS)、胰蛋白酶、RPMI-1640培养基、青链霉素混合液、磷酸盐缓冲液(PBS)、CCK-8细胞增殖-毒性检测试剂盒。
1.1.2 实验菌株及细胞
鼠伤寒沙门氏菌TA98,TA100:中国典型培养物保藏中心。
人肝癌细胞系HepG2,由中国科学院细胞库提供。
1.2 仪器与设备
BC-J二氧化碳细胞培养箱;LGT-10C真空冷冻干燥机;BM-37XB倒置显微镜; Infinite F50酶标仪;血球计数板。
1.3 实验方法
1.3.1 Ames实验1.3.1.1 实验菌株培养
将两个菌株分别接种于营养肉汤(按GB15193.4—2014配置)中,37 ℃摇床(100 r/min)培养10 h,培养过程中注意用锡纸包裹。
1.3.1.2 自发回变数的测定
向2 mL顶层培养基(融化状态)中加入菌液0.1 mL,迅速摇匀倒入底层培养基平板中,转动平板使平板表面平整均匀,37 ℃培养48 h,计数每个平板的菌落总数。
1.3.1.3 AFB1降解后的致突变性(Ames)实验
1)受试物的准备
将25μL AFB1标准溶液(浓度为100 μg/mL)与975 μL PADE在37 ℃,180 r/min暗处降解72 h,分别在降解0、1、2、3 d的时间点向反应体系中加入3 mL的二氯甲烷涡旋进行萃取,获得降解后的有机相受试物(二氯甲烷层)和水相受试物,有机相在氮气下吹干重新溶解在DMSO,使原AFB1的浓度分别为2.5、0.5、0.1 μg/mL;水相进行冷冻干燥,重新溶解在DMSO中,与有机相设置相同浓度稀释。将DMSO作为溶剂对照,0.1 mg/mL的氨基芴作为阳性对照,所有待检测溶液都要过滤除菌。
2)平板掺入法测定AFB1降解后的致突变性
与自发回变数的操作相同,只是加入菌液的同时加入0.1 mL的受试物溶液(将0.1 mL菌液与0.1 mL受试物溶液提前混合或者先向顶层培养基中加入受试物45 ℃水浴,再加入菌液),代谢活化组还需要加入0.5 mL大鼠肝S9活化溶液。
1.3.2 CCK-8法检测细胞增殖-毒性
AFB1的准备:分别配置1.0、2.5、5.0、10.0μg/mL的AFB1溶液,在氮气下吹干,用DMSO溶解,再添加RPMI-1640完全培养液,使DMSO的含量为1%。
降解后产物的准备:降解反应结束后(72 h),通过二氯甲烷萃取分别获得有机相和水相,有机相通过氮气吹干二氯甲烷,残留物用DMSO(1%)溶解,再用RPMI-1640完全培养液稀释,使原AFB1浓度分别为1.0、2.5、5.0、10.0 μg/mL;水相通过冷冻干燥去除水分,重新溶解在DMSO(1%)中,加入RPMI-1640完全培养液,配置相应浓度的待测物质。
将制备的细胞悬液以及不含细胞的完全培养液(100 μL/孔)加入96孔板,在培养箱培养过夜(待细胞贴壁生长状态良好),再将孔板取出加入10 μL不同浓度的待测物质,继续培养24 h,再向每孔中加入10 μL CCK-8溶液,在培养箱中孵育1~4 h,用酶标仪测定450 nm处的吸光度。设置空白孔(无细胞的培养液,不加药),对照孔(含细胞的培养液,1%DMSO的培养液),实验孔(含细胞的培养液,不同浓度的待测物质)。细胞存活率的计算:

2 结果与分析
2. 1 Ames实验结果
2.1.1 实验菌株生物学鉴定标准
对于生物学特性鉴定合格及自发回变菌落数在正常范围内(表1)的测试菌株可进行样品测试。平板掺入法的结果评价标准为[20-22],测试菌株TA98的回变菌落数等于或大于无处理对照组的2倍,其他测试菌株的回变菌落数等于或大于无处理对照组的2倍,并具有以下两种情况之一的可判定为阳性结果:1)有剂量-反应关系;2)某一测试点有可重复的阳性结果。

表1 实验菌株生物学鉴定标准
注:+表示阳性,-表示阴性。
2.1.2 自发回变数的测定
由表2可知,这两株菌的自发回变菌落数均在正常范围内。

表2 测试菌株的自发回变数
2.1.3 AFB1降解后的致突变性分析
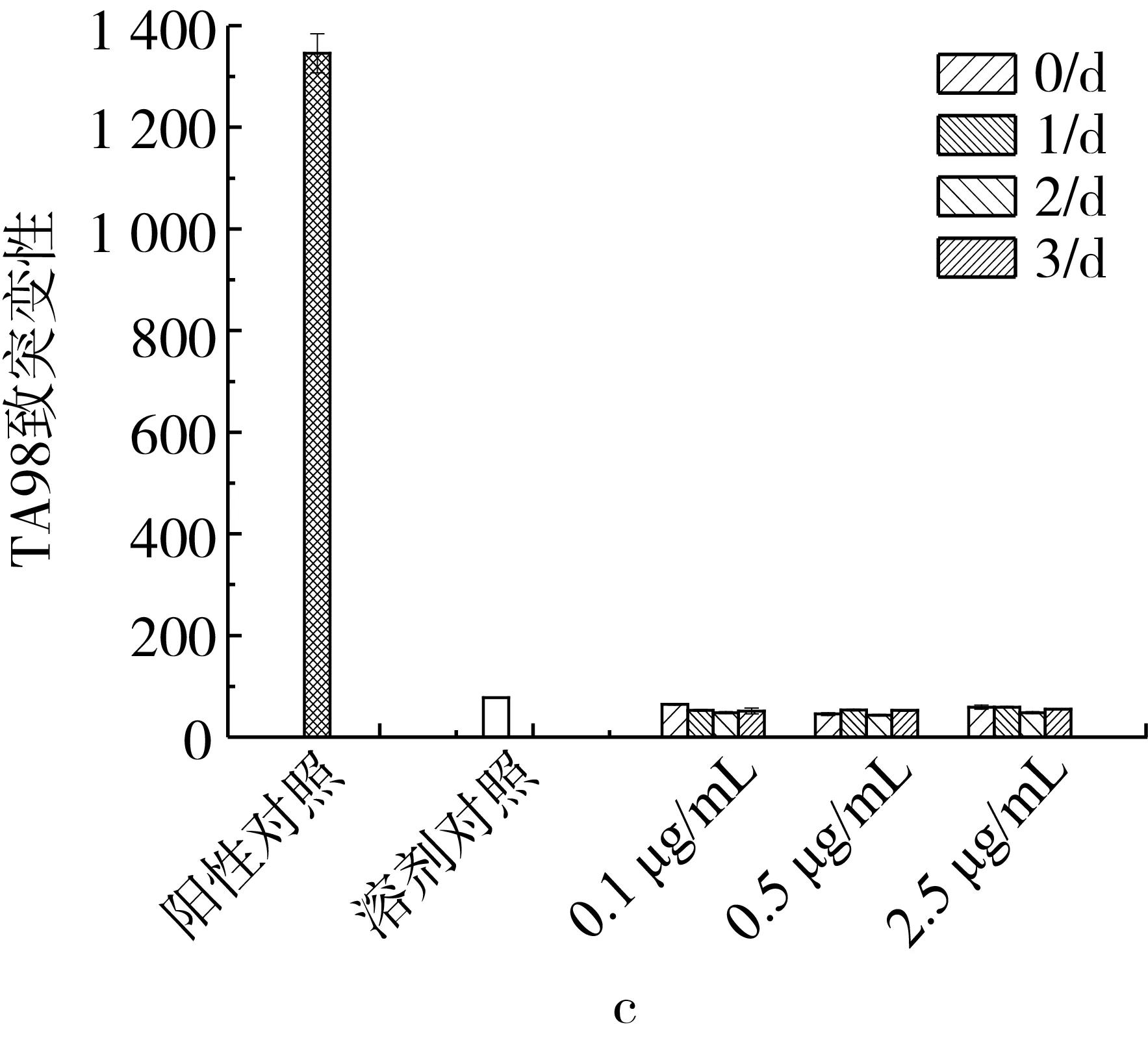
在未有代谢活化物激活受试物的情况下(图1),未降解组(降解0 d),有机相受试物测试,在2.5 μg/mL浓度时,TA98和TA100的回变菌落数较大(大于阳性对照组),且在0.1 μg/mL浓度下,TA98的回变菌落数与浓度呈比例关系;在降解1 d的情况下,有机相受试物测试,三个浓度下TA98和TA100的回变菌落数超过溶剂对照的2倍,但浓度与回变菌落数之间不存在比例关系,且与未降解组相比回变数明显减少;在降解2 d的情况下,有机相受试物测试,三个浓度下TA98和TA100的回变菌落数明显减少(与降解0 d和降解1 d的相比),浓度与回变菌落数之间无比例关系,TA98的回变菌落数远超过溶剂对照组的两倍,TA100的回变菌落数达到溶剂对照组的一倍多;在降解3 d的情况下,有机相受试物测试,TA98和TA100在三个浓度下的回变菌落数与溶剂对照组及自发回变相比,无很大差别。水相受试物测试中,整个过程三个浓度下TA98和TA100的回变菌落数与溶剂对照的无明显差别。




注:a、b分别为TA98和TA100在AFB1剂量分别在0.1、0.5、2.5 μg/mL情况下有机相受试物的致突变性;c、d分别为TA98和TA100在AFB1剂量分别在0.1、0.5、2.5 μg/mL情况下水相受试物的致突变性。图1 待测物致突变性检测结果(S9-)
结果显示,在降解0 d 时,有机相受试物为致突变阳性,且致突变性极强(较强的致癌性),在降解1 d到降解2 d时,AFB1已经降解一部分,总的来看还是呈现致突变阳性,在降解3 d时,呈现致突变阴性;在该实验条件下水相受试物对TA98和TA100无致突变作用。
在代谢活化物(S9)活化情况下(图2),所有测试组的回变菌落数与未代谢活化的相比普遍增多。未降解组(降解0 d),有机相受试物测试,TA98的回变菌落数在浓度0.1 μg/mL时呈相应的比例关系,TA100的回变菌落数大于阳性对照组并远远大于溶剂对照组;随着降解时间的延长,三个浓度下TA98和TA100的回变菌落数均呈下降趋势。在降解3 d的情况下,有机相呈现致突变阴性。水相受试物测试中,整个过程三个浓度下TA98和TA100的回变菌落数与溶剂对照的无明显差别。
结果显示,在降解0 d时,有机相受试物(AFB1)表现出强致突变作用;在降解1 d到降解2 d时,降解的量还很少,有机相受试物中还存在较多的AFB1,仍是表现出致突变阳性;在降解3 d的情况下,有机相呈现致突变阴性。在该实验条件下水相受试物对TA98和TA100均无致突变作用。
结果表明,AFB1经过降解后,其致突变性明显降低,降解3 d后,其降解产物已表现出致突变阴性结果。李文明[23]研究AFB1降解产物的致突变性,将反应体系经旋蒸干燥重新溶解,通过Ames实验的平板掺入法检测降解产物的致突变性,得到降解产物是低毒或无毒的结果,与本研究结果相似。Alberts等[24]和Rao等[25]均将有机相和水相进行了Ames实验检测,得到了相似的结论。


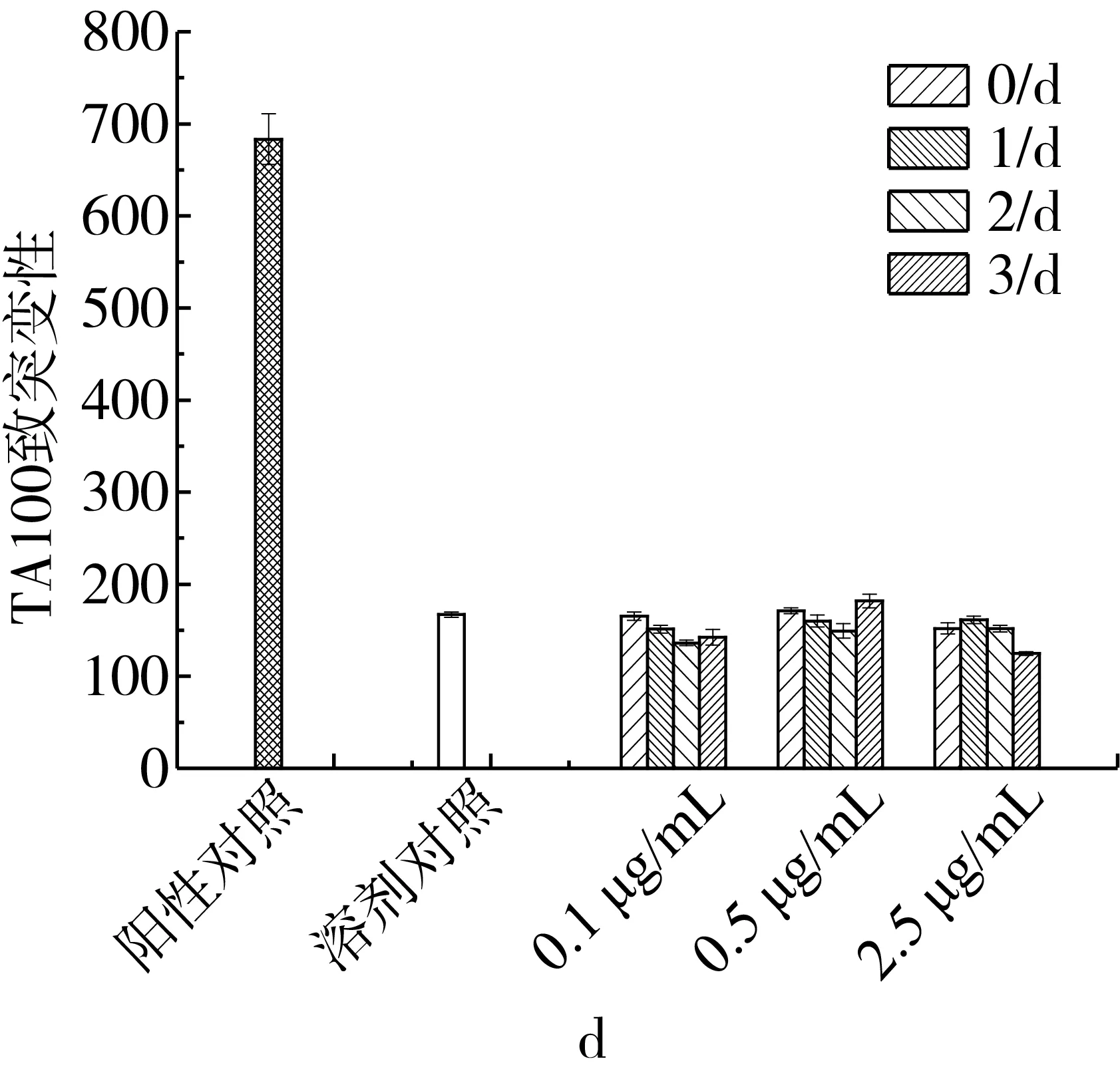
注:a、b分别为TA98和TA100在AFB1剂量分别在0.1、0.5、2.5 μg/mL情况下有机相受试物的致突变性;c、d分别为TA98和TA100在AFB1剂量分别在0.1、0.5、2.5 μg/mL情况下水相受试物的致突变性。图2 待测物致突变性检测结果(S9+)
2.2 细胞毒性实验
2.2.1 AFB1处理HepG2细胞后的细胞存活率
HepG2细胞在1.0、2.5、5.0、10.0 μg/mL的AFB1标准溶液作用24 h后,利用cck-8法检测细胞存活率。结果显示,以未经任何处理的细胞作为对照,AFB1作用24 h后的细胞活性随着 AFB1浓度的增加而呈下降趋势,2.5 μg/mL时细胞活性已低于72%,10.0 μg/mL时细胞活性已低于56%。
2.2.2 AFB1降解后的细胞毒性
在所测浓度范围内,降解后产物对HepG2细胞的抑制率均小于17%,降解后有机相的细胞毒性随着AFB1的浓度增加略有提高但无明显差异,初始浓度为2.5 μg/mL的AFB1经降解后,有机相降解液作用于细胞的存活率达到92%;初始浓度为10.0μg/mL的AFB1经降解后,有机相降解液作用于细胞的存活率达到83%,降解后水相对HepG2的细胞存活率均在91%以上。数据分析,降解后的细胞毒性与降解前相比明显降低,只有微量毒性,这与Liu等[26]研究结果相似。
2.2.3 不同浓度的AFB1及其降解物对HepG2细胞的影响
对照组(未处理)细胞呈多边形密度大。经过AFB1处理的细胞,数量明显减少,部分细胞形态发生显著改变,细胞褶皱,有些细胞死亡而不再紧密贴壁,有些细胞呈圆形,还有些细胞呈现半透明状态推测其即将凋亡(图3)。

图3 不同浓度AFB1处理下的HepG2细胞状态
不同浓度AFB1降解后作用于HepG2细胞后,细胞其数量稍有减少(倒置显微镜下观察)。图4为有机相降解液对HepG2细胞生长状态的影响,整体上细胞浓度有所减少,有些细胞边界不清晰,折光性差。图5为水相降解液对HepG2细胞生长状态的影响,整体细胞状态比有机相降解液处理的细胞状态稍好,细胞形态稍有改变,折光性稍差。在5.0 μg/mL的浓度下,细胞有些稀少;在10.0 μg/mL的浓度下,细胞密度大,可见对细胞的毒害较小,这与前人的研究结果相似[27]。

图4 不同浓度有机相降解液对HepG2细胞形态的影响

图5 不同浓度水相降解液对HepG2细胞形态的影响
3 结论
本研究对AFB1经PADE降解后的产物进行毒性分析,将降解后的产物分为有机相和水相,分别对有机相和水相进行Ames实验和细胞毒性实验分析。
1)Ames实验结果表明,AFB1经PADE降解后对鼠伤寒沙门氏菌TA98、TA100的致突变作用显著小于空白对照组(未降解的AFB1),甚至与自发突变无显著差异,降解3 d后,其降解产物已表现出致突变阴性结果。
2)细胞毒性实验表明,与未处理细胞组相比,经AFB1降解产物作用的细胞存活率均达到83%以上。AFB1经PADE降解后其细胞毒性明显降低(与AFB1相比),在低浓度AFB1经过降解的情况下,降解后无细胞毒性。
