超声-微波协同酶法制备芸豆抗性淀粉工艺优化及结构分析
2020-05-24刘淑婷王志辉张艳莉
刘淑婷 王 颖,2,3* 王志辉,2 王 迪 张艳莉
(1 黑龙江八一农垦大学食品学院 黑龙江大庆163319 2 国家杂粮工程技术研究中心 黑龙江大庆163319 3 黑龙江省农产品加工与质量安全重点实验室 黑龙江大庆163319)
抗性淀粉(Resistant starch,RS)又称抗酶解淀粉,是指在健康人体小肠中难以被消化降解,而在结肠中能被微生物菌群完全或部分利用,产生对人体有积极作用的一类淀粉[1-2]。抗性淀粉根据来源不同可分为5 种类型[3-4],其中RS3 型抗性淀粉因较强的抗酶解性而成为研究焦点。与可消化淀粉相比,抗性淀粉消化缓慢且能在体内发酵增加短链脂肪酸含量,具有降低餐后血糖,增加饱腹感,预防结肠癌,促进矿物质吸收等功效。
肖兵[5]和骞宇[6]等研究发现不同品种及不同类型的抗性淀粉发酵后产生的短链脂肪酸种类和含量存在显著性差异。Zhang 等[7]采用压热-酶解法制备玉米抗性淀粉;Lu 等[8]采用超声波-酶解法制备豌豆抗性淀粉;Mutlu[9]采用微波辐射法制备高直链玉米抗性淀粉,两种方法联用均可有效提高抗性淀粉得率。然而,目前传统方法多采用单一超声波处理或微波辐射法联合酶解法制备抗性淀粉,超声-微波协同方法较少,且原材料主要为高直链玉米淀粉、马铃薯淀粉、香蕉淀粉等,有关杂豆类抗性淀粉研究报道较少。作为我国出口量第一的芸豆,干芸豆粒中淀粉含量50%~60%,其中直链淀粉30%~40%,而较高的直链淀粉含量正是促进抗性淀粉形成的根本[10]。本研究以东北主产芸豆为原料,优化制备工艺条件,探究抗性淀粉结构特性,拓宽抗性淀粉来源,为抗性淀粉的综合开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
紫花芸豆,市售;普鲁兰酶(1 000 ASPU/g)、葡萄糖淀粉酶(100 000 U/mL)、耐高温α-淀粉酶(20 000 U/mL),上海源叶生物有限公司;直链淀粉(>99%)、支链淀粉,上海蓝季科技发展有限公司;盐酸、氢氧化钠等试剂均为分析纯级。
1.2 主要仪器
CW-200A 超声-微波协同反应仪,上海新拓分析仪器科技有限公司;A360 紫外分光光度计,上海翱艺仪器有限公司;Nicolet 6700 傅里叶变换红外光谱仪,美国Thermo Fisher 公司;GPC-50 常温凝胶色谱仪(配RI230 示差折光检测器),安捷伦科技有限公司;JSM-7800F 型扫描电镜,日本电子株式会社。
1.3 试验方法
1.3.1 芸豆抗性淀粉的制备
1)芸豆淀粉提取工艺流程 紫花芸豆→清洗、浸泡→去皮→干磨、过筛→芸豆粉→脱脂→碱液浸提(料液比1 ∶7 g/mL,NaOH 溶液0.2 g/100 mL)→反复离心(3 000 r/min,10 min)→收集沉淀(呈白色)→调节pH 值至中性→离心→烘干→粉碎、过筛→芸豆淀粉
2)抗性淀粉的制备 称取3.5 g 芸豆淀粉于锥形瓶中,配成质量分数20%的淀粉悬浮液。设置超声-微波协同反应仪温度40 ℃、微波功率300 W、处理20 min。调节pH=5.0,添加普鲁兰酶(9 ASPU/g 干基),在温度55 ℃恒温振荡酶解10 h,沸水浴灭酶10 min。121 ℃压热30 min,流水冷却至室温,4 ℃老化24 h。烘干老化淀粉(50 ℃,12 h),高速粉碎、过80 目筛,即得芸豆抗性淀粉。
1.3.2 单因素试验 以抗性淀粉得率为指标,考察淀粉悬浮液质量分数、超声-微波时间、普鲁兰酶添加量和微波功率对抗性淀粉得率的影响,考察的因素水平如表1所示。考察单因素时,固定其余反应条件:淀粉悬浮液质量分数20%、超声时间20 min、微波功率300 W、溶液pH 5.0、普鲁兰酶(9 ASPU/g 干基淀粉)、酶解10 h。
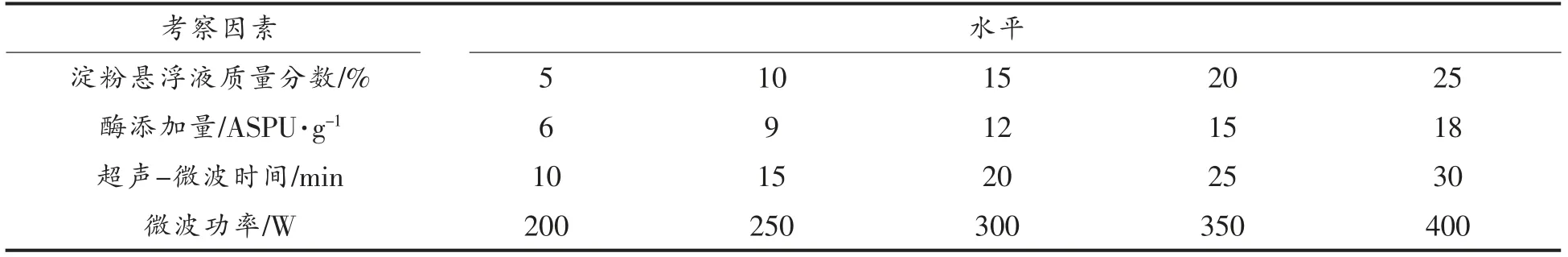
表1 单因素试验因素与水平Table1 The factor and level of single factor experiment
1.3.3 响应面法优化芸豆抗性淀粉制备工艺 结合响应面试验设计原理,筛选优化淀粉悬浮液质量分数、超声时间、普鲁兰酶添加量和微波功率工艺参数,以抗性淀粉得率Y 为响应值,设计Box-Behnken 中心组合试验确定最佳工艺条件,响应面因素水平设计如表2所示。

表2 响应面设计因素水平表Table2 The factor level table of response surface design
1.3.4 抗性淀粉得率测定 参照Goni[11]、宋洪波[12]的方法纯化抗性淀粉,并作适当改进。取纯化后的抗性淀粉1.0 g 加入5 mL KOH 溶液(2 mol/L),剧烈震荡溶解、沉淀;调节pH 值至4.0~4.5,加入过量的葡萄糖淀粉酶,60 ℃恒温震荡60 min,灭酶5 min,冷却,4 000 r/min 离心10 min,收集上清液,水洗沉淀并离心,反复3 次,合并上清液,用蒸馏水定容100 mL。
用DNS 法测定还原糖的含量,计算芸豆抗性淀粉得率:

式中:Y——抗性淀粉得率/%;M——还原糖含量/g;M1——淀粉干基质量/g。
1.3.5 颗粒形态扫描 取少量样品,均匀涂抹于导电胶上,固定在样品台上喷金处理,扫描电镜观察,拍摄不同放大倍数的样品颗粒形态显微照片,选择具有代表性照片分析研究[13]。
1.3.6 红外光谱扫描 称取干燥样品2.0 mg,磨细干燥的KBr 粉末200 mg,于研钵中充分研磨,混合均匀,压片,用傅里叶红外光谱仪全波段扫描,设置扫描范围4 000~400 cm-1,分辨率4 cm-1[14]。
1.3.7 碘吸收曲线及平均聚合度测定 称取样品20 mg,用无水乙醇润湿,吸取1 mL 氢氧化钾溶液(2 mol/mL)充分溶解样品。调节溶液pH 6.0~7.0,用去离子水定容50 mL。取10 mL 定容液与2 mL碘液混合,用去离子水定容100 mL。用紫外分光光度计于波长450~800 nm 范围扫描样液[15]。根据Banks[16]公式计算平均聚合度(DP):
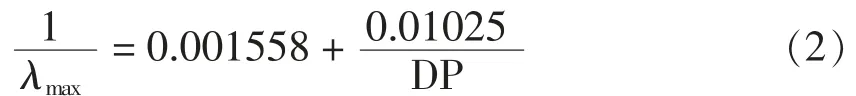
1.3.8 分子质量测定 参照吴小婷[17]和Naguleswaran 等[18]的方法,称取样品20 mg,用流动相做前处理。凝胶色谱仪操作条件:色谱柱型号:Waters Styragel(7.8 mm×300 mm);流动相:VDMSO∶V水相=1∶2,流速0.8 mL/min,柱温45 ℃,进样量10 μL。
1.3.9 数据处理与统计分析 用Design Expert 8.0.6 和SPSS 20 软件分析和处理数据,用Excel、Origin 软件绘制相关图表。
2 结果与分析
2.1 单因素试验结果分析
由图1a 可见,随着淀粉悬浮液质量分数的增加,抗性淀粉得率呈先增大后减小趋势。较低或较高的淀粉悬浮液质量分数均不利于抗性淀粉的形成,淀粉悬浮液质量分数较低时,淀粉分子分散在溶液中不易接触碰撞,分子间无法缔合形成稳定的双螺旋结构[19-20];淀粉悬浮液质量分数较高时,颗粒的聚集和凝沉导致淀粉在后续反应中无法充分糊化和酶解,阻碍了大分子链断裂形成短直链淀粉分子[21]。
由图1b 所示,固定微波功率300 W,延长超声时间,可提高抗性淀粉得率。延长超声时间,抗性淀粉得率未增加却略有减小,推测超声波加速溶液中聚合物分子间摩擦,降解淀粉分子,将长链分子切割成短直链淀粉分子,通过改变分子聚合度,间接影响抗性淀粉得率。
由图1c 所示,抗性淀粉得率随普鲁兰酶添加量的增加逐渐升高。推测淀粉颗粒糊化后吸水膨胀使结晶区氢键断裂,小分子淀粉溶出,酶直接作用于支链淀粉α-1,6-糖苷键,水解形成较多游离的直链淀粉分子,促进老化过程中分子重排。酶过量还可能促进淀粉分子过分水解,分子链聚合度太低而不易形成抗性淀粉。
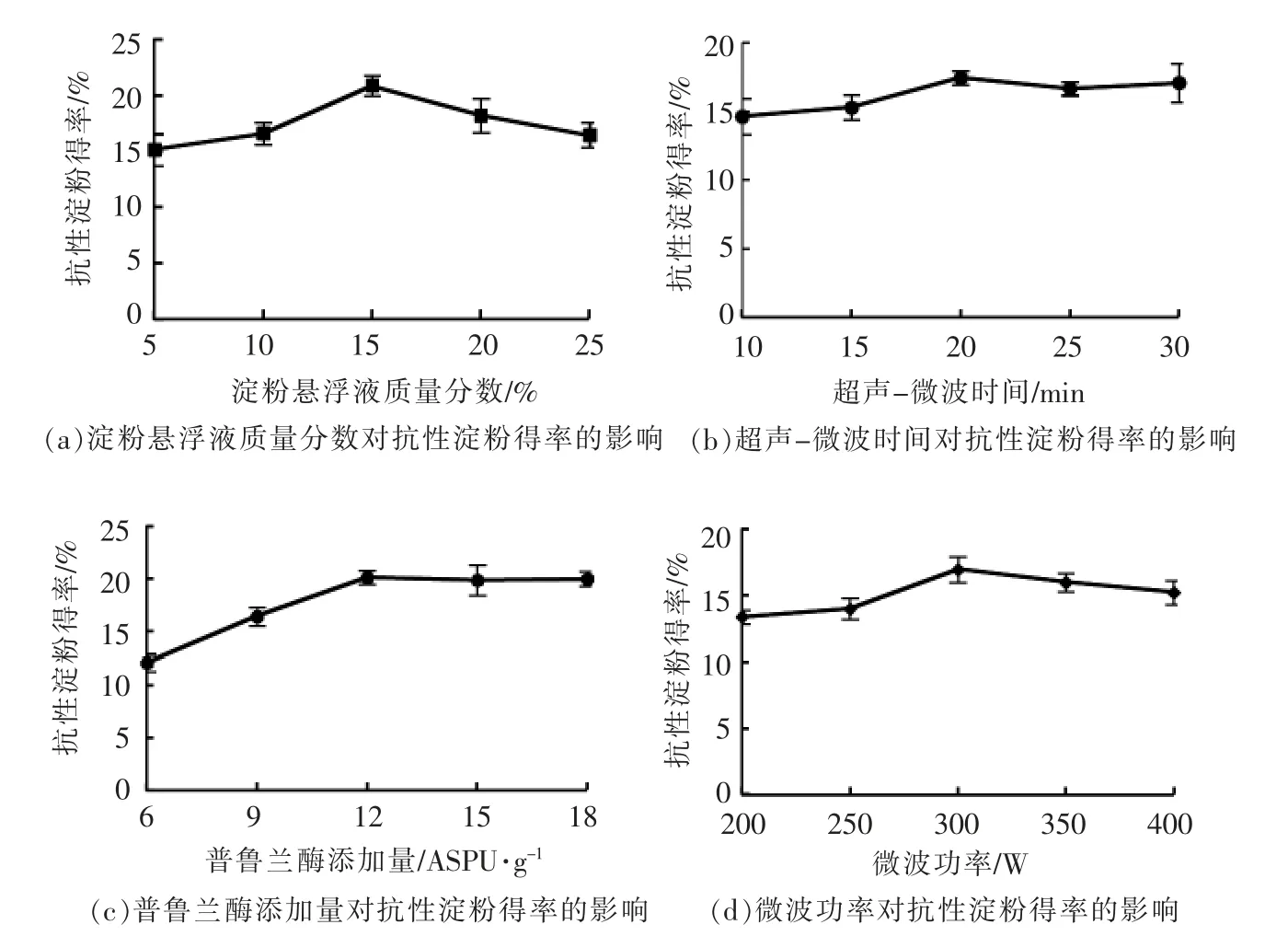
图1 单因素试验结果Fig.1 Results of single factor experiment
由图1d 所示,随着微波功率的增大,抗性淀粉的得率逐渐升高,然而过大的微波功率使抗性淀粉得率呈缓慢降低趋势,推测较高的微波功率使体系迅速升温,大量能量聚集在淀粉凝胶中,使其受热不均匀;淀粉颗粒在水分气化作用下吸水膨胀破裂,部分分子被过度降解,不利于重结晶形成抗性淀粉[22]。
2.2 响应面试验结果分析
2.2.1 响应面设计与分析 采用Design Expert 8.0.6 中Box-Behnken 中心组合试验设计超声-微波辅助酶解法制备芸豆抗性淀粉参数,试验设计及结果见表3。利用Design Expert 8.0.6 软件回归分析。
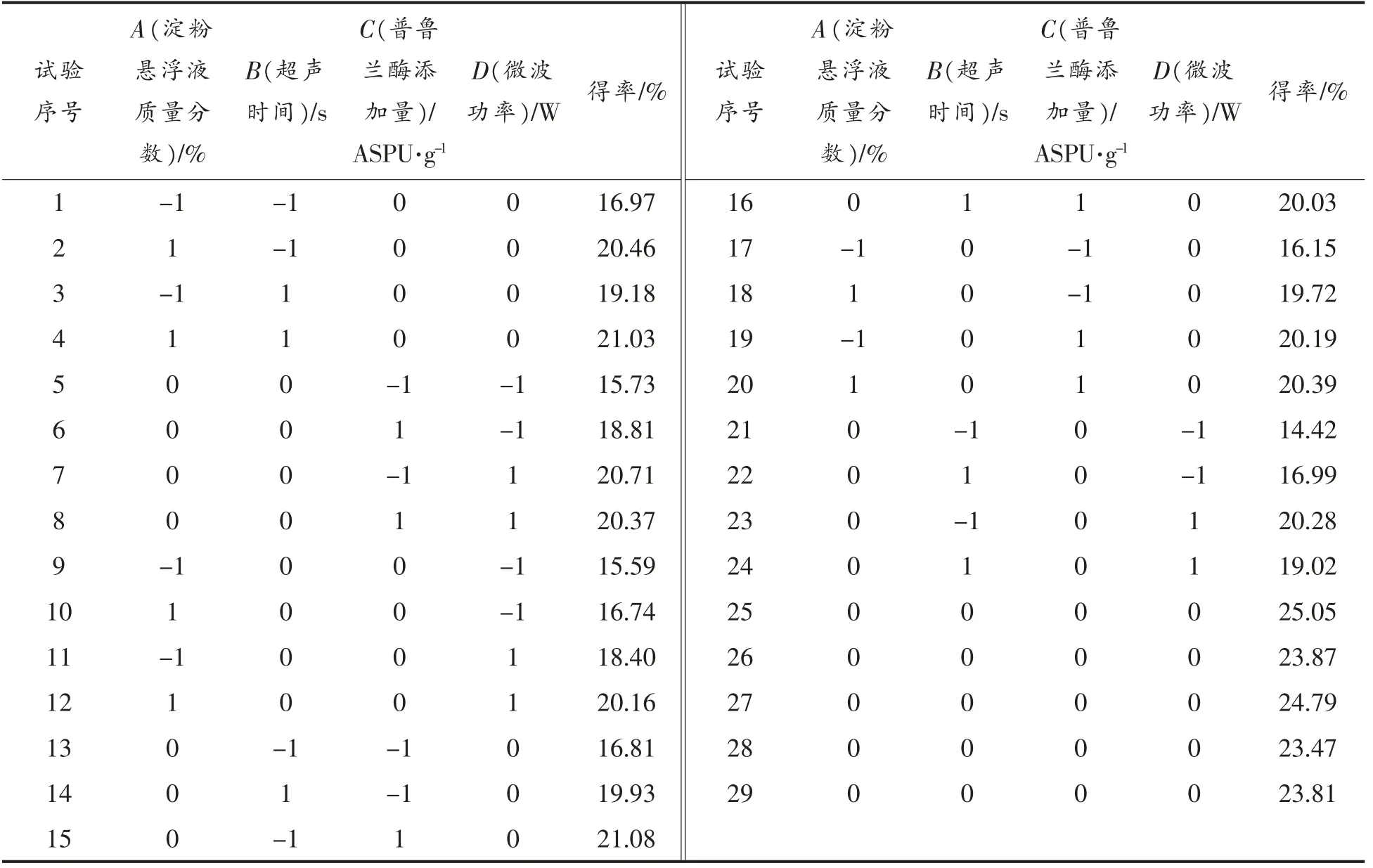
表3 Box-Behnken 试验设计及抗性淀粉得率Table3 Box-Behnken test design and the yield of resistant starch
根据二次回归方程的方差分析及显著性检验分析可知:模型P 值小于0.0001,回归方程模型达到极显著,失拟项不显著,回归方程模型成立,R2=97.10%,大于90%,表明方程模型与实际试验结果具有良好的拟合度和相关性,此模型可优化超声-微波辅助酶解法制备芸豆抗性淀粉的工艺,判断抗性淀粉得率。
回归方程模型中一次项、二次项均达到显著水平(P<0.05,P<0.01),表明A、B、C、D 4 个因素对抗性淀粉得率的线性效应、曲面效应显著。根据4 个因素对响应值影响程度得出其对抗性淀粉得率的影响顺序:微波功率>淀粉悬浮液质量分数>普鲁兰酶添加量>超声时间。二次多项回归模型如下:
Y = 24.2 + 1.0 A+0.51 B + 0.99 C+1.72 D -0.84 AC-1.04 BC-0.96 BD-0.85 CD-2.69 A2-2.54 B2-2.07 C2-3.66 D2
2.2.2 交互作用分析 由图2可知,各因素交互作用的等高线呈椭圆形,说明交互作用显著;响应曲面图开口向下,说明方程有极大值;图2c、2d 的等高线较图2a、2b 密集,表明BD、CD 交互作用对抗性淀粉得率影响更显著。经Design Expert 8.0.6软件确定超声-微波辅助酶解法制备紫花芸豆抗性淀粉的最佳工艺参数:淀粉悬浮液质量分数15.83%,超声时间20.08 min,普鲁兰酶添加量12.46 ASPU/g,微波功率310.94 W,此条件下芸豆抗性淀粉得率预测值为24.55%。考虑实际操作的可行性与准确性,确定最佳工艺参数为淀粉悬浮液质量分数16%,超声20 min,普鲁兰酶添加量12.5 ASPU/g,微波功率300 W。平行试验3 次,紫花芸豆抗性淀粉得率为(24.37±0.41)%,接近模型预测值,表明该回归模型能准确预测抗性淀粉得率。
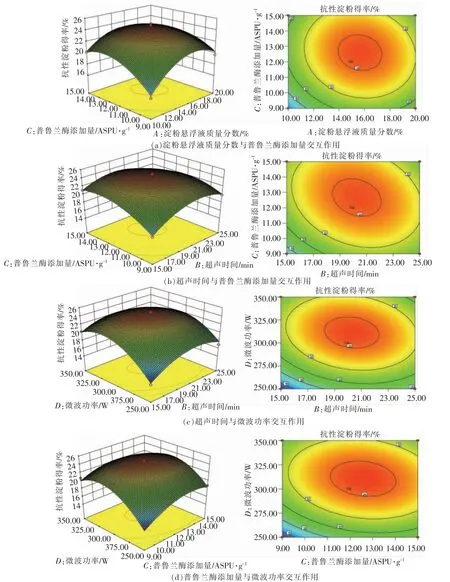
图2 各因素交互作用影响芸豆抗性淀粉得率的响应面及等高线图Fig.2 Response surface and contour plot of the interaction of various factors on the yield of cowpea resistant starch
2.3 颗粒形貌分析
用扫描电镜直接观察样品表面细微结构,通过电子束与样品间相互作用获取被测样品形貌特征,通过分析物质的颗粒形貌,说明物质的组成结构与内在性质间的关系。紫花芸豆淀粉及抗性淀粉颗粒形貌扫描图如图3所示。芸豆淀粉颗粒饱满完整,分布均匀,大小不一,呈肾形或不规则球形,部分呈圆形,表面光滑;紫花芸豆抗性淀粉颗粒呈不规则且棱角分明的多边形结构,质地紧密,表面粗糙,横断面呈片层状结构[23],推断超声波的高频率振动使淀粉溶液中的微小泡核重复生长、闭合,产生空化作用[24]。其紧密的片层状结构可能因微波辐射导热而使直链淀粉分子快速从原淀粉颗粒中溶出,结晶区吸水膨胀,后经脱支酶直接作用于α-1,6-糖苷键,使其断裂,形成适宜结合成双螺旋结构的短直链淀粉分子,淀粉分子在老化回生过程中凭借分子间氢键及范德华力重新形成有序的无规则稳定晶体结构。

图3 紫花芸豆淀粉及抗性淀粉颗粒形貌扫描图(500×)Fig.3 Scanning diagram of the morphology of purple kidney bean starch(a)and resistant starch(b)(500×)
2.4 红外光谱分析
芸豆淀粉及抗性淀粉的红外光谱扫描图如图4所示。芸豆淀粉及抗性淀粉谱线走势相同,均在2 929.35,1 648.33,930.00,859.07,766.3 cm-1处出现特征吸收峰,分别对应C-H 伸缩振动峰,C=O振动吸收峰以及指纹区的C-O,C-C 伸缩振动峰和C-H 面外弯曲振动吸收峰,说明抗性淀粉在制备过程中未生成新的官能团,只是原淀粉分子链的有序重排过程[25-26]。与原淀粉相比,芸豆抗性淀粉在1 019.70 cm-1处吸收峰较宽,此吸收峰于淀粉结晶区和无定型区之间,对应淀粉老化的特征吸收峰,推测是淀粉分子老化过程中氢键的缔合作用导致此吸收峰变宽。
2.5 碘吸收曲线及平均聚合度
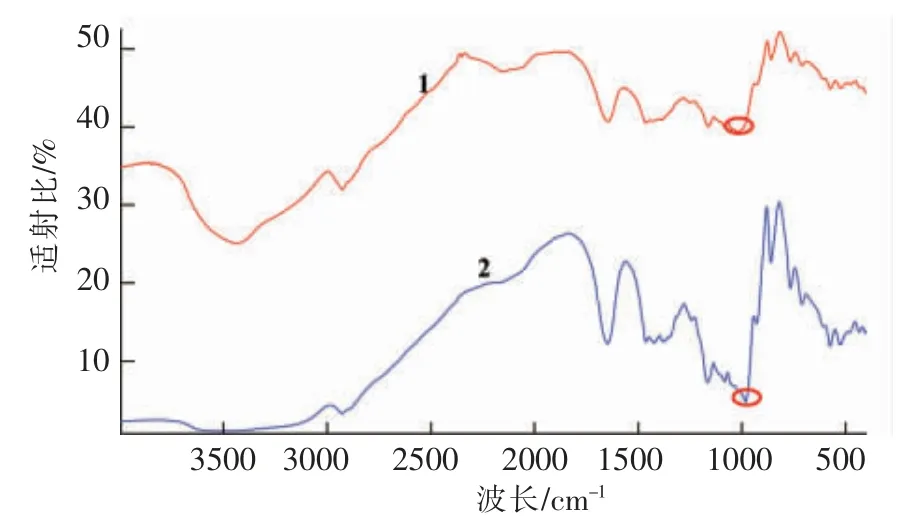
图4 芸豆淀粉及抗性淀粉红外光谱扫描图Fig.4 Infrared spectrum scan of different varieties of cowpea starch and resistant starch
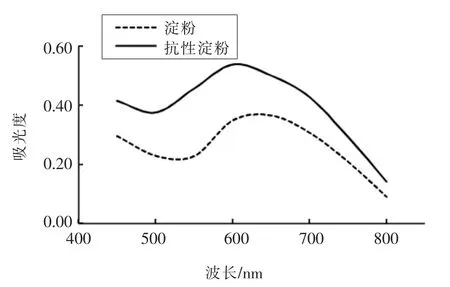
图5 芸豆淀粉及抗性淀粉碘吸收曲线Fig.5 Iodine absorption curve of kidney bean starch and resistant starch
淀粉与碘形成有色络合物,该络合物在特定波长范围内的最大吸收波长和吸收峰的变化直接关系淀粉分子链长和平均聚合度[27]。芸豆淀粉及抗性淀粉碘吸收曲线如图5所示。相同吸收波长处的抗性淀粉吸光度远大于芸豆淀粉,说明抗性淀粉中直链淀粉含量明显高于芸豆淀粉,这与张焕新的研究结果一致[28]。由表4可知,芸豆抗性淀粉的最大吸收波长和平均聚合度均显著低于原淀粉,推测较大的平均聚合度使淀粉分子间存在较强的排斥作用,在超声-微波的联合外力作用下淀粉分子震动摩擦增加分子间排斥力,使压热和酶解脱支处理更易将相互排斥的分子链切割断裂,增加短直链分子的数量和移动速度,利于淀粉分子在老化过程中重结晶形成稳定三维空间结构,降低分子聚合度,同时促进抗性淀粉形成。
2.6 分子质量分析
淀粉作为一种高分子聚合物,其理化性质与分子质量、分子质量分布密切相关,通常利用凝胶渗透色谱分离此类聚合物中不同体积和相对分子质量的分子[29],其中重均分子质量(Mw)和数均分子质量(Mn)分别决定聚合物中高分子质量部分和低分子质量部分;多分散系数(Mw/Mn)决定分子质量分布范围,分散系数值越接近1 表明物质组分越单一,分散系数值大于1 表明分子质量分布越宽[30]。芸豆淀粉及抗性淀粉分子质量如表5所示。芸豆抗性淀粉的Mw/Mn 低于原淀粉,说明制备抗性淀粉过程中体系组分单一化,分子质量分布更集中,符合2.5 节中抗性淀粉平均聚合度变小的结果。推断超声波的机械力及微波辐射的热能将体系中长支链淀粉分子降解为短支链组分,降低直、支链淀粉比例[31],导致分散系数降低,而压热酶解过程重新形成适合重结晶的直链淀粉长度,使直链淀粉分子在老化过程聚合,更易形成凝胶网状结构。

表4 芸豆淀粉及抗性淀粉平均聚合度Table4 Average polymerization degree of cowpea starch and resistant starch

表5 芸豆淀粉及抗性淀粉分子质量Table5 Molecular quality of kidney bean starch and resistant starch
3 结论
1)响应面试验优化得到超声-微波协同酶法制备芸豆抗性淀粉的最佳工艺条件:淀粉悬浮液质量分数16%、普鲁兰酶添加量12.5 ASPU/g、微波功率300 W、超声-微波处理20 min,此时抗性淀粉得率最高为(24.37±0.41)%。
2)超声-微波处理及酶解脱支作用破坏淀粉颗粒表面结构,在制备抗性淀粉过程中不产生新的官能团。
3)超声-微波处理及酶解脱支作用使抗性淀粉的平均聚合度降低;抗性淀粉的多分散性降低,使分子质量分布范围变窄。
