直链淀粉含量及淀粉平均聚合度对抗性淀粉含量影响的研究
2017-03-27朱哲刘良忠黄婷王幻王松树
朱哲+刘良忠+黄婷+王幻+王松树
摘要:直链淀粉含量与淀粉平均聚合度对抗性淀粉的形成有着重要的影响,以玉米淀粉、红薯淀粉、豌豆淀粉、绿豆淀粉为原料,采用普鲁兰酶和α-淀粉酶协同制备抗性淀粉,改变淀粉的直链淀粉含量和聚合度,分析淀粉直链淀粉含量及其聚合度与抗性淀粉含量的关系。结果表明,直链淀粉含量与抗性淀粉含量呈明显正相关,平均聚合度在一定范围内有利于提高抗性淀粉的含量。
关键词:直链淀粉含量;聚合度;抗性淀粉
中图分类号:TS236 文献标识码:A 文章编号:0439-8114(2017)02-0320-05
DOI:10.14088/j.cnki.issn0439-8114.2017.02.028
抗性淀粉(Resistant Starch,RS)又称抗酶解淀粉、难消化淀粉,在健康人体小肠内不能被消化吸收[1]。抗性淀粉具有与膳食纤维类似作用,可延缓餐后血糖上升[2],将有效控制糖尿病病情,RS在体内所产生的热量不及普通淀粉的十分之一,所以可认为RS在体内为低能甚至不产生能量[3],RS在大肠内的发酵产物主要是一些气体和短链脂肪酸,对预防结肠癌有着重要的意义[4]。抗性淀粉有5种类型[5]:RS1(物理包埋淀粉)、RS2(天然具有抗消化的抗性淀粉)、RS3(回生淀粉)、RS4(化学改性淀粉)、RS5(直链淀粉-脂质复合物)。其中,RS3是国内外研究的热点。工业上主要用压热处理方法制备抗性淀粉,通常是将淀粉悬浮液先加热到100 ℃以上,使淀粉充分糊化,让直链淀粉分子从内部释放出来,冷却到一定温度,维持足够长的时间,使直链淀粉回生,经酶消化水解支链淀粉和无定型区淀粉分子,得到抗性淀粉。因此,直链淀粉含量的多少直接影响抗性淀粉含量,通过脱支处理可以使支链淀粉脱支,相应增加直链淀粉含量,增加抗性淀粉含量[6,7]。Eerlingen等[8]研究了平均聚合度(DP)在40~610淀粉其抗性淀粉的含量,结果发现分子平均聚合度越小,抗性淀粉含量越低。聚合度也是淀粉分子形成抗性淀粉的重要参数。本试验以玉米淀粉、红薯淀粉、豌豆淀粉、绿豆淀粉为原料,采用普鲁兰酶与α-淀粉酶协同制备抗性淀粉,研究直链淀粉含量和淀粉平均聚合度对抗性淀粉含量的影响。
1 材料与方法
1.1 材料与试剂
玉米淀粉,湖北任森农业科技发展股份有限公司;红薯淀粉,山东宏河圣齐生物工程有限公司;豌豆淀粉,成都达恒毛实业有限公司;绿豆淀粉,衡水富桥淀粉有限公司;马铃薯直链淀粉标准样品,上海源叶生物科技有限公司;玉米支链淀粉标准样品,上海源叶生物科技有限公司;普鲁兰酶,江苏锐阳生物科技有限公司;液体葡萄糖淀粉酶,安琪酵母股份有限公司;液体耐高温α-淀粉酶,无锡赛德生物工程有限公司。
1.2 试验仪器与设备
AL204分析天平,上海右一仪器有限公司;扫描型紫外可见分光光度计,Thermo Fisher Evolution 220;DF-101S恒温加热磁力搅拌器,巩义市予华仪器有限责任公司;LD-5低速离心机,北京医用离心机厂;立式压力蒸汽灭菌锅,上海博讯实业有限公司;数显水浴恒温振荡器,常州博远实验分析仪器厂;雷磁PHS-3C PH计,上海精密科学仪器有限公司。
1.3 试验方法
1.3.1 样品直链淀粉含量测定方法 按照GB 15683-2008的方法进行测定和计算。
1.3.2 淀粉平均聚合度的测定 聚合度的测定为还原末端法[6,9]。样品经过85%的乙醇数次洗涤以除去可溶性糖,烘至恒重。称取0.200 g不同制备方法的淀粉样品,在2.00 mol/L的KOH溶液中溶解4 h直到全部溶解,加入少量蒸馏水,用1.00 mol/L的HCl中和至pH 6.0~7.0,后用蒸馏水定容至50 mL。取0.5 mL已配置好的溶液,DNS测定还原性末端的量(以葡萄糖的量表示)。按以下公式计算淀粉分子平均聚合度:
DP=■
式中,W为淀粉样品的质量(mg);1.1为淀粉换算成葡萄糖的系数,Gr为用DNS法则1 mL样品溶液的还原末端数量。
1.3.3 葡萄糖标准曲线的制作 采用3,5-二硝基水杨酸比色法[10]制作标准曲线。
1.3.4 抗性淀粉含量的测定 根据Goni法[11,12]测定抗性淀粉。称取1 g淀粉试样溶于20 mL、pH 6.5的磷酸缓冲液中。加入1 mL耐热α-淀粉酶溶液(20 U/mL),置于95 ℃水浴中振荡30 min,通过耐热α-淀粉酶溶液分解其中的可消化淀粉。用柠檬酸(1 mol/L)调节pH至4.0~4.5,再加入1 mL糖化酶(1 000 U/mL)。将样品进行水浴振荡,温度为60 ℃,时间为60 min,至可消化淀粉全部转化为葡萄糖。将得到的溶液置于3 000 r/min的离心机中进行离心,弃掉上清液。用水洗离心后的沉淀部分(重复两次),洗去其中的葡萄糖,抗性淀粉则全部沉淀。向沉淀中加入4 mol/L的KOH溶液5 mL,置于沸水浴中5 min,使得抗性淀粉全部溶解。再加入2 moL/L鹽酸10 mL中和样品中的KOH溶液,用缓冲液调节溶液pH至4.0~4.5。向样品中加入1 mL糖化酶,并在60 ℃水浴振荡60 min,这样就可以将抗性淀粉全部转化成葡萄糖。将所得样品定容至100 mL,然后采用DNS法[10]测定其中的还原糖含量,最后将数据乘以0.9就得到了抗性淀粉含量,并以此计算抗性淀粉得率:
Y=■×0.9×100%
式中,Y为抗性淀粉得率,M为样品质量;M0为还原糖质量。
1.3.5 抗性淀粉的制备工艺 称取一定量淀粉,加入蒸馏水调制成一定浓度的淀粉乳,密封于耐高温高压的烧杯中。将淀粉乳置于高压灭菌锅中,在一定温度下加热一段时间,使淀粉糊化。糊化结束后,在室温中放置,使其冷却至室温,再将样品放入4 ℃冰箱中冷藏24 h。取出回生的淀粉,80 ℃烘干12 h,用万能粉碎机粉碎,过80目筛,得到抗性淀粉。
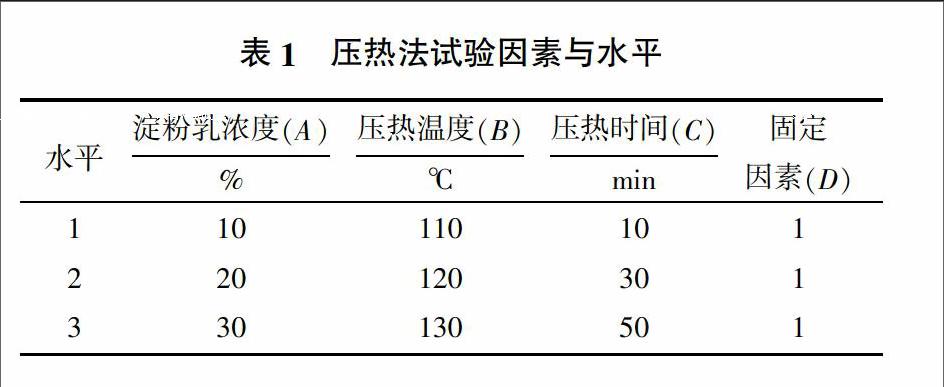
1.3.6 压热法条件的优化 参考文献[13],选取淀粉乳浓度、压热时间、压热温度对RS得率有较大影响的3个因素及其3个水平,采用L9(34)正交表进行正交试验,因素与水平见表1。
1.3.7 不同直链淀粉含量样品的制备及抗性淀粉制备 分别称取一定量的玉米淀粉、红薯淀粉、绿豆淀粉、豌豆淀粉4种淀粉调成淀粉乳,进行预糊化和高压糊化处理,迅速冷却至一定温度后加入适量普鲁兰酶,在55 ℃、pH 5.5条件下,4种淀粉样品分别脱支1、2、4、6、8 h,每组做3个平行试验。高温灭酶后冷却至室温,在4 ℃条件贮藏24 h,干燥过筛。检测样品的直链淀粉含量和抗性淀粉含量。
1.3.8 不同淀粉平均聚合度样品的制备及抗性淀粉制备 分别称取一定量的玉米淀粉、红薯淀粉、绿豆淀粉、豌豆淀粉4种淀粉调成淀粉乳,进行预糊化和高压糊化处理,每种淀粉分别添加0、2、4、6、8 mL的α-淀粉酶,在95 ℃、pH 6.0条件下,水解30 min,每组做3个平行试验。加酸停止水解,高温灭酶后冷却至室温,在4 ℃条件下贮藏24 h,干燥过筛。检测样品的平均聚合度和抗性淀粉含量。
2 结果与分析
2.1 直链淀粉含量标准曲线
直链淀粉含量标准曲线为y=0.004 5x+0.154 2,R2=0.999 7(图1)。
2.2 葡萄糖浓度标准曲线
葡萄糖浓度标准曲线为y=2.203 8x,R2=0.999 4(图2)。
2.3 压热法条件的优化及验证试验结果
由表2可知,影响压热条件的因素排序为A>B>C,即淀粉乳浓度对抗性淀粉影响最大,压热温度的影响次之,压热时间影响最小。试验最优组合为A2B2C2,即淀粉乳浓度为20%,压热温度为120 ℃,压热时间为30 min。在最优工艺参数条件下进行3次重复验证试验(表3),其淀粉含量为(8.30±0.02)%。
2.4 普鲁兰酶作用时间对直链淀粉形成的影响
由图3可知,普鲁兰酶酶解时间为6 h时,玉米淀粉、红薯淀粉含量达到最高;当普鲁兰酶脱支时间在0~6 h时,玉米、红薯直链淀粉含量随着酶解时间的增加而增加;当普鲁兰酶脱支时间在6~8 h时,玉米、红薯直链淀粉含量随着酶解时间的增加而减小。当普鲁兰酶脱支时间为4 h时,豌豆淀粉、绿豆淀粉含量达到最高;当普鲁兰酶脱支时间在0~4 h时,豌豆、绿豆直链淀粉含量随着酶解时间的增加而增加;当普鲁兰酶脱支时间在4~8 h时,豌豆、绿豆直链淀粉含量随着酶解时间的增加而减小。直链淀粉含量不随酶作用时间的增加而减小,是由于普鲁兰酶虽然不能无限制水解,最多能使表观直链淀粉含量达50%,但普鲁兰酶除了能水解支链淀粉分支中的α-1,6糖苷键,还能水解直链淀粉中的α-1,6糖苷鍵,到达最佳酶解时间后普鲁兰酶与淀粉已经作用充分,继续反应会导致淀粉水解过度生成短链或小分子,造成直链淀粉过短进而使直链淀粉的表观含量下降[14]。
2.5 直链淀粉含量对抗性淀粉形成的影响
利用不同的普鲁兰酶脱支时间分别处理玉米淀粉、红薯淀粉、豌豆淀粉、绿豆淀粉,制备不同直链淀粉含量的淀粉样品并制备抗性淀粉样品,直链淀粉含量与抗性淀粉含量关系如图4所示。经过普鲁兰酶作用后淀粉糊中直链分子含量极大地增加,直链淀粉含量对抗性淀粉的形成有显著的影响,随着直链淀粉含量的增大,抗性淀粉含量不断上升。分析其原因是淀粉糊中被打乱的分子链重新聚合、卷曲、折叠等形成新的晶体,其中直链分子凝沉更快,而且形成晶体也更牢固。在凝沉时分子链都是不断运动的,但每种分子链运动的速度不同,分子量大的支链分子运动的速度相对较慢而分子量小的直链分子则运动很快,直链分子碰撞在一起的几率较大,故直链分子回生速度比支链分子快,直链淀粉含量的增加促进了抗性淀粉的形成。
2.6 α-淀粉酶添加量对淀粉平均聚合度的影响
α-淀粉酶能够切断淀粉分子中的α-1,4糖苷键,从而切断淀粉分子链进而改变淀粉平均聚合度。由图5可知, 经过压热处理后随着α-淀粉酶用量的增加, 玉米淀粉、红薯淀粉、绿豆淀粉、豌豆淀粉4种淀粉的平均聚合度不断减小。
2.7 淀粉平均聚合度对抗性淀粉含量影响的研究
利用α-淀粉酶水解直链淀粉和支链淀粉中α-1,4糖苷键可以降低淀粉糊的黏度,进一步提高抗性淀粉含量。淀粉样品的平均聚合度主要受α-淀粉酶的影响,利用不同α-淀粉酶添加量分别酶解玉米淀粉、红薯淀粉、豌豆淀粉、绿豆淀粉4种不同淀粉,制备不同淀粉平均聚合度的淀粉样品和抗性淀粉,淀粉平均聚合度和抗性淀粉含量关系如图6所示。
由图6可知,随着加入α-淀粉酶水解,玉米淀粉平均聚合度从180降至92,抗性淀粉含量从14.21%升至17.12%;红薯淀粉平均聚合度从152降至95,抗性淀粉含量从15.11%升至20.35%;豌豆淀粉平均聚合度从170降至98,抗性淀粉含量从17.05%升至24.59%;绿豆淀粉平均聚合度从204降至114,抗性淀粉含量从15.98%升至22.61%。随着α-淀粉酶进一步增加,玉米淀粉平均聚合度从92降至32,抗性淀粉含量从17.12%降至12.87%;红薯淀粉平均聚合度从95降至34,抗性淀粉含量从20.35%降至13.91%;豌豆淀粉平均聚合度从98降至43,抗性淀粉含量从24.59%降至15.48%;绿豆淀粉平均聚合度从114降至41,抗性淀粉含量从22.61%降至14.21%。淀粉的平均聚合度对抗性淀粉含量影响较大。抗性淀粉的形成需要直链淀粉,因为直链淀粉可提供一定的三维结构空间。聚合度过小、直链淀粉分子太短、运动比较强烈、扩散速度较大较难聚集形成三维结构;而聚合度太大、直链淀粉过长、分子间的斥力较大也难聚集,所以只有中等长度才最有利于聚集。4种淀粉聚合度均在一定范围内抗性淀粉含量较高,所以控制淀粉平均聚合度在一定范围内,可有效地提高抗性淀粉含量。
3 小结与讨论
压热条件正交试验结果表明,影响压热条件的因素中淀粉乳浓度对抗性淀粉影响最大,压热温度的影响次之,压热时间影响最小。试验最优条件为淀粉乳浓度20%,压热温度120 ℃,压热时间30 min。
玉米淀粉、红薯淀粉、豌豆淀粉、绿豆淀粉4种淀粉为原料的试验呈现相同的规律。直链淀粉含量和淀粉平均聚合度对抗性淀粉的形成有显著影响,直链淀粉含量与抗性淀粉产率明显呈正相关,采用普鲁兰酶脱支处理增加淀粉直链淀粉含量有利于抗性淀粉的形成;采用α-淀粉酶处理淀粉,控制淀粉平均聚合度在一定范围内能大幅提高抗性淀粉的产率。
参考文献:
[1] GONZALEZ M C,MANAS E,GARCIAIZ L,et al.Resistant starch formation:Standardization of a high pressure autoclave process[J]. Agric Food Chem,1996,44:924-928.
[2] ASP N G.Preface:Resistant starch[J].European Journal of Clinical Nutrition,1992,46(2):1-3.
[3] 杨海军.功能性食品配料-水溶性膳食纤维[J].中国食物与营养,2003,13(9):29-31.
[4] 付 蕾,田计春.抗性淀粉的制备、生理功能和应用研究[J].中国粮油学报,2008,23(2):206-209.
[5] FUENTES Z E,SANCHEZ Z E,SENDRA E,et al.Resistant starch as prebiotic:A review[J].Starch Starke,2011,63:406-415.
[6] SANGLCK S,JACEON B,KWAN H P.Effect of partical acid hydrolysis and heat-moisture treatment on formation of resistant tuber starch[J].Cereal Chem,2004,81(2):194-198.
[7] BRUMOVSKY J O,THOMPOSN D. Production of boiling-stable granular resistant starch by partial acid hydrolysis and hydrothermal treatments of high-amylose maize starch[J].Cereal Chem,2001,78(6):680-689.
[8] EERLINGE R C,DECEUNINCK M,DELCOUR J A. Enzyme resistant starch II influence of amylase chain length on resistant starch formation[J].Cereal Chem,1993,70(3):345-350.
[9] 楊 光,丁霄霖.抗性淀粉分子量分布的研究[J].中国粮油学报,2000,15(5):37-40.
[10] 赵 凯,许鹏举,谷广烨,等.3,5-二硝基水杨酸比色法测定还原糖含量的研究[J].食品科学,2008,29(8):534-536.
[11] 李爱萍,唐书泽,张志森,等.大米抗性淀粉定量测定方法比较研究[J].食品工业科技,2006,27(1):195-197.
[12] GONI I,MANAS E, GARCIA D L,et al.Analysis of resistant starch:A method for food products[J].Food Chemistry,1996, 56(4):445-449.
[13] 李新华,崔静涛,钟 彦,等.玉米抗性淀粉制备工艺的优化研究[J].食品科学,2008,29(6):186-189.
[14] SAURA C F,GONI I,BRAVO L,et al. Resistant starch in food:Modified method for dietary fiber residues[J].Food Sci,1993,58(3):642-643.
