挤压和发酵对小米多肽ACE抑制活性及抗氧化作用的影响
2020-05-24侯殿志
侯殿志 陈 静 沈 群
(中国农业大学食品科学与营养工程学院 植物蛋白与谷物加工北京市重点实验室国家果蔬加工工程技术研究中心 北京100083)
高血压是心血管疾病(如冠心病和外周动脉疾病)发病的重要独立因子之一。目前,大约有6种药物应用于高血压的治疗,其中ACE 抑制剂是一种治疗高血压的主要药物。然而,这些药物在治疗高血压的同时,伴有较多的不良副作用,如味觉紊乱、皮疹和咳嗽等[1]。而食物来源的ACE 抑制多肽更加安全和柔和,这些寡肽有望成为人们日常饮食中一种新型的抗血压成分[2]。食源性多肽除降压作用外,往往伴随抗肿瘤、抗氧化、增强免疫等功能,具有较好的热、酸稳定性、水溶性等优点,可作为功能因子添加到食品中,具有广泛的前景[3]。
许多来源于植物和动物的蛋白质被证实存在ACE 抑制多肽,如玉米[4]、油菜籽[5]、沙丁鱼[6]和乳球蛋白[7]等。小米和玉米类似,主要贮藏蛋白为醇溶性蛋白,含有较多的疏水性氨基酸,且难溶于水,因此小米蛋白可能产生与玉米蛋白类似的降血压肽。挤压和发酵是食品加工过程中常用的技术,从原理来说,挤压是通过压力、温度和机械剪切的组合导致蛋白质的结构和性质发生变化,而发酵是利用微生物产生的酸和酶等作用。目前,这两种技术已用于大豆[8]、豌豆[9]、扁豆[10]和玉米[11]降血压肽的制备。对于小米来说,挤压和发酵不仅可以改造蛋白质的结构和性质,还可以降低抗营养因子含量[12-13]。
本试验以小米为原料,研究挤压和发酵处理对小米蛋白消化率的影响,同时对在胃蛋白酶-胰酶水解条件下得到的小米多肽的ACE 抑制活性和抗氧化能力进行分析,旨在为小米降压肽或相关功能性产品的开发提供理论依据。
1 材料与方法
1.1 材料
东方亮小米,山西东方物化农业科技有限责任公司。4 ℃贮藏,备用。
植物乳杆菌,中国农业大学食品科学与营养工程学院功能乳品实验室保藏菌种;酿酒酵母,中国农业大学食品科学与营养工程学院生物技术实验室保藏菌种。胃蛋白酶(≥250 U/mg)、胰酶(8×USP)、N-[3-(2-呋喃基)丙烯酰]-L-苯丙氨酰-甘氨酰-甘氨酸(FAPGG)、4-羟乙基哌嗪乙磺酸(HEPES)和2,2-二苯基-1-苦基肼(DPPH,2,2-diphenyl-1-picrylhydrazyl),Sigma-Aldrich 公 司;α-淀粉酶(1 048 U/mL),丹尼斯克公司。
1.2 仪器与设备
电子天平(AR5120),奥豪斯国际贸易(上海)有限公司;分析天平(ACCULAB ALC-110.4),德国Sartorius 公司;pH 计(FE20),瑞士梅特勒-托利多公司;紫外分光光度计(UV-2102C),尤尼柯(上海)仪器有限公司;凯氏定氮仪(KDY-9820),北京通润源机电技术有限责任公司;电导率仪(FE30),瑞士梅特勒-托利多公司;双螺杆挤压(SLG30-IV),中国济南赛百诺科技开发有限公司;恒温磁力搅拌器(HWCL-5),中国郑州长城仪器有限公司;高速万能粉碎机(JP-300B),浙江省永康市久品工贸有限公司;水浴恒温振荡器(SHA-BA),金坛荣华仪器制造有限公司;真空冷冻干燥机(LGJ-25C),北京四环科学仪器有限公司;电磁炉(EC21-21T03),广东美的生活电器制造有限公司;灭菌锅(LS-B35L),北京美科美生物技术开发有限公司。
1.3 方法
1.3.1 植物乳杆菌和酿酒酵母发酵过程中pH 值和菌落总数的测定 将扩大培养14 h 的酿酒酵母和植物乳杆菌培养液分别4 ℃、4 000×g 离心5 min,弃上清液,收集菌体,在沉淀中加入适量无菌生理盐水(0.85% NaCl),洗涤并离心,再弃上清液,重复两次,最后在收集的菌体沉淀中加入10 mL 灭菌生理盐水,振荡混匀后作为种子菌液。取1 mL 菌悬液接种于100 mL 米浆中(米、水质量比1∶10),于30 ℃培养24 h,每隔4 h 取样测定pH和菌落总数。
1.3.2 挤压小米粉和植物乳杆菌发酵小米粉的制备
1)挤压小米粉 将小米粉水分含量调节至16%;挤压腔中4 个区温度分别为:Ⅰ区温度60℃,Ⅱ区温度90 ℃,Ⅲ区温度120 ℃,Ⅳ区温度175 ℃,螺杆转速280 r/min。
2)植物乳杆菌发酵小米粉 取1 mL 植物乳杆菌悬液接种于100 mL 米浆中(米、水质量比为1∶10),于30 ℃恒温恒湿培养箱中培养24 h,然后将样品冻干,保存。
1.3.3 脱脂小米及小米粗蛋白的制备
1)脱脂小米的制备 将小米粉碎,按1 ∶5(m/V)加入正己烷,在室温下脱脂24 h。若未脱除干净,则可加入未用过的正己烷继续脱脂。
2)小米粗蛋白的制备 将脱脂小米粉与去离子水按1∶5(m/V)在搅拌器上混合均匀。沸水浴糊化10 min,冷却后,加入α-淀粉酶(30 U/g 底物),50 ℃恒温水浴中保持2 h,然后将样品取出,沸水浴20 min 灭酶。将样品液10 000×g 离心15 min,去上清液,沉淀冻干、粉碎、过80 目筛,得到小米粗蛋白样品。
1.3.4 小米蛋白消化率的测定 小米蛋白消化率的测定采用文献[14]方法,并稍作调整。
将脱脂小米粉与去离子水按1 ∶5(m/V)在磁力搅拌器上混合均匀,沸水浴糊化10 min,冷却后加入α-淀粉酶(30 U/g 底物),50 ℃恒温水浴中保持2 h。然后,将样品取出,沸水浴20 min 灭酶。当样品冷却至37 ℃时,用2 mol/L HCl 调节pH 值为2.0。在水解过程中,用pH 计监控pH 值变化,并随时调节,然后,恒温搅拌,转速为180 r/min。当样品溶液温度达到37 ℃时,按E/S 4∶100 加入胃蛋白酶溶液(用0.1 mol/L HCl 溶液配制),水解2 h,然后,用2 mol/L NaOH 调节pH 值为8.0,按E/S 4∶100 加入胰蛋白酶溶液(用pH7.5 的0.1 mol/L 磷酸缓冲液配制),水解2 h。在胃蛋白酶和胰酶消化10,30,60,90 min 和120 min 后,加入三氯乙酸(TCA)灭酶。将样品液8 000×g 离心20 min,冻干。
体外消化率采用三氯乙酸-氮溶指数(TCANSI)法测定和计算。取5 mL 的不同消化液于5 mL 10% TCA 中,4 000×g 离心20 min,得到TCA不溶组分。TCA 不溶性氮含量采用凯氏定氮法测定。消化过程氮释放量计算公式:

式中:N0——蛋白样品中的TCA 不溶性氮含量(mg);Nt——消化t min 时的TCA 不溶性氮含量(mg)。
1.3.5 小米蛋白水解肽的制备 称取适量小米蛋白样品,按5%加入去离子水,混合均匀,使用胃蛋白酶-胰酶水解小米蛋白。胃蛋白酶-胰酶水解过程中,先利用胃蛋白酶水解2 h 后,再用胰酶水解2 h。水解后,沸水浴10 min 灭酶,将样品液8 000×g 离心20 min,冻干。
1.3.6 血管紧张素转化酶(ACE)抑制活性的测定[15]采用96 孔酶标仪测定小米多肽的ACE 抑制活性。以FAPGG 作为ACE 的底物,按照表1添加各个反应的组分。将40 μL 样品和HEPES 缓冲液(80 mmol/L,pH 8.3)加入96 孔板中,然后加入10 μL 0.1 U/mL ACE 溶液混合,最后加入50 μL FAPGG 溶液,在37 ℃条件保温5 min,在波长340 nm 处测定吸光值。继续保温反应至30 min,再次测定吸光值。
以单位时间内吸光值变化表示ACE 酶活力,抑制剂对ACE 酶的抑制程度为ACE 抑制活性I(%):
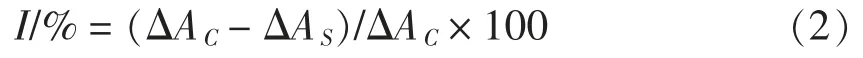
式中:ΔAC——空白组吸光值在30 min 内的变化;ΔAS——样品组吸光值在30 min 内的变化。
IC50值是抑制50%的ACE 活性时,抑制剂的浓度。样品中多肽浓度采用福林-酚法测定[16]。
1.3.7 抗氧化能力测定 DPPH 自由基清除能力和铁离子还原能力分别采用De[17]和Benzie[18]的方法测定。
1.3.8 数据处理 采用Microsoft Excel 2016 和SPSS 22.0 统计软件对数据进行处理和分析。每个试验均重复3 次。图中不同字母表示差异在0.05水平显著。

表1 ACE 抑制活性的测定方法Table1 Measuring method of the inhibitory activity of ACE
2 结果与分析
2.1 植物乳杆菌和酿酒酵母发酵过程中pH 值和菌落总数的变化
植物乳杆菌(Lactobacillus plantarum)和酿酒酵母(Saccharomyces cerevisiae)是食品工业中常用的发酵菌种。小米粉经乳酸杆菌和酿酒酵母发酵,可有效改善小米中植酸含量、氨基酸组成等[19]。对植物乳杆菌和酿酒酵母在小米粉发酵过程中pH 值和菌落总数的变化情况进行检测,结果见图1。
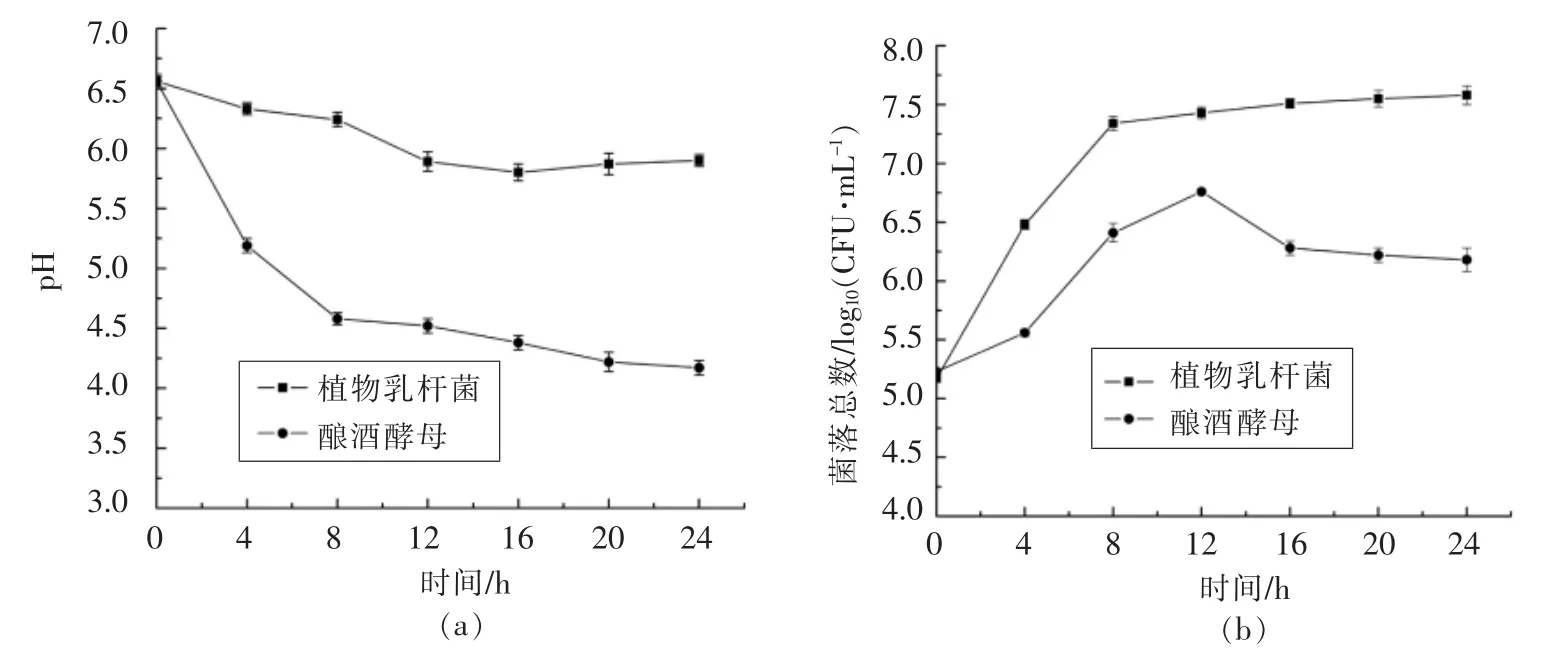
图1 小米发酵过程中植物乳杆菌和酿酒酵母的(a)pH 和(b)菌落总数的变化Fig.1 Changes in pH(a)and total number of bacteria(b)of Lactobacillus plantarum and Saccharomyces cerevisiae during the fermentation process of foxtail millet
从图1a 可以看出,随着发酵时间的延长,副产物的不断积累,植物乳杆菌和酿酒酵母发酵液的pH 值均呈下降趋势。酿酒酵母在发酵12 h(pH 5.89)后,其pH 值基本稳定;而植物乳杆菌发酵液的pH 值却一直呈下降趋势,其原因是植物乳杆菌属于乳酸菌属,发酵过程中乳酸产生量不断增加,进而pH 值不断降低,这也说明植物乳杆菌在进行新陈代谢。同样,对比两种菌体在小米发酵中的菌落总数变化(图1b),自发酵开始,24 h 内植物乳杆菌在小米基质中的菌落总数始终高于酿酒酵母。12 h 时酿酒酵母的菌落总数达到最大值(5.75×106CFU/mL),之后菌体生长进入衰退期,发酵基本趋于结束。然而,植物乳杆菌却没有因pH 值的持续下降而出现衰退的现象,在12 h 菌落总数达到2.70×107CFU/mL 后,趋于稳定。从以上数据可以看出,植物乳杆菌在小米基质中的生长优于酿酒酵母,这说明经植物乳杆菌发酵处理的小米粉的蛋白质可能被分解为易于人体吸收的水解多肽。根据以上结果,后续试验选用植物乳杆菌发酵小米粉。
2.2 小米蛋白消化率
蛋白消化率是评价谷物营养价值的重要指标,通常采用建立胃蛋白酶-胰酶体外模拟消化法对谷物在胃和小肠中的消化情况进行评价[20]。高消化率的蛋白质能够提供更多的游离氨基酸和小肽给人体吸收。小米中含有抗营养因子[12]、蛋白质的二硫键以及强烈的疏水特性[21],使得其具有较低的蛋白质消化率。合理的加工方式可改善对小米蛋白的消化率。图2显示原粉经挤压和发酵处理,其蛋白消化率变化情况。
由图2可知,从整体上看,在240 min 的蛋白消化过程中,经挤压和发酵处理的小米蛋白的消化率上升趋势基本高于原粉,说明挤压和发酵均能不同程度地提高小米蛋白的消化率。相比发酵,挤压对小米蛋白消化率的影响较大。经120 min胃蛋白酶模拟消化后,原粉、植物乳杆菌发酵粉和挤压粉的蛋白消化率分别达到17.60%,21.85%和46.00%,再经120 min 的胰酶模拟消化后,其消化率分别上升至30.03%,35.78%和53.11%。对比240 min 时的原粉消化率,挤压和发酵对小米蛋白消化率的提升率分别达到16.07%和76.86%。
挤压和发酵对小米蛋白消化率的作用效果有差异,可能是由于挤压的高温短时剪切和摩擦作用处理,导致蛋白质变性,蛋白酶作用位点暴露,提高蛋白质消化率[22]。赵学伟等[23]通过对挤压条件的优化研究,发现在试验范围内小米-豆粕复合挤压后蛋白体外消化率不同程度地提高。而对于植物乳杆菌,在对谷物发酵过程中,基质pH 值的下降可激活谷物内源性蛋白酶,使大分子蛋白质解聚,同时产生的有机酸对蛋白进行部分水解,从而提高蛋白的消化率[24]。另外,刘思思等[21]对小米粉进行纯种发酵,发现植物乳杆菌发酵可以降低小米中影响蛋白消化率的抗营养因子——植酸的含量。然而,发酵的持续进行导致营养物质消耗殆尽,且微生物代谢产物等也会抑制植物乳杆菌的生长,造成菌活下降,随之蛋白水解及产酸能力下降,对蛋白质的作用能力有限。综上,挤压对小米蛋白消化率的提高能力更明显。
2.3 ACE 抑制活性分析
经胃蛋白酶-胰酶水解得到的小米原粉,挤压粉和植物乳杆菌发酵粉多肽都具有一定的ACE抑制活性(图3)。
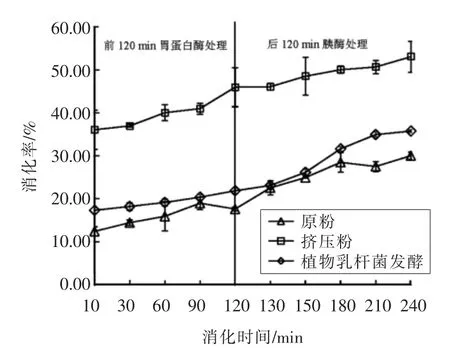
图2 小米原粉、挤压粉和植物乳杆菌发酵粉的蛋白体外消化率变化Fig.2 Changes in vitro protein digestibility of raw,Lactobacillus plantarum and extruded foxtail millet
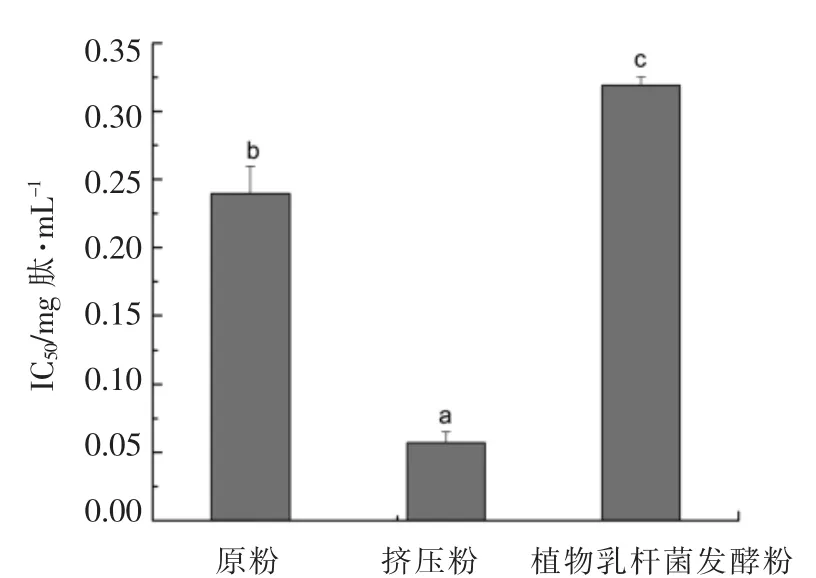
图3 小米原粉、挤压粉和植物乳杆菌发酵粉多肽ACE 抑制活性变化Fig.3 Changes in ACE inhibitory activity of peptide from raw,extruded and Lactobacillus plantarum fermented foxtail millet
从图3可以看出,经胃蛋白酶-胰酶水解得到的小米原粉,挤压粉和植物乳杆菌发酵粉多肽都具有一定的ACE 抑制活性。相比原粉,同样处理条件下,经挤压处理的小米多肽ACE 抑制活性显著提高(P<0.01),而经植物乳杆菌发酵导致小米多肽ACE 抑制活性显著降低(P<0.01)。原粉、挤压粉和植物乳杆菌发酵粉制备的多肽ACE 抑制活性之间存在显著性差异。小米挤压粉蛋白水解肽的IC50值最低(0.057 mg 肽/mL),即具有最强的ACE 抑制活性。
挤压作用使小米蛋白的消化率显著提高,说明对其的降解作用也更明显,进而ACE 抑制活性强。由于菌体特殊的微生物学特性,所以发酵过程可能造成小米蛋白复杂的生化变化,进而影响生物活性物质的生成及终产品的生理功能[25]。从试验结果可知,植物乳杆菌发酵对小米多肽ACE 抑制活性的作用效果较差。ACE 抑制肽活性的强、弱与其结构、分子质量分布等也有着紧密的联系[26],其内在机理还需研究。
2.4 抗氧化能力分析
小米蛋白经酶解释放出有特殊活性的肽段,其中抗氧化能力也是其重要活性之一。经胃蛋白酶-胰酶水解得到的小米原粉、挤压粉和植物乳杆菌发酵粉多肽的DPHH 自由基清除能力和铁离子还原能力变化情况如图4a 和4b 所示。
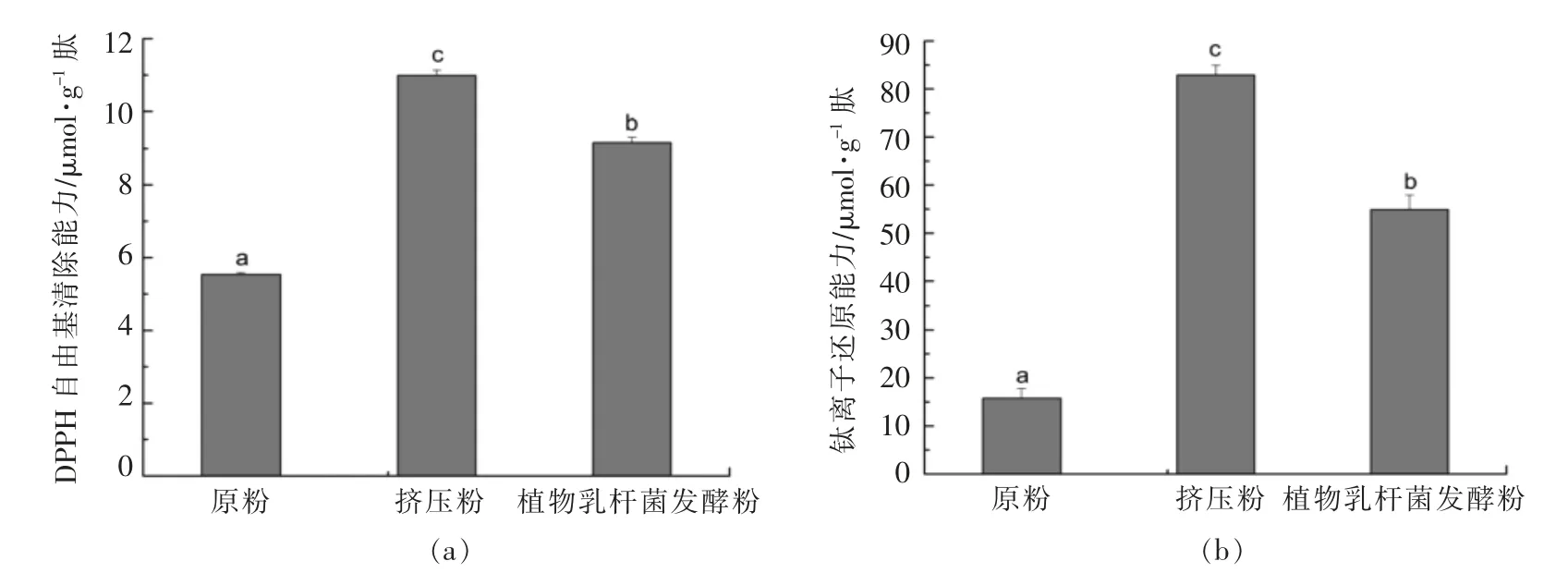
图4 小米原粉、挤压粉和发酵粉的DPPH 自由基清除能力(a)和铁离子还原能力变化(b)Fig.4 Changes in DPPH free radical scavenging ability(a)and ferric reducing ability of plasma(b)of peptides from millet raw powder,extruded powder and fermented powder
由图4a 和4b 可知,挤压粉和植物乳杆菌发酵粉多肽的DPPH 自由基清除能力(10.99 μmol/g肽)和铁离子还原力(82.92 μmol/g 肽)基本高于相应的原粉多肽。相比于原粉,挤压和发酵处理对小米多肽的抗氧化能力都有显著的提高(P<0.01),且各存在显著性差异。曹亚兰等[27]对大豆肽的抗氧化研究表明,挤压预处理可显著提高大豆肽的抗氧化活性。挤压可使蛋白质分子结构伸展、重组,表面电荷重新分布趋向均匀化,分子间氢键、二硫键等部分断裂,暴露出更多的酶切位点,提高了酶解敏感性[22],进而提高小米多肽的抗氧化能力。王宏兹等[28]研究发现,与紫薯原粉相比,经植物乳杆菌发酵的紫薯粉抗氧化能力显著提高。植物乳杆菌发酵使小米蛋白中氨基酸组成和含量发生变化,进而可能影响其抗氧化活性[19]。另外,多肽的抗氧化能力可能与其氨基酸组成和顺序有关[29]。
3 结论
小米粉经挤压和发酵处理后,其蛋白消化率均提高。比较而言,挤压对小米蛋白消化率的提高幅度更大一些。另外,同样处理条件下,与原粉相比,经胃蛋白酶-胰酶水解得到的挤压小米多肽能够显著提高ACE 抑制活性(P<0.01);经胃蛋白酶-胰酶水解得到的挤压和发酵小米多肽的DPPH 自由基清除能力和铁离子还原能力都显著提高(P<0.01)。由此可见,从挤压小米蛋白的胃蛋白酶-胰酶水解物中继续筛选高活性的ACE 抑制剂,是进一步研究小米功能的一条新途径。基于本试验研究结果,未来还将探讨更多的加工方式对小米多肽ACE 抑制活性和抗氧化能力的影响。
