TLR4单克隆抗体对过敏性紫癜小鼠损伤的保护作用及其机制*
2020-05-20朱松柏郑荣浩朱宏飞吴晓林
贵 琳,朱松柏,郑荣浩,舒 岚,朱宏飞,王 勇,吴晓林△
1湖北省妇幼保健院儿童肾病风湿免疫科,武汉 4300702湖北省中医药研究院,湖北省中医院麻醉科,武汉 4300613武汉大学动物实验中心,武汉 430071
过敏性紫癜,又被称为亨诺-许兰综合征(Henoch-Schonlein purpura,HSP),是以全身小血管炎症为主要病变的系统性血管炎,以皮肤出现青紫瘀斑为主要临床表现,随着病情发展可累及胃肠道、关节及肾脏等多个系统,严重威胁患者的身心健康[1]。此病好发于3~10岁的适龄儿童,有研究报道其发病率为0.14‰~0.22‰,且男性多于女性[2-3]。迄今,该病的病因及发病机制尚不完全清楚,可能涉及感染、药物、遗传以及饮食等多种诱发因素[4]。其中,免疫功能失衡可能为HSP的主要病理机制之一,主要是由自身免疫应答机制的紊乱所致,很多研究表明,在HSP患者体内的多项免疫指标均有显著变化[5]。
研究证明,Th17细胞可通过分泌IL-17等促炎症因子介导一系列炎症反应、自身免疫性疾病以及异体移植排斥反应的发生发展过程[6]。而以CD4+CD25+Treg为主的Treg细胞是一组具有免疫抑制功能的T细胞,对异体移植排斥和自身免疫性疾病等具有重要的调节作用[7]。在正常情况下,均来源于初始CD4+T细胞的Th17和Treg保持平衡状态;而在炎症反应或自身免疫性疾病发生时,以IL-6为主的促炎症因子异常表达会影响CD4+T细胞的分化格局,破坏Th17/Treg平衡,进而导致机体一系列损伤[8]。相关研究还显示,Toll样受体4(Toll like receptor 4,TLR4)在HSP患儿体内存在异常活化,尤其是累及肾损伤的患者,血清TLR4水平异常偏高,提示其可能通过调节免疫应答机制参与了HSP的发病过程[9]。本研究在以往研究的基础之上,建立HSP小鼠模型,并采用TLR4单克隆抗体进行治疗,从网状内皮系统(reticuloendothelial system,RES)功能、炎症因子水平和病理学变化等多角度进行探讨,研究其对HSP小鼠的保护作用以及相关机制,为HSP的临床免疫治疗奠定一定基础。
1 材料与方法
1.1 实验动物
本研究中的动物实验均符合国家相关法律和动物伦理学要求,所有实验在武汉大学动物实验中心完成。选取50只健康雄性C57BL/6小鼠(7~9周龄,体重20~25 g),饲养于以下条件:照明/黑暗周期为12/12 h(光照时间8:00~20:00),温度为(22±3)℃,湿度为(52±3)%,不限制摄食和饮水。
1.2 试剂及仪器
造模试剂:麦胶蛋白(Gliadin)购自东京化成工业株式会社,用时配制成含0.1%Gliadin、6 mmol/L HCl的酸化水;印度墨水购自北京西中化工厂。
治疗药物:兔抗小鼠TLR4 mAb(货号:MAB2759)及同型对照抗体兔IgG2A(货号:MAB006)购自R&D公司;阳性对照药物西咪替丁(国药准字H20058427)购自国药集团,用时以0.9%氯化钠注射液配制成0.1 g/mL溶液。
检测试剂:小鼠外周血单核细胞分离液试剂盒(货号E501094)购自上海生工公司;抗小鼠FITC-CD4抗体(货号:11-0042-82)、抗小鼠PE-IL-17抗体(货号:45-7177-82)及抗小鼠PE-CD25抗体(货号:12-0251-82)购自eBioscience公司;小鼠血清ELISA检测试剂盒:S-IgE(货号:MU30943)、IL-17(货号:MU30074)、IL-6(货号:MU30044)、IL-10(货号:MU30055)和TGF-β(货号:MU30574)均购自Bio-Swamp公司;RNA提取试剂盒、反转录试剂盒购自TaKaRa公司;SYBR Green染料购自Lumiprobe Corporation公司;BCA蛋白定量试剂盒(货号:A045-3)及全蛋白提取试剂盒(货号:W034)购自南京建成公司;兔抗鼠GAPDH抗体(货号:2118)购自CST公司;兔抗小鼠TLR4抗体(货号:19811-1-AP)、山羊抗兔IgG二抗(货号:10285-1-AP)购自武汉三鹰公司;兔抗小鼠IL-17抗体(货号:MAB421)购自R&D公司。
主要仪器:Real-time System荧光定量PCR仪(Bio-Rad,美国);酶标仪(Bio-Tek,美国);流式细胞仪(Beckman,美国)等。
1.3 小鼠HSP模型构建
将小鼠适应性饲养1周后开始实验。选取50只小鼠,随机分为5组:正常对照组、HSP模型组、同型对照组、TLR4 mAb组和西咪替丁阳性对照组,每组10只。参照赵志华等[10]的HSP动物造模法,正常对照组:灌胃小鼠6 mmol/L的HCl酸化水(不含Gliadin),灌胃量为0.5 mL/只,隔日灌胃1次,持续到14周末。其余4组:实验前3周以0.4 mg/10 g的量于尾静脉注射印度墨水,每周注射1次;持续3周后,灌胃0.1% Gliadin、6 mmol/L HCl酸化水,0.5 mL/只,隔日灌胃1次,持续至14周末。其中,在造模的最后3 d,将1 mg Gliadin加入到含5 mmol/L HCl酸化水的pH为7.4的磷酸盐缓冲液(PBS)中,给小鼠尾静脉注射0.2 mL/只,每天1次,连续3 d。14周末处理结束。
1.4 药物干预
模型构建成功后,对各治疗组小鼠进行对应药物干预,持续3周。同型对照组小鼠腹腔注射非特异性兔IgG2A,剂量为100 μg/(kg·d);TLR4 mAb组小鼠腹腔注射TLR4 mAb,剂量为100 μg/(kg·d);阳性药物对照组小鼠腹腔注射西咪替丁注射液,剂量为30 mg/(kg·d);而正常对照组和模型组小鼠均在腹腔注射等体积生理盐水(20 mL/kg)。药物干预处理3周后,取材检测。
1.5 尿蛋白含量检测
干预结束后,用代谢笼收集各组小鼠的24 h尿液,并通过尿蛋白试剂盒(CBB法)进行定量,尿蛋白的浓度(mg/L)=(测定A值-空白A值)/(标准A值-空白A值)×标准品的浓度(563 mg/L)。
1.6 小鼠RES功能检测
干预结束后,以印度墨汁小鼠碳粒廓清法[11]检测各组小鼠RES功能。实验操作步骤:将印度墨汁稀释10倍后,于小鼠尾静脉注射0.05 mL/10 g稀释后的印度墨汁,分别在注入2 min(t1)和12 min(t2)眼眶取血0.02 mL,将血溶入浓度为0.1% Na2CO3溶液中摇匀。以等量0.1% Na2CO3溶液为对照。在波长640 nm处检测两个时间点的吸光度值(A1和A2)。小鼠麻醉并称体重,采集静脉血液、皮肤及肾脏组织保存,并摘取肝脏、脾脏称重,计算吞噬指数K和吞噬系数α。其中K=(lgA1-lgA2)/(t2-t1);α=K1/3×体重/(肝重+脾重)。
1.7 小鼠外周血单核细胞的Th17和Treg细胞分选
采集各组小鼠新鲜外周血,按小鼠外周血单核细胞分离液试剂盒操作制备单核细胞悬液,后经流式细胞术检测外周血单核细胞悬液中CD4+IL-17+T细胞(Th17)及CD4+CD25+T细胞(Treg)分别占CD4+T细胞的百分比,并计算各组Th17/Treg细胞比值。
1.8 小鼠血清S-IgG、IL-17、IL-6、IL-10和TGF-β水平检测
将血液3000 r/min离心10 min后,取血清;采用ELISA检测试剂盒分别检测各组小鼠血清中S-IgE含量以及炎症细胞因子IL-17、IL-6、IL-10和TGF-β的水平。
1.9 小鼠皮肤和肾脏中RORγt及Foxp3在mRNA水平上的检测
根据NCBI上公布的小鼠视黄酸相关性孤儿受体(retinoic acid associated orphan receptor γt,RORγt)、叉头样转录因子3(forkhead helix transcription factor 3,Foxp3)基因及内参基因GAPDH序列分别设计qRT-PCR引物:RORγt 上游5′-C-GCGGAGCAGACACACTT-3′,下游5′-CTGGACCTCTGTTTTGG-3′;Foxp3上游5′-GCTGCCTACAGTCCCCTA-3′,下游5′-TTTGCCAGCAGTGGGTA-3′;GAPDH上游5′-GTCGTACCACAGGCATTG-3′,下游5′-CAATGCCTGGGTACATGG-3′;并由上海生工公司合成提供。采用2-ΔΔCt表示基因的相对表达量。
1.10小鼠皮肤和肾脏中相关蛋白表达量检测
提取各皮肤和肾脏组织总蛋白,以蛋白浓度检测试剂盒检测蛋白浓度。取20 μg蛋白和4 μL 2×SDS上样缓冲液混合均匀,高温变性10 min;上样,转膜;以5%脱脂牛奶封闭1 h;用PBS冲洗;分别加入一抗(TLR4,1∶800;IL-17,1∶1000;GAPDH,1∶1000),4℃恒温孵育过夜;用PBS冲洗;添加二抗(1∶5000)25℃孵育0.5 h,用PBS冲洗;显色。采用Quantity One图像分析软件进行灰度比分析。
1.11小鼠皮肤和肾脏组织病理学变化检测
取上述小鼠皮肤及肾脏样本,经过脱水、浸蜡、包埋、切片(5 μm)、展片、烤片等程序后,以苏木精-伊红染色,在显微镜下拍照、记录并分析其病理学变化情况。
1.12统计学分析
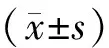
2 结果
2.1 TLR4 mAb降低HSP小鼠24 h尿蛋白含量
小鼠尿蛋白检测结果(表1)显示,和正常对照组比较,HSP模型组小鼠24 h尿蛋白含量显著升高(P<0.01);和HSP模型组和同型对照组比较,TLR4 mAb组小鼠24 h尿蛋白含量显著降低(均P<0.01)。
2.2 TLR4 mAb提升HSP小鼠RES功能
小鼠RES功能检测结果(表2)显示,和正常对照组比较,HSP模型组小鼠吞噬指数K及吞噬系数α均显著降低(均P<0.01),即为小鼠RES功能的下降;和HSP模型组和同型对照组比较,TLR4 mAb组小鼠吞噬指数K及吞噬系数α均显著增加(均P<0.01),即小鼠RES功能增强。

表1 各组小鼠24 h尿蛋白含量变化Table 1 Changes of 24-h urine protein content of mice
与正常对照组比较,**P<0.01;与HSP模型组比较,##P<0.01;与同型对照组比较,&&P<0.01
2.3 TLR4 mAb促进HSP小鼠外周血单核细胞中Th17/Treg平衡
流式细胞术检测结果(表3)显示,与正常对照组比较,HSP模型组小鼠外周血单核细胞中Th17细胞占比及Th17/Treg比值显著增加(均P<0.01),而Treg细胞占比显著降低(P<0.01);与HSP模型组和同型对照组比较,TLR4 mAb组小鼠Th17细胞占比及Th17/Treg比值显著下降(均P<0.01),而Treg细胞占比显著增加(均P<0.01)。

表2 各组小鼠RES功能变化Table 2 Changes of RES function in mice of each
与正常对照组比较,**P<0.01;与HSP模型组比较,##P<0.01;与同型对照组比较,&&P<0.01
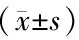
表3 各组小鼠外周血Th17及Treg细胞占比变化Table 3 Changes of proportion of Th17 and Treg cells in peripheral blood of mice in each
与正常对照组比较,**P<0.01;与HSP模型组比较,##P<0.01;与同型对照组比较,&&P<0.01
2.4 TLR4 mAb对HSP小鼠血清S-IgE、IL-17、IL-6、IL-10、TGF-β分泌的影响
小鼠血清ELISA检测结果(表4)显示,与正常对照组比较,HSP模型组小鼠血清S-IgE、IL-17、IL-6、IL-10及TGF-β分泌水平显著升高(均P<0.01);与HSP模型组比较,TLR4 mAb组的S-IgE、IL-17、IL-6显著降低(均P<0.01),IL-10、TGF-β显著升高(均P<0.01)。
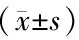
表4 各组小鼠血清S-IgE及免疫细胞因子水平变化Table 4 Changes of serum S-IgE and immune cytokine levels in mice of each
与正常对照组比较,**P<0.01;与HSP模型组比较,##P<0.01;与同型对照组比较,&&P<0.01
2.5 TLR4 mAb抑制HSP小鼠RORγt、促进Foxp3基因的表达
qRT-PCR检测结果(图1)显示,与对照组比较,HSP模型组小鼠皮肤和肾脏组织中RORγt的mRNA水平显著升高(均P<0.01),而Foxp3的mRNA水平显著降低(均P<0.01);与HSP模型组及同型对照组比较,TLR4 mAb组小鼠皮肤和肾脏组织中RORγt的mRNA水平显著降低(均P<0.01),而Foxp3的mRNA水平显著升高(均P<0.01)。

A:RORγt基因的表达水平;B:Foxp3基因的表达水平;与正常对照组比较,**P<0.01;与HSP模型组比较,##P<0.01;与同型对照组比较,&&P<0.01图1 各组小鼠皮肤和肾脏组织中RORγt及Foxp3基因的表达Fig.1 Expression of RORγt and Foxp3 genes in skin and kidney tissues of mice in each group
2.6 TLR4 mAb抑制HSP小鼠TLR4及IL-17蛋白的表达
如图2,与正常对照组比较,HSP模型组小鼠皮肤及肾脏组织中TLR4、IL-17蛋白水平升高;与HSP模型组比较,TLR4 mAb组的TLR4、IL-17蛋白表达降低。
2.7 TLR4 mAb改善HSP小鼠组织病理学变化
苏木精-伊红染色结果(图3)显示,正常对照组小鼠皮肤及肾脏组织表现正常,无病变出现。而HSP模型组和同型对照组则出现皮肤水肿,明显的血管扩张、充血甚至出血,可见较多炎症细胞浸润,同时,肾小球囊腔有积液,且肾小球系膜出现增生,也有炎症细胞浸润。和HSP模型组比较,TLR4 mAb组和西咪替丁组的以上病理症状均有减轻。
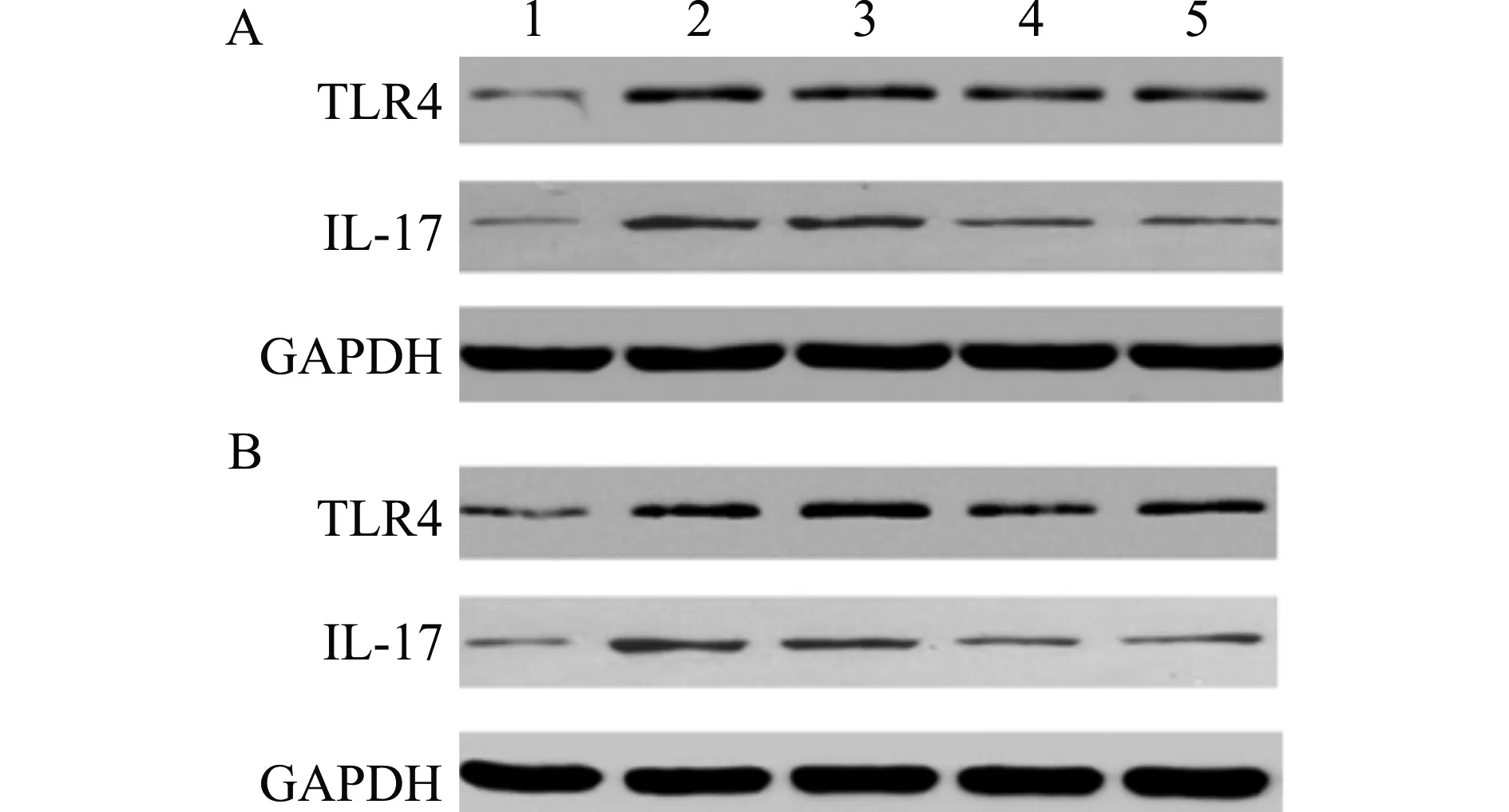
1:正常对照组;2:HSP模型组;3:同型对照组;4:TLR4 mAb组;5:西咪替丁组;A:皮肤组织;B:肾脏组织图2 各组小鼠皮肤及肾脏组织TLR4及IL-17蛋白表达Fig.2 Expression of TLR4 and IL-17 protein in skin and kidney tissue of mice in each group

A/F:正常对照组;B/G:HSP模型组;C/H:同型对照组;D/I:TLR4 mAb组;E/J:西咪替丁组图3 小鼠皮肤及肾脏组织病理学变化(苏木精-伊红染色,×200)Fig.3 Histopathological changes of skin and kidney in mice(Hematoxylin-eosin staining,×200)
3 讨论
HSP是由多种原因导致的血管性疾病,多发于儿童,严重阻碍患者的发育并降低其生活质量[12]。Toll样受体是一类细胞表面跨膜受体,能够有效识别病原相关分子,可以介导宿主细胞内的多种信号通路,Toll样受体是机体发生感染,启动免疫反应和炎症反应的第一道防线,同时也是固有免疫和适应性免疫的桥梁[13]。大量研究已证明,TLR4可以通过介导细胞因子的合成,促进T细胞的活化,以及介导Th1/Th2平衡等途径调节HSP的发病[14]。但在HSP患儿体内高水平的TLR4是否还通过其他免疫途径介导HSP还不清楚。因此本研究采用TLR4 mAb对HSP小鼠模型进行干预,探究TLR4 mAb对HSP小鼠损伤的保护作用及机制。
HSP为一种由免疫球蛋白A(IgA)为主的系统性血管炎症,主要症状为血管壁变得更脆,且通透性增强[15]。本研究采用印度墨水封闭小鼠RES,另外持续以抗原刺激免疫系统,建立了HSP小鼠模型。14周造模结束后,与对照组比较,模型组小鼠尿蛋白含量显著升高,提示持续的抗原刺激导致小鼠产生典型的皮肤性病变,引发HSP肾炎,肾脏组织的病理染色结果也表明其可导致HSP肾炎的发生。刘建宏等[16]所构建的HSP小鼠模型也表现出RES功能的下降和血清免疫循环复合物(CIC)水平的增加。前期对HSP机制的研究主要集中于IgA和IgG等抗原抗体复合物,但近几年研究证实IgE介导的Ⅰ型速发型变态反应也参与了HSP的发生和发展[17]。在本研究中,HSP小鼠模型经TLR4 mAb的干预治疗后,显著提升了RES功能,而S-IgE水平显著下降,我们认为TLR4 mAb可以显著改善HSP小鼠的过敏性症状。
目前,细胞免疫失衡被普遍认为与HSP的发病机制相关[18]。Th17和Treg是近些年发现的CD4+T细胞亚群,它们在维持机体免疫平衡过程中发挥着重要作用,且免疫相关性疾病和感染性疾病中广泛存在着Th17/Treg细胞失衡,主要表现在CD4+IL-17+Th17细胞的增多及CD4+CD25+Treg细胞的减少[19]。其中,在HSP中同样发现Th17细胞及相关因子IL-6、IL-17以及RORγt表达明显增高,而Treg及Foxp3的表达显著降低[20]。周杜鹃等[21]在HSP的相关性研究中发现HSP肾炎患儿体内存在Th17细胞及其相关因子IL-17水平的明显增高,而Treg水平的明显降低,提示Th17/Treg免疫失衡参与了HSP肾炎的发病过程;且HSP组与HSP肾炎组患儿Th17/Treg比值无显著差异,进一步提示了长期的HSP临床症状无论是否累及肾脏诱发HSP肾炎,其二者在发病机制上无本质性区别,均与Th17/Treg免疫失衡密切相关。而本研究显示,HSP小鼠存在典型的Th17/Treg细胞比例失调及相关调控因子RORγt、Foxp3的差异性表达;此外,由此导致的一系列炎症因子出现明显的上调,进而诱发皮肤及肾脏炎症反应。而TLR4 mAb的干预治疗能改善HSP小鼠皮肤及累及至肾脏的炎症反应。
综上所述,TLR4 mAb能显著提升HSP小鼠的RES功能,降低血清过敏反应标志物S-IgE的分泌水平,改善皮肤及肾脏组织的组织病理学变化。其作用机制可能与TLR4 mAb直接或间接降低TLR4、IL-17的表达水平进而介导Th17/Treg免疫平衡密切相关。而本研究仅从动物水平验证及阐述了TLR4 mAb治疗HSP小鼠的有效性及潜在机制,其对临床患者的作用效果如何仍需进一步深入研究。
