脂多糖通过TLR4-MyD88信号通路诱导BV2小胶质细胞激活模型的建立*
2020-05-20王俊力罗卫东张忠文梅俊华陈国华
王俊力,邵 卫,杨 运,罗卫东,张忠文,梅俊华,陈国华
华中科技大学同济医学院附属武汉市中西医结合医院神经内科,武汉 430022
小胶质细胞是中枢神经系统的免疫细胞,它在防御感染和损伤大脑的神经炎症免疫反应中起着至关重要的作用[1],然而异常激活的小胶质细胞可导致多种促炎介质和细胞因子的过度表达,从而引起神经变性相关疾病(包括帕金森病、阿尔茨海默病、多发性硬化、亨廷顿病和缺血性脑卒中)[2-4]。因此,抑制小胶质细胞的异常激活可能对多种神经炎症相关的神经系统疾病的预后具有重要意义。本研究通过观察脂多糖(lipopolysaccharide,LPS)对BV2小胶质细胞炎性因子及相关信号通路分子表达的影响,探讨不同活化程度的BV2小胶质细胞与炎性介质之间的关系及其可能的细胞信号转导途径,以期建立高效稳定的BV2小胶质细胞激活模型。
1 材料与方法
1.1 实验细胞和主要试剂
BV2小胶质细胞株购于武汉大学中国典型培养物保藏中心;高糖DMEM培养液、青霉素和链霉素、0.25%胰酶(含EDTA)购于Hyclcone公司;胎牛血清(FBS)购于Gibco公司;脂多糖(LPS)购于Sigma公司;Cell Counting Kit-8(CCK-8试剂盒)购于DOJINDO公司;NO检测试剂盒购于上海碧云天生物技术有限公司;肿瘤坏死因子α(TNF-α)、白细胞介素-1β(IL-1β)ELISA试剂盒购于深圳欣博盛生物科技有限公司;Prime ScriptTMRT Master Mix逆转录试剂盒和SYBRTMPremix Ex Taq TMⅡ(Perfect Real Time)购于TaKaRa公司;兔来源髓样分化因子88(MyD88)多克隆抗体购于Affinity公司;兔来源Toll样受体4(TLR4)单克隆抗体购于Abcam公司;小鼠来源β-actin单克隆抗体购于Sigma公司;HRP标记山羊抗兔IgG二抗、HRP标记山羊抗鼠IgG二抗购于EARTH公司。
1.2 BV2小胶质细胞的培养
将BV2小胶质细胞用高糖DMEM培养液(含有10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素)培养,放置于37℃、5%CO2培养箱中培养,每隔3天传代。
1.3 CCK-8法绘制BV2小胶质细胞生长曲线
将BV2小胶质细胞消化,细胞计数后以每孔5×107/L接种到96孔板中,每孔100 μL,每板4孔,共计7板;细胞放入37℃、5%CO2培养箱中共培养6 d,第2、4、6天按照常规细胞培养换液,每次换液后培养液为100 μL;分别于接种后第0、1、2、3、4、5、6天取1板细胞进行检测,向每孔中加入CCK-8溶液10 μL,37℃孵育2 h后,使用酶标仪测定450 nm处的吸光度(A)值,最终以测定时间为横轴,每次吸光度值的平均值为纵轴,绘制细胞生长曲线。
1.4 CCK-8法检测BV2小胶质细胞活性
取对数生长期BV2小胶质细胞以每孔5×107/L接种到96孔板中,每孔100 μL。待BV2小胶质细胞贴壁后,分别加入不同浓度的LPS(0.25、0.5、1、2、4 μg/mL),24 h后弃去上清液,PBS清洗3次,向每孔中加入100 μL无血清高糖DMEM和CCK-8溶液10 μL,37℃孵育2 h后,用酶标仪测定450 nm处的A值;实验中分别设立空白组和对照组,每组设立4个复孔,重复3次。
1.5 Griess法测定NO水平
将对数生长期BV2小胶质细胞消化,细胞计数后以每孔1×105个细胞的密度接种到24孔板中培养。待BV2小胶质细胞贴壁后,分别加入不同浓度的LPS(0.25、0.5、1、2、4 μg/mL),24 h后收集细胞培养液上清,每组各取50 μL加到96孔板中,再分别加入50 μL Griess试剂Ⅰ和Ⅱ,振荡混匀后避光反应10 min,用酶标仪测定540 nm处的A值。各组中NO含量依据标准曲线确定。
1.6 qRT-PCR检测BV2小胶质细胞TLR4、MyD88 mRNA的表达
将对数生长期BV2小胶质细胞消化,细胞计数后以每孔2.5×105个细胞的密度接种到6孔板中培养。待BV2小胶质细胞贴壁后,分别加入不同浓度的LPS(0.25、0.5、1、2、4 μg/mL),24 h后弃去培养液,PBS清洗3次。按照RNA提取试剂盒说明书提取各组细胞总RNA,经分光光度计测定浓度和纯度后,进行逆转录合成(反应体积20 μL)cDNA。然后以cDNA为模板进行PCR扩增,其反应方案为:95℃,1 min,预变性;95℃15 s,58℃20 s,72℃20 s,循环40次;72℃,末段延伸5 min;熔解曲线:72℃~95℃,每20 s升温1℃,所用引物序列见表1,每组设3个复孔,使用GAPDH作为内参,采用2-ΔΔCt法计算目的基因的表达量,结果以TLR4、MyD88与GAPDH mRNA表达量的比值表示。

表1 qRT-PCR检测所用的引物序列及长度Table 1 Primer sequences of qRT-PCR detection
1.7 Western blot检测BV2小胶质细胞TLR4、MyD88蛋白的表达
将对数生长期BV2小胶质细胞消化,细胞计数后以每孔2.5×105个细胞的密度接种到6孔板中培养。待BV2小胶质细胞贴壁后,分别加入不同浓度的LPS(0.25、0.5、1、2、4 μg/mL),24 h后弃去培养液,无菌PBS清洗3次。加入蛋白酶抑制剂与RIPA裂解缓冲液的混合液提取各组细胞总蛋白,用BCA法测定蛋白浓度,计算出含40 μg蛋白的溶液体积即为上样量。以β-actin为内参,加入5×蛋白上样缓冲液,100℃水浴5 min。取各组蛋白样品进行SDS-PAGE凝胶电泳、转膜后加入5%脱脂奶粉(0.5%TBST配制)常温摇床封闭1 h。分别加入小鼠抗β-actin单克隆抗体、兔抗TLR4抗体、兔抗MyD88抗体后4℃过夜。TBST洗膜3次(10 min/次)后分别加入HRP标记山羊抗兔IgG二抗(1∶5000)、HRP标记山羊抗鼠IgG二抗(1∶5000)室温下孵育30 min,TBST再次洗膜后加入等体积混匀的ECL化学发光试剂A和B,均匀滴加到膜的蛋白面,保持1~2 min后放入凝胶成像仪中曝光成像,应用Image J软件进行各组样本条带灰度值分析,结果以TLR4、MyD88蛋白与β-actin条带灰度值的比值表示。
1.8 ELISA法检测BV2小胶质细胞培养上清液中TNF-α、IL-1β含量
对数生长期BV2小胶质细胞以每孔5×107/L接种到96孔板中培养,每孔100 μL。待BV2小胶质细胞贴壁后加入LPS(1 μg/mL),24 h后收集BV2小胶质细胞培养上清液。用ELISA试剂盒检测TNF-α和IL-1β水平,具体操作步骤按ELISA试剂盒说明书进行。用酶标仪测定450 nm处的A值,建立标准曲线拟合,根据标准曲线计算TNF-α和IL-1β的含量。
1.9 统计学分析
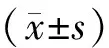
2 结果
2.1 BV2小胶质细胞的生长曲线
根据BV2小胶质细胞生长曲线可知,BV2小胶质细胞传代培养后第0~2天是生长缓慢的潜伏期,第2~3天是对数生长期,第3~5天是平顶期,生长曲线呈平台状,第5天后细胞开始衰亡(图1)。取对数生长期BV2小胶质细胞用于后续实验研究。

图1 BV2小胶质细胞生长曲线Fig.1 Growth curve of BV2 microglia
2.2 LPS对BV2小胶质细胞形态的影响
图2为静息状态下的BV2小胶质细胞,胞体小,并具有伸向各个方向的细长突起;图3为经LPS(1 μg/mL)刺激后的BV2小胶质细胞,胞体增生肥大,突起减少且回缩变短,呈圆形或杆状,形态呈现类阿米巴样。

图2 静息状态BV2细胞形态(×100)Fig.2 Morphology of resting BV2 microglia(×100)
2.3 LPS对BV2小胶质细胞活性的影响
以对照组A值为标准(100%),其余各组A值与对照组比值代表各组细胞存活率,LPS刺激BV2小胶质细胞后能明显降低细胞存活率,且在实验剂量范围内呈现剂量依赖性;不同浓度的LPS(0.25、0.5、1、2、4 μg/mL)刺激BV2小胶质细胞后细胞存活率分别为(0.944±0.023)、(0.860±0.023)、(0.761±0.026)、(0.636±0.015)、(0.537±0.017),与对照组比较差异均有统计学意义(均P<0.05)。
2.4 LPS对BV2小胶质细胞NO释放的影响
LPS刺激BV2小胶质细胞后能显著提高NO的释放量,且在实验剂量范围内呈现剂量-效应关系,LPS浓度为0.25、0.5、1、2、4 μg/mL时,BV2小胶质细胞NO释放量分别为(7.947±0.089)、(10.835±0.292)、(13.132±0.590)、(16.790±0.631)、(23.100±0.751)μmoL,与对照组(4.142±0.140)μmoL比较,差异均有统计学意义(均P<0.05)。
2.5 qRT-PCR检测BV2小胶质细胞TLR4和MyD88 mRNA的表达
由图4可知,LPS刺激BV2小胶质细胞后TLR4和MyD88 mRNA的表达较相应对照组明显升高,差异有统计学意义(均P<0.05);且TLR4 mRNA和MyD88 mRNA的表达随着LPS浓度增加呈现先升高后降低的趋势,均在LPS 1 μg/mL时达到峰值。
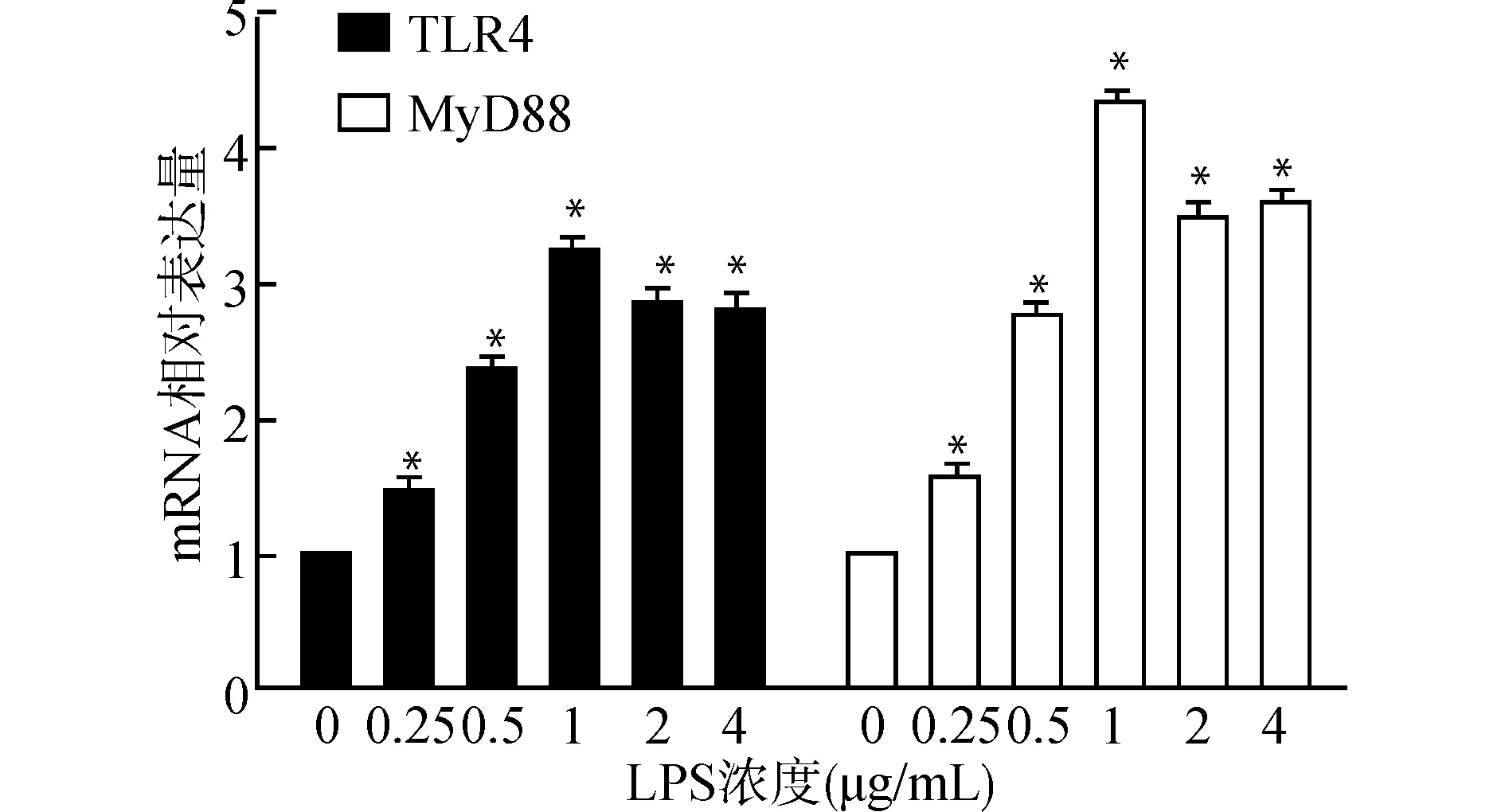
与对照组比较,*P<0.05图4 qRT-PCR检测BV2小胶质细胞TLR4和MyD88 mRNA表达Fig.4 Detection of TLR4 and MyD88 mRNA expression in BV2 microglia by qRT-PCR
2.6 Western blot检测BV2小胶质细胞TLR4和MyD88蛋白的表达
从图5可见,LPS刺激BV2小胶质细胞后TLR4和MyD88蛋白的表达较相应对照组明显升高,差异均有统计学意义(均P<0.05);且TLR4蛋白和MyD88蛋白的表达随着LPS浓度增加呈现先升高后降低的趋势,均在LPS 1 μg/mL达到峰值。
2.7 ELISA法检测BV2小胶质细胞培养上清液中TNF-α和IL-1β浓度的变化
LPS(1 μg/mL)作用后,BV2小胶质细胞培养上清液中TNF-α的浓度明显增高[(1115.547±42.269)vs.(128.198±11.077)],IL-1β的浓度也明显增高[(98.390±8.831)vs.(16.040±0.285)],与对照组比较差异均有统计学意义(均P<0.05)。

与对照组比较,*P<0.05图5 Western blot检测BV2小胶质细胞TLR4和MyD88蛋白表达Fig.5 Detection of TLR4 and MyD88 protein expression in BV2 microglia by Western blotting
3 讨论
大量研究表明,神经炎症反应可引起神经元内稳态异常及氧化损伤,从而在阿尔茨海默病、多发性硬化和帕金森病等中枢神经系统疾病中发挥至关重要的作用[5-6]。多项前瞻性研究显示,健康受试者长期服用非甾体类抗炎药物可降低阿尔茨海默病和帕金森病的患病率,这间接地表明神经炎症反应在神经变性性疾病发病过程中起重要作用[7-11]。因此,抑制神经炎症反应必将为阿尔茨海默病、帕金森病等中枢神经系统疾病的治疗提供新的思路和方案。
小胶质细胞是中枢神经系统中的免疫效应细胞,它被激活后主要分化为发挥促炎作用的M1型和起抗炎作用的M2型[12-14]。在阿尔茨海默病发病过程中,小胶质细胞通过清除细胞外和早期弥漫斑块内的Aβ可以有效促进Aβ的产生与清除之间的平衡,有利于脑内损伤的修复;然而,随着不溶性Aβ在斑块内聚集的形成,小胶质细胞被异常激活,并通过自分泌或旁分泌方式产生多种促炎介质,如肿瘤坏死因子、白介素-1β、白介素-6、一氧化氮和活性氧(ROS)等,这些介质对神经元产生强烈的毒性作用,导致脑内损伤的进一步恶化[15-17]。因此,调控小胶质细胞的激活,减少炎症介质的表达,从而减轻神经炎症损伤是阿尔茨海默病研究的主要靶向之一。
BV2小胶质细胞是小鼠小胶质细胞通过逆转录病毒转染v-raf/v-myc后获得永生化的细胞系。该细胞系高度纯化,且保留有小胶质细胞形态、表型及各种功能,是研究小胶质细胞理想的体外模型。脂多糖(LPS)为革兰阴性细菌细胞壁的特征成分,它与小胶质细胞膜上的TLR4受体结合启动TLR4信号通路的传导。TLR4通过其衔接蛋白MyD88和TRIF途径下传信号,其中MyD88途径是经典信号传导途径,其诱导的信号主要产生促炎介质[18-20]。因此,建立高效稳定的BV2小胶质细胞激活模型和探讨BV2小胶质细胞激活的跨膜转导机制对阿尔茨海默病的体外研究尤为重要。
本实验分别用不同浓度的LPS(0.25、0.5、1、2、4 μg/mL)诱导BV2小胶质细胞,实验结果发现BV2小胶质细胞被LPS激活后,BV2小胶质细胞胞体增生肥大,突起减少回缩变短,呈圆形或杆状,形态呈现类阿米巴样;LPS能明显降低BV2小胶质细胞存活率及提高NO释放量,且在实验剂量范围内呈现剂量-效应关系;TLR4、MyD88 mRNA及蛋白的表达随着LPS浓度增加呈现先升高后降低的趋势,且均在LPS 1 μg/mL时达到峰值;LPS(1 μg/mL)诱导BV2小胶质细胞后显著提高TNF-α和IL-1β浓度。
综上所述,LPS可能通过TLR4信号通路诱导BV2小胶质细胞活化,进而上调其炎性介质的水平。同时结合本实验结果发现:1 μg/mL LPS是建立高效稳定BV2小胶质细胞激活模型的最佳浓度。TLR4信号通路可能是调控小胶质细胞激活、减少炎症损伤的关键靶点。寻找和开发靶向调控TLR4信号通路的药物可能对阿尔茨海默病等中枢神经系统疾病相关炎症反应的控制及预后改善具有重要意义。当然,靶向调控TLR4信号通路的药物还需在今后的动物实验和临床研究中进一步验证。
