长链非编码RNA SNHG16在胰腺癌中的表达及功能*
2020-05-20马松林周婷婷廖宇圣
王 剑,马松林,周婷婷,廖宇圣
华中科技大学同济医学院附属武汉中心医院消化内科,武汉 430014
胰腺癌(pancreatic cancer,PC)是致死率极高的恶性肿瘤,在全球癌症致死率中排名第4[1]。近年来,尽管手术、放疗和化疗等治疗方法取得了长足的进步,胰腺癌的5年总生存率仍不尽人意,主要原因是其易转移和化疗耐药性[2],因此需要对与胰腺癌发生和发展相关的分子机制进行深入研究。
长链非编码RNA(lncRNA)是一种非编码RNA,其在转录、转录后翻译和表观遗传基因调控上发挥广泛的作用[3]。lncRNAs在肿瘤的发生和发展中参与肿瘤相关基因或miRNA的调节而发挥抑癌或致癌作用,是潜在的诊断和治疗的分子标志物[4-5]。lncRNA小核仁RNA宿主基因16(SNHG16)在多种恶性肿瘤中表达异常[6-7],但其在胰腺癌中的表达情况和功能尚不清楚。本研究旨在探讨PC患者SNHG16表达情况、临床意义及其功能和作用机制。
1 材料与方法
1.1 组织样本收集
收集2014年1月到2018年1月间在武汉市中心医院普通外科诊断和手术治疗的胰腺癌患者共46例的临床病理标本。纳入标准:①患者经病理诊断为胰腺癌且不存在其他部位肿瘤;②患者具有完整的临床资料和随访信息;③患者手术前未接受任何其他治疗(包括放化疗和生物治疗)。排除标准:①术前接受化疗者;②临床资料和随访资料不全或病理组织不合格者。患者手术后立即将胰腺癌组织和癌旁组织在液氮中直接冷冻并储存在-80℃冰箱。本研究根据赫尔辛基宣言的原则,经医院伦理委员会批准同意。
1.2 临床资料和随访
从患者临床病历资料中收集患者年龄、性别、病理类型和TNM分期等信息,术后随访采用定期门诊复诊和电话随访方式进行,每半年随访1次,共失访2人。术后总生存时间为手术治疗日起至死亡时间间隔,中位随访时间为24个月。
1.3 主要试剂和仪器
4种人胰腺癌细胞系(BxPC-3、SW1990、PANC-1和AsPC-1)及胰腺导管上皮细胞系(HPDE6-C7)购自美国ATCC。One Step Prime script miRNA cDNA合成试剂盒、细胞计数试剂盒-8(CCK-8)、微孔板分光光度计、RIPA缓冲液、抗体[抗β-连环蛋白(β-catenin)、抗c-myc和抗细胞周期蛋白D1(cyclin D1)]购于北京生物试剂有限公司。基质胶Matrigel及Transwell小室购自美国BD公司,ThermoND2000C超微量分光光度计购自美国Thermo公司,GeneAmp PCR system 9700扩增仪购自美国PerkinElmer公司,靶向干扰RNA序列(si-SNHG16)和阴性对照序列(si-NC)均由上海吉玛公司化学合成。
1.4 实验方法
1.4.1 细胞培养和转染 将4种胰腺癌细胞系和正常胰腺导管上皮细胞系置于含有10%胎牛血清和双抗的RPMI-1640培养液,并在37℃和5%CO2下培养,实验所需的细胞均为对数生长期细胞。按LipofectamineTM2000说明书方案靶向干扰RNA(si-SNHG16)和阴性对照(si-NC)转染AsPC-1细胞,并分成SNHG16敲低组(si-SNHG16组)和阴性对照组(si-NC组),通过qRT-PCR检测转染效率。
1.4.2 实时定量聚合酶链反应(qRT-PCR) 将适量组织加入1 mL RNAiso plus研磨,随后加入200 μL氯仿,振荡并静置10 min,在12000 r/min及44 ℃条件下离心15 min,随后加入异丙醇,离心后收集沉淀,用1 mL 75%乙醇洗涤后晾干,总RNA的浓度在分光光度计下测定。采用SureCycler 8800 PCR仪(Agilent Technologie)行逆转录,加入RR036A逆转录试剂盒,合成cDNA。PCR引物由上海吉玛生物公司合成。SNHG16上游引物:5′-ACATCGGCATGATGGCAGAA-3′;下游引物:5′-TCACAAAAGGCGGGACCAC-3′。GAPDH上游引物:5′-GTAACCCGTTGAACCCCATT-3′;下游引物:5′-CCATCCAATCGGTAGTAGCG-3′。以GAPDH为内参对照,结果分析采用2-ΔΔCt法进行基因表达的相对定量。根据癌组织中SNHG16的表达中位值将46名患者分为SNHG16高表达组(n=25例)和低表达组(n=21例)
1.4.3 细胞增殖和凋亡实验 用CCK-8试剂盒测定体外细胞增殖。在96孔板中接种转染的AsPC-1细胞(5×103个/孔)培养96 h,每隔24 h,每孔加入10 μL CCK-8溶液孵育4 h。然后用微孔板分光光度计在每个时间点测量490 nm处的吸光度。使用Annexin Ⅴ-荧光素异硫氰酸酯(FITC)/碘化丙啶(PI)检测试剂盒(Invitrogen,Carlsbad,CA,USA)以流式细胞术评估凋亡程度。将总共约5×104个AsPC-1细胞接种到6孔板中用于细胞凋亡测定,使用Annexin Ⅴ-FITC凋亡检测试剂盒进行测试,使用Cell-Quest软件分析细胞凋亡率。
1.4.4 细胞侵袭实验 用Transwell实验测定细胞侵袭能力,待AsPC-1细胞转染24 h后,经胰酶消化离心后,将1×105个/100 μL细胞悬液接种于Matrigel包被的Transwell小室的上室,下室加入含10%FBS的DMEM培养液500 μL,48 h后取出小室,采用4%多聚甲醛溶液固定细胞15 min,结晶紫染色10 min,在200倍视野下计数3个视野穿出小室的细胞数。
1.4.5 荧光素酶检测 TOP/FOP闪光荧光素酶报告系统参照文献[8]的方法检测细胞Wnt/β-catenin信号激活状态。将转染后的AsPC-1细胞在16孔板(2×104个/孔)中培养,48 h后收获细胞并裂解用于荧光素酶测定,以海肾TK荧光素酶载体作为内部对照。
1.4.6 蛋白印迹实验 将细胞在RIPA缓冲液中裂解,并使用蛋白质测定试剂盒测定蛋白质浓度。通过十二烷基硫酸盐,钠盐-聚丙烯酰胺凝胶(SDS-PAGE)电泳分离蛋白质样品,然后转移到硝酸纤维素膜上。用含有0.05%Tween 20的Tris缓冲盐水洗膜,再以5%脱脂乳封闭,并与第一抗体一起在4℃下以1∶200的浓度孵育至少12 h,然后与辣根过氧化物酶(HRP)偶联的第二抗体在室温下孵育2 h。根据制造商的方案,通过酶联化学发光法进行条带检测。GAPDH蛋白条带用作对照。
1.5 统计学方法
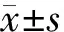
2 结果
2.1 SNHG16在胰腺癌患者癌组织和细胞系中表达上调
胰腺癌组织中SNHG16的相对表达量显著高于癌旁组织(P<0.01),见图1A;在4个胰腺癌细胞系(BxPC-3、SW1990、PANC-1和AsPC-1)中SNHG16的表达水平显著高于人胰腺导管上皮细胞系HPDE6-C7(均P<0.01),见图1B。

A:胰腺癌与癌旁组织;B:胰腺癌细胞系;与癌旁组织和HPDE6-C7比较,**P<0.01图1 SNHG16在人胰腺癌组织和胰腺癌细胞系中表达上调Fig.1 Up-regulation of SNHG16 expression in human pancreatic cancer tissue and pancreatic cancer cell line
2.2 胰腺癌组织中SNHG16表达的临床意义
SNHG16高表达与肿瘤分化程度、TNM分期和淋巴结转移相关(均P<0.05),而与年龄、性别无相关性(均P> 0.05),见表1。Kaplan-Meier生存分析结果显示,SNHG16高表达组患者总生存率显著低于SNHG16低表达组患者(P=0.003),见图2。

图2 SNHG16高表达组和低表达组胰腺癌患者总生存率比较Fig.2 Comparison of overall survival of patients with pancreatic cancer between SNHG16 high expression group and SNHG16 low expression group

表1 SNHG16表达与胰腺癌患者的临床病理因素的关系Table 1 Association of SNHG16 expression with clinicopathologic factors of patients with pancreatic cancer
2.3 SNHG16敲低抑制胰腺癌细胞增殖
si-SNHG16组SNHG16的相对表达量较si-NC组显著降低(P<0.01),见图3A;CCK-8实验显示敲低SNHG16表达48、72及96 h后,si-SNHG16组A490nm值显著低于si-NC组(均P<0.01),见图3B。
2.4 SNHG16敲低促进胰腺癌细胞凋亡
凋亡实验显示敲低SNHG16表达后,si-SNHG16组细胞凋亡率显著高于si-NC组,(15.3±1.5)%vs.(4.8±0.4)%,P<0.01,见图4。
A:敲低效率测定;B:CCK-8实验;与si-NC组比较,**P<0.01图3 SNHG16敲低抑制胰腺癌细胞增殖Fig.3 Knockdown of SNHG16 inhibited the proliferation of pancreatic cancer cells

A:流式细胞术测定细胞凋亡;B:凋亡率的比较,与si-NC组比较,**P<0.01图4 敲低SNHG16表达促进胰腺癌细胞凋亡Fig.4 Knockdown of SNHG16 promoted apoptosis of pancreatic cancer cells
2.5 SNHG16敲低抑制胰腺癌细胞侵袭
Transwell实验显示,200倍视野下,SNHG16敲低导致细胞侵袭能力显著降低(P<0.01),si-SNHG16组侵袭细胞数(202±13)显著少于si-NC组(411±15),见图5。
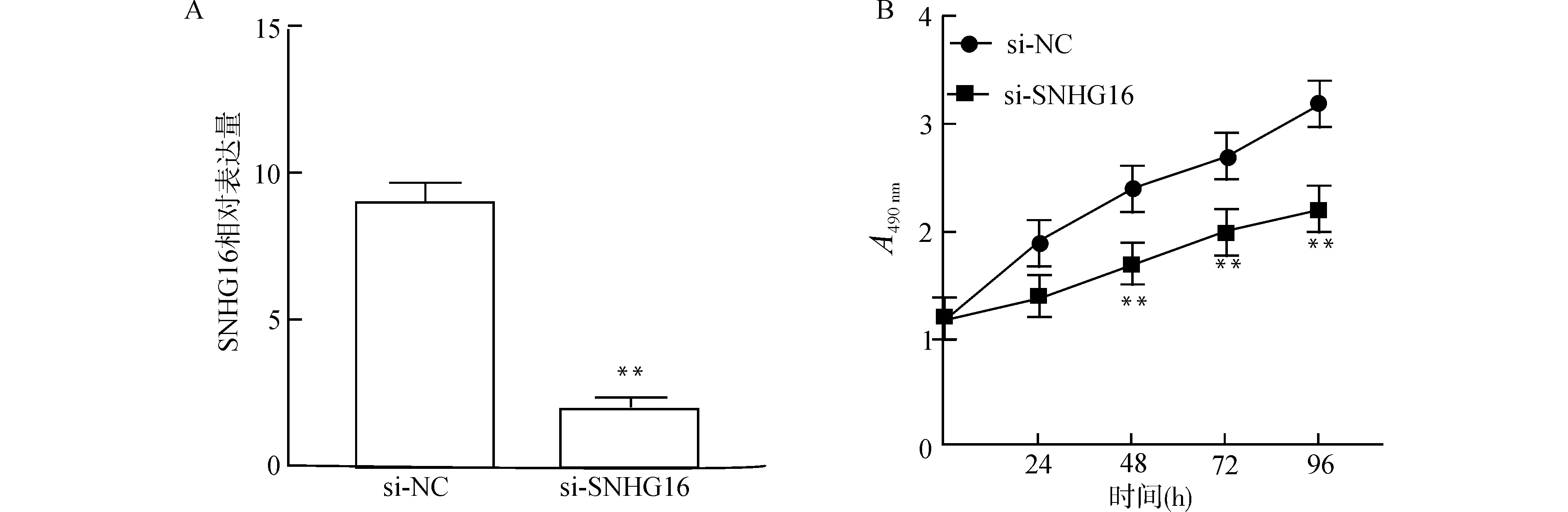
2.6 敲低SNHG16表达抑制胰腺癌细胞中Wnt/β-catenin信号通路激活
Wnt途径激活TOP/FOP荧光素酶报告基因实验结果显示:当AsPC-1细胞中SNHG16表达下调时,Wnt/β-catenin信号通路的活性受到抑制(图6A);蛋白印迹检测Wnt/β-catenin活性相关蛋白表达发现,敲低SNHG16表达水平后,胰腺癌细胞系(AsPC-1)细胞中c-myc、β-catenin和cyclin D1表达均显著降低(均P<0.01)(图6B)。
A:TOP荧光素酶闪光矢量检测转染后AsPC-1中β-catenin/淋巴增强结合因子启动子活性;B:蛋白印迹分析显示转染后AsPC-1细胞中Wnt/β-catenin信号传导途径组分的变化,与si-NC组比较,**P<0.01图6 SNHG16敲低抑制AsPC-1中Wnt/β-catenin途径激活Fig.6 Knockdown of SNHG16 suppressed activation of Wnt/β-catenin signaling pathway in AsPC-1
3 讨论
胰腺癌是常见的高致死性癌症,即使在美国胰腺癌患者5年生存率仍低至6%[9]。胰腺癌诊断时往往处于晚期,即使符合手术切除标准的胰腺癌患者术后5年生存率仍低于20%[9]。积极研究胰腺癌发病分子基础和预后标志物对改善胰腺癌患者预后尤为重要。
lncRNAs是一类大于200个核苷酸且没有蛋白质编码能力的RNA分子[10],随着大量lncRNAs的发现和功能鉴定,部分被认为是胰腺癌诊断和预后的分子标志物[11-12]。文献报道lncRNA TUG1可通过靶向miR-29c在体外和体内促进胰腺癌细胞生长及迁移[13]。文献报道SNHG1上调通过抑制胰腺癌中Notch-1信号通路抑制细胞增殖、转移和侵袭[14]。lncRNA GAS5通过调节miR-221/SOCS3途径介导胰腺癌细胞自我更新和上皮间质转化,促进癌细胞转移和对吉西他滨的耐药性[15]。本研究发现胰腺癌组织中SNHG16表达显著高于癌旁组织,同时发现4种胰腺癌细胞系中SNHG16表达显著高于HPDE6-C7细胞系。胰腺癌患者癌组织中SNHG16的高表达与患者肿瘤分化程度、TNM分期和淋巴结转移密切相关(均P<0.05),且SNHG16高表达患者总生存率显著降低,提示SNHG16表达增加与预后不良和总生存率降低相关,是潜在的预测胰腺癌不良预后的分子标志物。文献报道SNHG16在几种恶性肿瘤如口腔癌[16]和非小细胞肺癌[17]中发挥致癌基因作用,且可作为上述癌症预后不良的分子标志物,本研究结果与上述结果存在一致性。本研究发现SNHG16表达下调可致癌细胞增殖和侵袭能力受到抑制,且促进细胞凋亡,提示其可能在肿瘤进展中发挥促进作用。
Wnt/β-catenin信号传导途径与肿瘤发生和癌症进展密切相关,其在细胞生长、发育和干细胞分化中起关键作用[18]。本研究发现敲低SNHG16表达可显著性抑制Wnt/β-catenin信号传导途径的活性,且Wnt/β-catenin信号传导途径相关蛋白表达水平明显降低。文献报道lncRNA UCA1可通过调节Wnt/β-catenin信号通路促进口腔鳞状细胞癌细胞的增殖和迁移[19],lncRNA CASC11通过激活Wnt/β-catenin途径促进结直肠癌的生长和转移[20],提示SNHG16可能通过参与Wnt/β-catenin信号传导途径调节胰腺癌增殖和侵袭过程。
总之,本研究发现lncRNA SNHG16在胰腺癌组织和细胞系中表达上调,其表达水平与肿瘤分化程度、TNM分期、淋巴结转移和总生存率相关,是胰腺癌潜在的分子标志物。SNHG16敲低可抑制胰腺癌细胞增殖和侵袭能力,并促进细胞凋亡,其可能通过抑制Wnt/β-catenin信号通路活性而发挥抗癌作用。
