腹膜后路径在直肠子宫陷凹封闭的腹腔镜全子宫切除术中的应用
2020-05-20王晓翊熊宙芳
王晓翊,熊宙芳
华中科技大学同济医学院附属协和医院妇产科,武汉 430022
全子宫切除术是妇科最常见的手术之一,自1989年Hary Reich教授完成第1例腹腔镜全子宫切除术以来[1],腹腔镜手术在全子宫切除术中的比例持续上升。与开腹手术相比,腹腔镜全子宫切除术的住院时间短、切口美观、术后疼痛轻和恢复快,因而具有明显的优势[2-4]。但有研究表明严重的盆腔粘连与腹腔镜全子宫切除术手术时间延长和术中、术后并发症增加有关,其导致的中转开腹率可高达6.3%[5]。
子宫、子宫颈的后壁与其周围的组织结构(如直肠、乙状结肠、阴道后壁或子宫骶骨韧带等)之间形成广泛粘连可导致直肠子宫陷凹封闭。在行腹腔镜全子宫切除术时需将直肠、乙状结肠与子宫、子宫颈后壁的粘连松解,但因解剖界限不清,粘连分离困难,增加了输尿管、肠管损伤的风险,从而导致妇科医生选择开腹全子宫切除术。我们选择2015~2019年华中科技大学同济医学院附属协和医院妇产科开展的直肠子宫陷凹封闭患者的腹腔镜下全子宫切除术75例进行回顾性分析,探讨安全应用腹膜后路径的策略方法,现报道如下。
1 资料与方法
1.1 一般资料
病例纳入标准:①符合全子宫切除术的手术指征;②患者的直肠、乙状结肠致密粘连于子宫、宫颈后壁上,而且肠壁包埋在两侧子宫骶骨韧带之间,造成直肠子宫陷凹封闭;③异常出血者术前常规行诊刮排除子宫内膜恶性变。病例排除标准:①妇科恶性肿瘤性疾病;②膜性粘连所致直肠子宫陷凹封闭。
选取我院收治直肠子宫陷凹封闭的腹腔镜全子宫切术患者75例,病例选取时间为2015年1月至2019年6月。根据最终选取的手术方式分为腹膜后路径组(n=35)和腹膜内路径组(n=40),两组患者年龄、子宫大小、体质指数(body mass index,BMI)、既往盆腹腔手术史等比较差异均无统计学意义(均P>0.05),资料具有可比性。见表1。
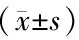
表1 两组一般资料比较Table 1 Comparison of the general data between the two
1.2 方法
1.2.1 腹膜后路径组 全麻下取膀胱截石位,常规消毒铺无菌手术单,脐部切口放置10 mm套管,建立压力为13 mmHg的CO2气腹。腹腔镜监视下(图1A),利用超声刀分离盆腹腔粘连,凝固并切断子宫圆韧带、切开阔韧带前叶及膀胱腹膜返折,下推膀胱至宫颈外口水平以下。平行于骨盆漏斗韧带切开后腹膜,进入腹膜后间隙。暴露输尿管,分离直肠侧窝和膀胱侧窝,于髂内动脉的子宫动脉起始处凝固并切断子宫动脉,切开阔韧带的后叶直至子宫骶骨韧带的水平。凝固并切断输卵管及卵巢固有韧带(如需切除附件则切断骨盆漏斗韧带),同法处理对侧。分离两侧子宫骶骨韧带内侧与直肠之间的直肠旁间隙(图1B,1C),并由直肠旁间隙进入肠管与子宫后壁致密粘连下方的直肠阴道间隙。钝性分离直肠阴道间隙,剪刀锐性分离肠管与子宫后壁的致密粘连。粘连全部松解后,直肠阴道间隙完全分离(图1D)。
解剖出双侧子宫血管,以双极电凝靠近子宫壁电凝切断子宫血管。超声刀切断骶主韧带后,沿阴道穹隆部环形切断阴道壁,切除子宫,缝合阴道残端,检查创面无出血后结束手术。
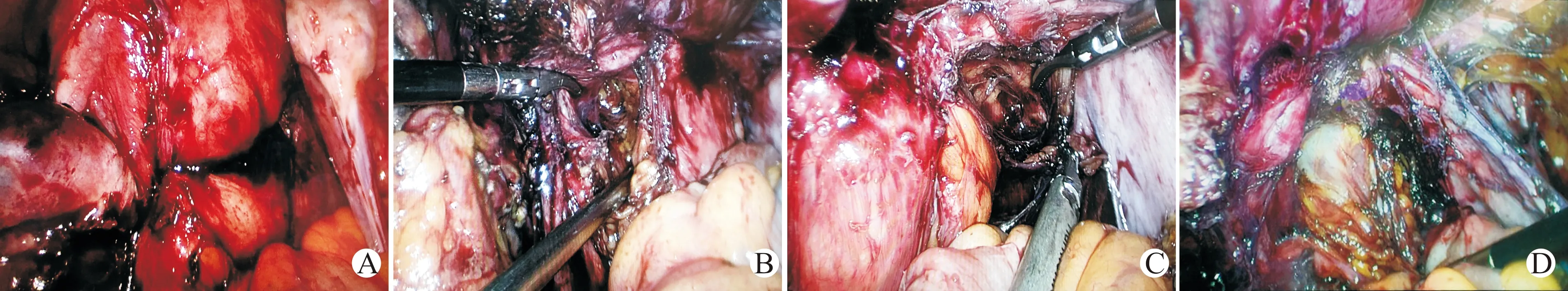
A:术前直肠子宫陷凹完全封闭;B:分离左侧直肠旁间隙;C:分离右侧直肠旁间隙;D:直肠阴道间隙完全分离图1 应用腹膜后路径对直肠子宫陷凹封闭的患者进行腹腔镜全子宫切除术Fig.1 Application of retroperitoneal approach in total laparoscopic hysterectomy for patients with obliterate posterior cul-de-sac
1.2.2 腹膜内路径组 不打开后腹膜及进入腹膜后间隙,超声刀凝固并切断子宫圆韧带、切开阔韧带前叶及膀胱腹膜返折,下推膀胱至宫颈外口水平以下。凝固并切断输卵管及卵巢固有韧带(如需切除附件则切断骨盆漏斗韧带)。
紧贴子宫后壁分离肠管与子宫后壁的致密粘连后,以双极电凝靠近子宫壁电凝切断子宫血管,并按常规行全子宫切除术。
1.3 统计学方法
2 结果
2.1 两组手术情况比较
腹膜后路径组手术时间、术中出血量分别为(115.57±17.23)min、(75.71±40.89)mL,腹膜内路径组分别为(140.88±18.32)min、(112.57±95.24)mL,腹膜后路径组的平均手术时间、术中出血量均少于腹膜内路径组,差异有统计学意义(均P<0.05)。腹膜后路径组术后体温恢复时间、肛门排气时间、住院天数分别为(2.11±1.47)d、(34.69±4.94)h、(6.31±0.87)d,腹膜内路径组分别为(1.52±1.13)d、(33.47±.6.93)h、(6.40±0.96)d,差异均无统计学意义(均P>0.05)。见表2。
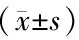
表2 两组手术情况的比较Table 2 Comparison of operation between the retroperitoneal group and intraperitoneal
2.2 两组围手术期并发症情况
腹膜内路径组有1例术中出血量大于500 mL,1例中转开腹,而腹膜后路径组两者均无。两组均无膀胱、输尿管和肠管损伤,无术后尿潴留发生。
3 讨论
直肠子宫陷凹封闭通常与子宫内膜异位症、盆腔炎或盆腔肿瘤相关。Cullen于1914年首次描述了在子宫内膜异位症患者中,部分患者的直肠、乙状结肠粘连于子宫、宫颈后壁上,而且肠壁包埋在两侧子宫骶骨韧带之间,造成直肠子宫陷凹封闭。大多数专家认为这是该疾病的最严重表现形式之一,并且隐藏在封闭的直肠子宫陷凹之间的内膜异位病灶最难以手术切除[6]。
对于直肠子宫陷凹封闭的腹腔镜全子宫切除术,需进行涉及肠管、卵巢和输尿管等重要盆腔结构的广泛粘连分解。目前通过腹腔镜或剖腹手术是确诊直肠子宫陷凹封闭的唯一途径,直肠子宫陷凹封闭是妇科医生进行腹腔镜全子宫切除术的一大挑战。通常,致密的粘连和解剖学变异导致解剖层次不清,出血多以及脏器损伤,尤其是未被识别的热损伤导致的迟发性瘘管或脓肿,增加了手术的复杂性,延长了手术时间,并且并发症和中转开腹的发生率高于普通妇科腹腔镜手术[7]。因此,在手术前准确地评估直肠子宫陷凹封闭的情况,对于合理的手术计划、获得有意义的知情同意和适当转诊至上级医院是至关重要的。
研究表明慢性盆腔疼痛、性交痛、排便困难或痛经的病史均与直肠子宫陷凹封闭相关。盆腔检查时如出现直肠子宫陷凹的局部压痛,则需警惕直肠子宫陷凹封闭的可能性。而如果存在直肠子宫陷凹结节,几乎有一半患者存在直肠子宫陷凹封闭[8]。超声波检查时的“滑动征象”技术也有助于手术前诊断直肠子宫陷凹封闭。“滑动征象”是指在阴道超声检查时在阴道探头上轻柔加压,然后评估直肠、乙状结肠是否可以自由滑过子宫后壁、子宫颈后部和阴道后壁。正常时直肠、乙状结肠可以自由地滑过子宫后壁、子宫颈后部和阴道后壁。但如果不发生滑动,则提示它们之间的位置相对固定,肠管和子宫、宫颈等紧密,直肠子宫陷凹封闭[9]。经阴道超声预测直肠子宫陷凹封闭,与金标准腹腔镜的检查结果有高度的相关性,它的准确性、敏感性、特异性、阳性和阴性预测值分别为65.4%~96.2%、80.0%~100%、64.7%~100%、50.0%~100%和94.7%~100%[10-11]。研究表明使用3-T系统进行盆腔MRI检查可降低信噪比,确保良好的空间分辨率和对比度,提供有关直肠子宫陷凹封闭和子宫骶骨韧带等隐藏在直肠子宫陷凹中病变的良好术前评估[12]。Kikuchi等[13]在盆腔磁共振成像时将超声凝胶注入阴道及直肠,描绘陶氏腔与直肠和输尿管等关键器官之间的位置关系,评估直肠子宫陷凹的粘连情况。结果表明没有使用超声凝胶进行MR成像诊断直肠子宫陷凹封闭的敏感性和特异性为81.0%和55.6%,而将超声凝胶注入阴道及直肠后,MR成像诊断直肠子宫陷凹封闭的敏感性和特异性提高到95.2%和88.9%。因此,盆腔磁共振成像时将超声凝胶注入阴道及直肠是一种有潜在价值的术前诊断直肠子宫陷凹封闭的简单可靠方法。
直肠子宫陷凹封闭导致其周围器官的解剖结构严重扭曲,手术中需要进行细致的解剖,广泛的肠粘连分离,从而增加了肠损伤的机会[14]。肠损伤是腹腔镜手术中较常见的严重并发症之一,其导致的死亡率可高达3.6%[15]。传统观念认为肠管和子宫之间的粘连紧密,不利于通过腹腔镜进行安全地分离。如果采用腹膜内路径,在肠管粘连于子宫后壁的最上端开始用剪刀锐性分离,并配合适当钝性分离,由于粘连紧密、解剖层次不清、分离面出血等原因,将增加肠道损伤的机会,使腹腔镜全子宫切除术极具挑战性且充满危险。为了降低肠损伤的风险,Cho[16]提出了一种改良技术——阴道镜和腹腔镜相结合的方法。先经阴道在阴道穹隆处环形切开阴道壁,分离直肠和阴道壁之间的间隙,并尽可能向上靠近粘连的边缘分离子宫、宫颈后壁与肠管之间的粘连。将阴道拉钩置入该空间,将其推向致密粘连的边缘,其尖端尽可能靠近子宫。然后在腹腔镜监视下识别阴道拉钩,使用腹腔镜剪刀可以相对容易地解剖子宫和拉钩之间的区域,打开封闭的直肠子宫陷凹。Reich等[17]指出在阴道或直肠中放置探头可以显示阴道或肠管的轮廓,将有助于识别解剖平面,分离子宫、宫颈及阴道后壁与肠管之间的粘连,从而避免损伤肠管。
采用腹膜后路径对直肠子宫陷凹封闭的患者进行腹腔镜全子宫切除术的策略包括:①打开进入腹膜后间隙,暴露输尿管。②分离直肠侧窝和膀胱侧窝,于髂内动脉的子宫动脉起始处凝固并切断子宫动脉,③凝固并切断输卵管及卵巢固有韧带(如需切除附件则切断骨盆漏斗韧带)。④分离两侧子宫骶骨韧带内侧与直肠之间的直肠旁间隙,并由直肠旁间隙进入肠管与子宫后壁致密粘连下方的直肠阴道间隙。⑤钝性分离直肠阴道间隙,锐性分离肠管与子宫后壁的致密粘连。粘连全部松解后,直肠阴道间隙完全分离。
该策略是从子宫骶骨韧带外侧开始解剖,然后转向封闭的直肠子宫陷凹,即先两侧,再中间。该策略具有以下几个优点:首先,直肠子宫陷凹封闭导致解剖结构扭曲,游离和暴露输尿管可以尽量减少输尿管损伤[18]。如果手术者不能明确输尿管的位置将会影响手术进展,甚至造成输尿管损伤。而术中暴露输尿管让手术者了解输尿管的走向,以便他们在远离输尿管时能够快速进行手术,并在接近输尿管时小心解剖,避免损伤输尿管。其次,先凝固并切断子宫动脉、输卵管及卵巢固有韧带(如需切除附件则切断骨盆漏斗韧带),再分离粘连。由于供应子宫的主要血管都已被切断,这样分离粘连时子宫创面的出血将明显减少,从而避免了出血所导致的视野模糊不清,减少肠管损伤的可能。第三,直肠侧窝、膀胱侧窝、直肠旁间隙和直肠阴道间隙都是无血管区,只要熟悉盆腔解剖,均不难分离。分离直肠旁间隙有助于明确肠管的轮廓,并利用该间隙进入肠管与子宫后壁致密粘连下方的直肠阴道间隙,有利于最终完全分离肠管和子宫、宫颈和阴道后壁之间的紧密粘连。
本研究表明,利用腹膜后路径对直肠子宫陷凹封闭的患者进行腹腔镜全子宫切除术,手术时间、术中出血量均少于腹膜内路径组,而且无中转开腹。利用腹膜后路径术中解剖层次清晰,避免了输尿管、肠管的损伤,出血少,手术时间缩短,可以获得更安全的手术效果,因此利用此策略大多数直肠子宫陷凹封闭的患者将不必进行开腹手术。
