基于微流控芯片的细胞共培养技术研究进展
2020-05-20段肖肖刘思秀
段肖肖,刘思秀,2
(1.复旦大学 环境科学与工程系,上海 200438; 2.复旦大学 上海市大气颗粒物污染与防治重点实验室,上海 200438)
细胞-细胞间通讯是多细胞生物的基本特征[1],了解细胞与细胞之间的通讯机制对于揭示多细胞生物生理和病理过程(如免疫相互作用、癌症转移、细胞分化等)至关重要[2-3].为了研究细胞与细胞之间的相互作用,建立类似体内环境的培养体系,在细胞培养技术的基础上发展出了细胞共培养技术[4].
细胞共培养技术主要通过两种方法建立: 直接共培养体系,即将2种或2种以上的细胞同时或分别接种于同一培养孔中,不同种类的细胞之间直接接触;间接共培养体系,即将2种或2种以上的细胞分别接种于不同的孔,置于同一培养环境之中,使不同种类的细胞共用同一种培养体系而不直接接触.细胞共培养技术旨在通过细胞共培养体系以维持细胞的功能和活力,诱导细胞分化,调控细胞增殖,促进早期胚胎发育和提高代谢产物产量[5].
在原生组织和器官中,细胞存在于三维微环境中,细胞之间、细胞与胞外基质之间存在复杂的相互作用.但体外细胞共培养技术最常用的二维单层细胞培养方法只能提供集体信息,不能充分反映或复制细胞在体内的特性,无法动态观察细胞的相互作用,这使得二维培养在药物筛选和其他组织工程应用中准确性差,范围受到限制.此外,细胞间通讯的机制仍然知之甚少,且多细胞系统中细胞间通讯极其复杂,包括缝隙连接信号、旁分泌信号、内分泌信号和突触信号,传统培养模式难以准确模拟生理微环境并传递细胞间通讯的信号[6-7].为能够模拟生理微环境下复杂的细胞间通讯以研究其通讯机制,研究人员提出了一种三维体外培养方法来模拟活体细胞,该方法允许细胞在无限接近体内微环境的三维空间基质中生长、发育和交流.与二维培养相比,它不仅能通过长期的细胞培养促进细胞聚集和组织形成,还可通过调节基因和蛋白表达、增殖、分化和迁移,在三维生理相关环境中调节细胞形态、行为和功能.因此,三维细胞培养方法有望比二维单层细胞培养方法更加准确.
微流控技术允许在微米大小的通道中对流体进行空间控制,以空间可控的方式共同培养多种细胞、生成和控制信号梯度及动态灌注培养,能够实现单个细胞的精确操作、对生理相关微环境的模拟以及在不同条件下的高通量分析[6-8],甚至可以探索扩展三维培养模型的生理相关性.研究表明,三维微流控系统与二维培养系统相比具有更强的分化、自我更新和细胞功能[7,9].将微流控技术与三维细胞培养相结合已成为细胞共培养技术的研究热点.
研究表明: 基于微流控芯片的细胞共培养技术已经广泛应用于肿瘤转移及分析[10-14]、抗癌药物筛选[13-15]、药物吸收和药物代谢[15-18]等领域,有望发展为体外生理研究的三维培养模型.本文从微流控芯片上细胞共培养系统的设计、共培养系统上的检测以及模型的应用3个方面对其进行了综述.
1 微流控芯片上细胞共培养系统的设计
1.1 接触共培养

图1 微流控芯片上细胞分层接触共培养Fig.1 Cell layered contactco-culture on microfluidic chip
微流控芯片上细胞接触共培养的方式通常为共腔室,共腔室中细胞悬液混合培养或细胞分层接触培养.细胞悬液混合培养是将两种或两种以上细胞悬液直接混合,混合液接种于芯片细胞培养腔室中共培养.细胞分层接触培养通常先聚合形成细胞层,再接种其他细胞粘附在其表面与之共培养,可实现直接跨层互作的细胞间相互作用和通信(图1).Jamada等[19]采用网状培养方法,使细胞在培养过程中与培养皿底部接触,细胞的附着和生长只能发生在网格片上,从而能够精确控制细胞与底物的相互作用,TIG120成纤维细胞(Human diploid fibroblast-like cell line)接种最终形成一个单层细胞片,人脐静脉内皮细胞(Human Umbilical Vein Endothelial Cells, HUVEC)接种于TIG120单层细胞片上,实现细胞双层接触共培养.除双层细胞单层接触模式,Liu等[20]设计的中间腔室模型能进一步模拟三维肿瘤微血管结构,该模型通过将含有U87人胶质瘤细胞的转谷氨酰胺酶(Transglutaminase, TG)水凝胶注入微通道聚合后,拉出聚氨酯纤维柔性膜产生中间腔室,然后将HUVEC悬液注入中间腔室内,HUVEC粘附在U87细胞表面共培养.
1.2 非接触共培养

图2 基于微阀隔离的细胞共培养模式Fig.2 Cell co-culture mode based on microvalve isolation
微流控芯片上细胞非接触共培养既有共腔室也有独立腔室,主要通过微阀隔离、通道隔离、膜隔离的方式实现非接触培养.
微阀隔离主要通过气动驱动系统控制微阀,形成隆起隔间,从而实现腔室的连接和隔离[21].如图2所示,微流控芯片由流体层、控制层及基底组成,微阀打开时隔断腔室间连接,两种细胞分别接种在流动层上微阀两侧,微阀关闭时腔室连接,实现非接触共培养.
通道隔离可分为独立腔室隔离和共腔室隔离[22].目前用于研究细胞间通讯的微流控细胞共培养体系主要以独立腔室隔离为主,多个腔室通过微阀[22]、微阵列柱或应用流体力学[23-24]进行腔室隔离.共腔室将微流控技术与流体力学相结合,通过控制液体流量流速,中间以培养基相连接,实现共腔室细胞共培养.目前,已经开发出多种基于通道隔离的细胞共培养模式,微流控芯片上的细胞间通讯研究也从细胞群体逐渐精准到单细胞分析.独立腔室与流体力学相结合的微流控芯片[23]可在良好的层流控制基础上,细胞自动沿主通道两侧直线稳定移动被引入相邻的分离区域,形成非接触共培养模型,便于实时观察细胞行为.共腔室与流体力学相结合的微流控芯片通常由两个平行的侧通道和中间通道组成[24],中间通道的接口用于连接左通道和右通道,不同隔间边缘整齐,无细胞碎片或对细胞迁移产生不利影响的物质.除细胞群体研究外,Zhu等[25]设计了共腔室心形凹陷捕获用于单细胞分析,特别的心形凹陷设计可以在单细胞水平上有效地配对不同类型的细胞,使细胞受到的空间限制最小化.通过调整心形凹陷的数量和位置还可实现多种功能,如控制的细胞配对比率、控制细胞配对间距、形成各种单细胞阵列.
多孔膜是工业中常用的一种组分,在传统的共培养体系中得到了广泛的应用.基底膜可以由不同的材料组成,并根据微孔的不同速率和直径进行划分,允许微分子或蛋白质自由穿梭,但不允许大型细胞通过,可实现即插即用.膜隔离在双通道间通过不同材质的基底膜(聚碳酸酯膜、PE聚乙烯膜等)相连接,一种细胞在芯片底部培养,另一种细胞在膜的顶部培养[15],或者利用微流体的特性在膜的两侧进行细胞接种,芯片上的分层结构能支持细胞的长期共培养.基于膜隔离的单通道分层共培养模型不允许维持细胞与细胞的长期稳定分层,最终将类似于随机共培养单层,且许多细胞容易聚集在微通道的入口和出口,限制了其在更多生理学相关研究中的应用.而基于膜隔离的双通道共培养模型,通过增加通道高度使细胞层更加均匀,细胞的形态更加稳定.
2 细胞共培养系统的检测
细胞共培养系统的检测包括: 系统或屏障渗透性评估和细胞间互作.构建芯片上的细胞共培养系统后,需要对该共培养系统或屏障进行评估以检测该系统是否可用于研究细胞间通讯机制(图3).
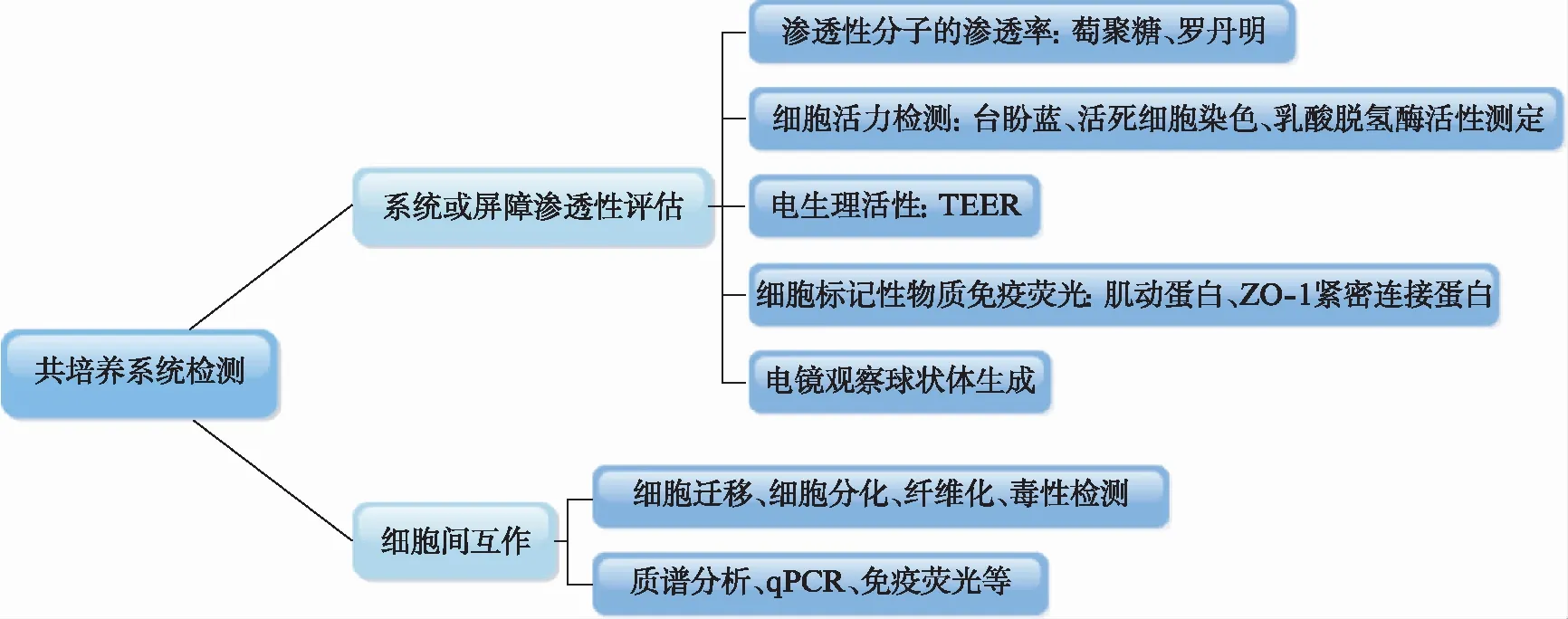
图3 共培养系统的检测Fig.3 Detection of co-culture system
现有的研究,系统或屏障渗透性评估主要包括渗透性分子的渗透率检测、细胞活力检测、电生理活性检测、细胞标记物检测及电镜观察细胞形态生成等.渗透性分子的检测可通过葡聚糖[16]、罗丹明等[20],用以检测系统中水凝胶的穿透性;细胞活力检测通过台盼蓝、噻唑蓝(3-(4,5-Dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide, MTT)比色法、活死细胞染色[26-28]等鉴定系统是否能为细胞共培养提供良好的环境;电生理活性检测主要应用于神经细胞神经元功能的特殊检测,通常采用膜片钳技术[23]、跨膜电阻(Transepithelial Electrical Resistance, TEER)[29-31]测量定量评估屏障渗透性;细胞标记物及形态学可检测共培养三维培养模式的形成.Liu等[20]通过电镜对比不同孔径的TG水凝胶结构,通过测定罗丹明在水凝胶中的扩散鉴定了系统的渗透性,并通过活死细胞检测验证了共培养系统的可行性.细胞共培养系统的功能验证可行,即可模拟原生微环境进行后续细胞间互作的研究,如细胞迁移[27,32]、细胞分化、纤维化[19]、毒性检测[15,33]等.芯片上的细胞检测迁移是细胞接收到另一细胞迁移信号影响而产生的移动,涉及血管生成、癌症转移等过程,主要通过显微镜观察迁移距离;细胞分化、纤维化主要通过细胞免疫荧光染色方法标记特定细胞,共聚焦显微镜观察分析细胞在时间和空间上的选择性表达,如细胞形态、细胞类群的变化;毒性检测通常检测互作相关信号因子的变化或用于研究靶向药物对系统的影响.Jeong等[34]通过测定成纤维细胞在培养基通道内细胞核与培养通道末端之间的迁移距离,分析成纤维细胞向三维肿瘤腔室的迁移能力.在该共培养系统中,通过比较活死细胞比例变化,研究了紫杉醇药物治疗的敏感性差异.
3 细胞共培养芯片模型的应用
在细胞共培养芯片模型的建立中,血管系统是建模最多的组织,其次是血脑屏障、气血屏障及肝模型.因此,本文针对微流控细胞共培养技术在血管生成、血脑屏障、气血屏障及肝模型的应用进行了介绍.
3.1 血管生成
血管生成芯片通常设计为微间隙,通常微间隙设计结合三维凝胶作为支架用于血管形成.该芯片结构有助于连接细胞,形成血管网络,提供更可靠的三维微环境,为临床医学和组织工程提供了良好的指导.在心血管模型建立中,为了模拟和研究流态应力,通常需要插入膜来模拟三维心血管环境,甚至将插入膜作为血管和瓣膜生物学机制研究的一部分.在共培养体系中,一些类型的癌细胞对血管形成的影响也得到了研究[13,35-36],血管网络与肿瘤发生和发展密切相关.
Liu等[20]在微流控芯片上模拟了三维肿瘤微血管结构,研究抗氧化剂对体外恶性胶质瘤细胞的作用.利用水凝胶构建三维腔内进行培养内皮细胞和胶质瘤细胞的培养,以模拟肿瘤微血管环境.以大孔明胶TG水凝胶为原料,制备了适合细胞培养和营养更新的生物力学性能良好的凝胶.Kim等[37]发现HUVECs的血管生成依赖于与人肺成纤维细胞(Lung Fibroblasts, LFs)的共培养,没有共培养LFs的HUVECs的系统不能形成相互连接的血管网络.
3.2 血脑屏障
血脑屏障是由脑内的血管内皮细胞以及星型胶质细胞、周细胞、基底膜共同构成的致密屏障结构,对于维持中枢神经系统内环境的稳定起到至关重要的作用[38].星形胶质细胞和血管内皮细胞共培养模型是最常见的神经系统及血脑屏障模型,芯片设计倾向于以微通道连接模拟轴突导向功能[39-40],芯片上血脑屏障微流体的结构主要有平面型和垂直型两种.平面微流体血脑屏障模型通常利用微柱或微通道阵列作为血液和脑侧腔之间的边界.由于这些微结构之间的间隙足够小,可以捕获任何一侧的细胞,因而两种细胞可以在微结构的两侧培养,其功能类似于垂直放置的多孔膜.垂直微流体血脑屏障模型通常使用多孔膜作为腔室血液和脑侧之间的边界.该多孔膜夹在两个微流体结构之间,一边是血管一边是脑组织.由于微通道连接可模拟轴突导向功能,因此血脑屏障的芯片设计更倾向于微通道连接.
要在体外建立脑血脑屏障的最佳模型,重要的是要模拟脑毛细血管微环境的关键物理特征,包括流体流动、细胞外基质和正常脑微血管的圆柱形几何结构.Jeong等[29]提出了一个多室微流体血脑屏障芯片,它概括了血脑屏障的关键功能星形胶质细胞毛细管界面,同时优化了生理剪切应力和细胞外基质以增加细胞的紧密连接,也允许一个芯片上同时进行多达16种不同的测试.星形胶质细胞能促进血脑屏障的形成,促进神经血管内皮细胞的成熟,促进更紧密的连接形成血脑屏障.研究表明,将小鼠内皮细胞和星形胶质细胞共培养于芯片内,外加体内水平剪切应力,可形成紧密的连接,显著降低屏障通透性.
3.3 气血屏障
气血屏障是由肺泡表面液体层、I型肺泡细胞与基膜、薄层结缔组织、毛细血管基膜与内皮等组成的组织结构,能够使肺泡与肺毛细血管紧密相连,以保证机体气体进行正常的交换[41].气血屏障的构建基于肺泡毛细血管界面的构建,系统设计通常为膜隔离非接触共培养,将肺泡细胞和血管内皮细胞共培养以构建肺泡与血管间的连接,培养采用气液暴露方式[42]模拟肺泡-毛细血管的关键功能.基于膜的分隔通道结构使其能够独立地操纵流体流动,以及细胞和营养物质的传递.此外,肺部功能涉及呼吸运动过程的细胞拉伸,在芯片上还需通过施加机械力模拟呼吸运动引起的肺泡-毛细血管界面的动态力学变形.
Dongeun等[43]构建了一个肺泡肺毛细血管单元的芯片模型,成功复制了由呼吸运动引起的肺泡-毛细血管界面的动态力学变形.在膜的两侧培养人肺泡上皮细胞和人肺微血管内皮细胞,当细胞生长成层时,空气被引入上皮间室,形成气液界面,更精确地模拟肺泡空气空间的内层.同时,该装置通过在侧腔施加真空,由压力驱动细胞微通道侧腔的变形,模拟正常吸气时肺泡上皮细胞和相邻毛细血管中紧密贴附的内皮细胞的拉伸,真空释放时弹性反冲细胞松弛到原来大小,重现生理呼吸运动.
3.4 肝模型
肝正弦波芯片是常见的肝模型,主要将肝细胞与内皮细胞共培养用于模拟肝窦的结构.芯片上肝模型微流体的结构主要为膜隔离非接触共培养.该模型可推广到多种肝脏生物学研究和与肝脏相关的疾病研究,如药物诱导的肝脏毒理学、癌症研究、各种嗜肝性感染因子的病理效应等.
研究表明,肝细胞分泌物的介质流动与胶原的动态相互作用在维持原发性肝细胞功能中发挥重要作用[44-46].因此,微流体平台上肝细胞在培养基流动灌注的条件下培养,并覆盖胶原蛋白,用来研究介质流动、胶原的产生和肝细胞功能的相互作用.Kang等[47]提出了一种新的肝脏模型,该模型模拟了大部分肝脏活动发生的肝窦的结构和微环境.该模型在芯片上设计了单通道结构和双通道结构支持肝细胞和内皮细胞共培养.单通道结构中,在原代大鼠肝细胞和内皮细胞之间添加一层薄薄的基质凝胶层,形成一层一层的共培养.双通道结构可模拟血窦,细胞在微孔膜的相对侧共培养,并加入持续灌注,低通道用于去除肝细胞的分泌因子,使肝细胞维持正常形态和类肝细胞功能至少30天.芯片上的肝正弦波与体内肝正弦波非常相似,并支持在微流体肝模型中进行长期的原发性肝细胞培养,该模型可用于肝脏疾病和肝脏毒理学的研究.
为精确模拟肝窦结构,进一步研制了一种由4种类型的原发性肝细胞在剪切流作用下组成的体外三维肝芯片[48],试图模拟肝微环境,具有良好的细胞组成和量化的物理相互作用.肝窦内皮细胞(Liver Sinusoidal Endothelial Cells, LSECs)、库普弗细胞(Kupffer Cells, KCs)、肝星状细胞(Hepatic Stellate Cells, HSCs)和肝实质细胞(hepatocytes, HCs)共培养到微流控芯片中,由多孔膜分离两个流体通道,可复制肝脏的生理细胞组成、显微结构和机械微环境.该肝芯片呈现了体内LSEC单层的特定结构,相邻细胞之间存在稀疏间隙,在两种不同流速的通道中均形成了良好的流场.剪切流暴露和肝细胞的共培养分别或协同促进白蛋白的分泌、产生以及细胞色素P450的代谢活性.同时,LSECs与其他3种肝细胞的共培养也促进了流式细胞术下中性粒细胞的募集.该肝脏芯片不仅可以作为体外肝脏基础研究的平台,还可以作为在生理相似的细胞组成、肝脏正弦结构和药物筛选的平台.
4 展 望
基于微流控芯片的细胞共培养技术能够模拟原生微环境以进行复杂的代谢和调控,为研究细胞与细胞间通讯提供了新的平台,对揭示多细胞生物生理和病理过程具有重要意义.目前,微流控芯片上细胞共培养系统的设计主要分为接触共培养和非接触共培养.接触共培养以共腔室设计为主,非接触共培养既有共腔室也有独立腔室,涉及微阀隔离、通道隔离、膜隔离的方式.构建芯片上的细胞共培养系统后,可通过渗透性分子的渗透率检测、细胞活力检测、电生理活性检测、细胞标记物检测及电镜观察细胞形态生成等对该共培养系统或屏障进行评估以检测该系统是否可用于研究细胞间通讯机制.共培养系统的功能验证可行,即可模拟原生微环境进行后续细胞通讯机制的研究,如细胞迁移、细胞分化、纤维化、毒性检测等.
随着微流控细胞共培养技术的发展,已构建了多种细胞共培养芯片模型.其中,血管系统是建模最多的组织,其次是血脑屏障、气血屏障及肝模型.微流控芯片上细胞共培养模型的建立提供了类体内组织或器官的结构,克服了传统二维细胞培养的诸多不足,可用于体外基础研究,并应用于靶向药物筛选和毒性检测等多个领域研究等.但是,由于细胞种类少、体外生理代谢系统不完整,简单的多种细胞共培养芯片模型对体内复杂的生理尺寸、微环境等难以实现更真实化的模拟,未达到真正的人体器官的功能.此外,芯片上仍需对细胞外基质的选择、剪切应力水平的调控、共培养的相互作用进行优化.随着技术的发展,芯片上细胞共培养技术正从简单的多细胞模型逐步向类器官的方向发展,以模拟生理稳态以及复杂疾病过程所需的完整的器官级功能.未来,还可以基于类器官芯片模型,通过流体连接来构建芯片上的人体系统,从而能够在系统级别上模拟多器官的相互作用和生理反应,有效应用于医学、生命科学、环境科学等领域.
