过量表达EPSPS转基因促进栽培稻与杂草稻杂种后代的叶绿素合成
2020-05-20马廷娟林凯青卢宝荣
马廷娟,原 野,林凯青,南 蓬,卢宝荣
(复旦大学 生命科学学院 生物多样性与生态工程教育部重点实验室,上海 200438)
5-烯醇式丙酮酰莽草酸-3-磷酸合酶(5-enolpyruvyshikimate-3-phosphate synthase, EPSPS)是所有植物和大部分微生物体内莽草酸途径的一个关键酶,在芳香族氨基酸的生物体合成中至关重要[1].此外,EPSPS还参与植物许多次生代谢物的合成,包括黄酮类化合物、细胞色素、生长激素等[2].当EPSPS的合成受阻或EPSPS被降解,植物的生长发育就会受到影响甚至死亡.草甘膦是许多除草剂中的有效活化学成分,可以竞争性抑制EPSPS活性,从而导致植物生长受阻,甚至死亡[3],这就是草甘膦作为一种广谱性除草剂的作用机理.抗草甘膦转基因植物的成功培育和商品化应用,使农作物产生了抗该除草剂的能力,因此在除草剂选择压下农作物能正常生长,但与此同时杂草会被除灭,提高了农作物的生产效率.
在众多利用EPSPS基因来提高草甘膦抗性的策略中[4-6],过量表达植物内源EPSPS基因就是有效的策略之一[7-9].通过过量表达来自栽培稻(水稻,Oryzasativa)的内源EPSPS基因,育种家培育出的转基因水稻品系,具有抗草甘膦除草剂的能力[7-9].然而,转基因水稻品种中过量表达的EPSPS基因通过花粉介导漂移到野生近缘种中,是否会带来潜在的生态风险,成为公众关注的生物安全问题[10].前人在对过量表达EPSPS转基因水稻与杂草稻杂种分离后代的安全评价中发现,在不施用草甘膦除草剂的情况下,不同组合中含有EPSPS转基因的杂种后代(F3)群体,其光合速率均显著高于不含转基因对照群体,表明过量表达EPSPS基因能显著提高杂种后代的光合作用速率[11].
光合作用在植物生长发育过程中具有非常重要的作用,而且光合作用的速率受到许多因素调节.光合作用除了受光系统对光能的捕捉等因素的影响之外[12],叶绿素的含量与光合作用的速率也密切相关.研究表明,在一定的范围内,叶绿素的含量越高,光合速率越高,反之亦然[13].因此,在过量表达EPSPS转基因水稻与杂草稻杂种后代中观察到的光合速率增加现象,是否与叶绿素含量的增加有关?非常值得探究.这些研究的结果,可以帮助我们从叶绿素合成途径整个通路的角度,来解析过量表达EPSPS基因与光合作用速率增加的关系,包括在叶绿素合成途径中哪些关键基因的表达量发生了变化,进而影响叶绿素含量的增加(图1).
由图1可以看出,有3个基因,即GLUTR(谷氨酰-tRNA还原酶合成基因)、CHLH(镁螯合酶亚基CHLH合成基因)以及PORA(原叶绿素酸酯还原酶A合成基因)在叶绿素合成通路中发挥关键作用,这已经得到了大量研究的证实[14-16].EPSPS基因的过量表达是否会导致这3个基因的表达量发生变化也是亟待回答的问题.
通过乙醇浸提和紫外分光光度相结合的方法,可以测定目标植物叶片中叶绿素的含量[17],而通过荧光定量PCR(qPCR)的方法,可以分析测定植物体中目标基因的相对表达量[18].对叶绿素含量的检测和基因表达量的检测,都已经有了成熟的方法.通过对含有过量表达EPSPS转基因的杂种后代群体,与其非转基因对照群体的叶绿素含量和叶绿素合成关键基因进行比较,就可以明确回答上述问题.
因此本研究的主要目的: (1) 以过量表达EPSPS的转基因栽培稻与杂草稻杂种F3代分离群体为材料,检测含转基因群体的叶绿素含量是否比非转基因群体有所增加;(2) 检测含转基因群体的叶绿素合成3个关键基因(GLUTR,CHIH,PORA)相对表达量是否比非转基因群体有所增加.上述科学问题的解答有助我们进一步理解EPSPS的过量表达为什么会导致光合速率的增加,以及其它适合度相关性状都有不同程度加强的原因.同时,也为进一步研究莽草酸途径中EPSPS的增加如何影响光合速率的分子机制奠定基础.
1 材料和方法
1.1 实验材料
本研究所选用的材料是转基因栽培稻和杂草稻杂交分离F3代分离群体,包括两个杂交组合的EPSPS转基因(WH1++和WH2++)和两个非EPSPS转基因纯合(WH1--和WH2--)群体.其中栽培稻是转基因栽培稻品系为EP3,杂草稻是来源于越南的W1和来源于韩国的W2[11].栽培稻品系EP3由福建省农业科学研究院遗传工程重点实验室提供.EP3中含有1个由中科院朱祯实验室分离自栽培稻(Minghui-W2)的内源基因EPSPS[9].EP3的获得过程是: 通过在同一个表达载体P1300上构建潮霉素抗性标记基因HPT和基因EPSPS并用农杆菌介导转化明恢86(MH-86)而得,控制EPSPS基因和标记基因HPT的启动子分别为Ubiquitin启动子和35S启动子[11].
WH1和WH2的获得过程为,将杂草稻W1和W2作为母本,EP3作为父本分别进行人工杂交,获得了2个杂交组合并含转基因的F1杂种(转基因杂合,WH1+-和WH2+-).将杂种F1进行自交分离,并通过转基因分子检测,分别获得含转基因(包括转基因杂合体和纯合体)或不含转基因的F2代群体;进一步对F2分离群体进行鉴定和筛选,获得遗传背景一致而包含EPSPS转基因(WH1++和WH2++,转基因阳性)和不含EPSPS转基因(WH1--和WH2--,转基因阴性)的纯合F3代群体,进行叶绿素含量测定和叶绿素合成途径基因的qPCR实验(表1).
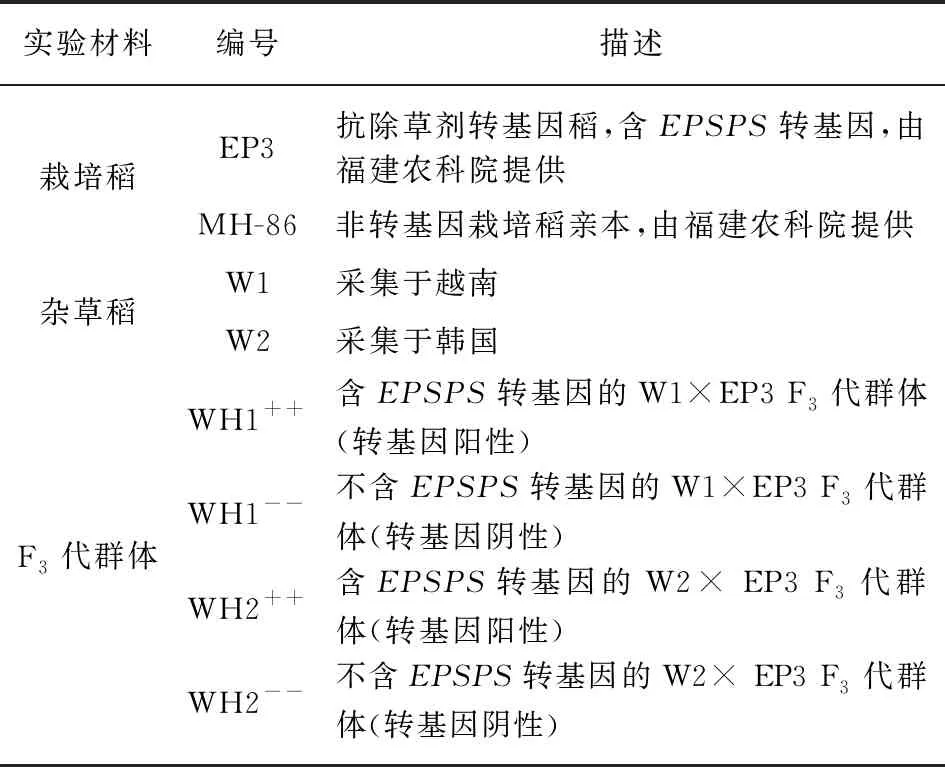
表1 本研究的实验材料和描述
前期利用RT-PCR、qPCR以及ELISA这3种不同的方法,均确认了所用实验材料的转基因阳性群体中EPSPS的表达量以及EPSPS蛋白的含量显著高于非转基因阴性群体[11].
1.2 方法
1.2.1EPSPS转基因阳性和阴性实验材料的鉴定
实验前需要将构建的栽培稻和杂草稻转基因杂种纯合后代群体和非转基因杂种纯合后代群体,用EPSPS基因特异性引物通过PCR进行筛选(正向引物: 5′-GTGGCTTCCTGGAGAGTAAAG-3′,反向引物: 5′-GTTCCTGACGAAAGTGCTTAGA-3′),确保本研究的材料严格分离为含有转基因EPSPS和不含转基因EPSPS群体.转基因阴阳性鉴定实验第一步要采用改进后的CTAB法提取叶片的总DNA[19].
在栽培稻和杂草稻转基因杂种后代中,利用EPSPS基因特异性引物能通过PCR反应在转基因阳性群体中扩增出两条带: 一条片段长度约为425bp,是水稻自身已有的EPSPS基因条带,另一条为转入的EPSPS基因条带,该外源基因不含内含子,故其扩增片段长度约为279bp.PCR反应使用的20μL反应体系中含有2×Reaction Mix 10μL,模板DNA 2μL,前后引物各1μL,Golden DNA Polymerase 0.2μL.PCR反应程序为: 94℃变性5min;94℃变性1min,55℃退火30s,72℃延伸1min,重复循环35次;最后72℃延伸7min.PCR扩增使用ABI公司2720 PCR热循环仪.实验中所用的2×Reaction Mix、Golden DNA Polymerase使用天根生化有限公司的产品,于生工生物工程(上海)有限公司合成所用引物.1.2%浓度的琼脂糖凝胶上进行PCR产物电泳,电泳后于紫外线下观察用溴化乙锭(EB)染色的胶.
1.2.2 实验设计及取样
本实验首先在黑暗环境下萌发不同来源的杂种后代组合.种子露白后移到光照培养箱培养10d,鉴定好转基因阴阳性之后移幼苗至温室培养,种植于预先填满土的50cm×40cm×15cm的塑料盆中.4组实验材料作为4个处理,每个处理按5行×4列的格局种植20株个体.总共有12个小区,每个处理分别重复种植于3个小区,每两个单株的间距设为5cm.保证温室温度在20~30℃之间(温度低于该范围时,采用人工照明光源对光照进行补偿).其中30d的材料同时测量了亲本(EP3和MH-86)作为对照.
实验材料选取两个时期,30d和60d.取样时,每种栽培稻和杂草稻转基因和非转基因杂种后代各选取30株,每个小区选取10株,剪去根部,称取植株根上部分鲜重m(g).选取5株实验材料混样作为一个样本,每种杂种后代群体重复取样6次.
1.2.3 叶绿素含量测定
采用混合液浸提法提取叶绿体色素.取水稻(培养30d和60d)根以上相同位置的叶片0.1g,剪成4~8mm的叶条,放入具塞试管中,加入混合提取液(丙酮∶乙醇=1∶1体积比混匀)至刻度,置暗箱中直接浸提叶绿体色素约48h,其间振摇2~3次,直至碎片完全变白为止[17].绿色溶液经准确定容,澄清后用NanoDrop2000c超微量紫外分光光度计分别于645nm、663nm波长下测定吸光度,计算得到叶绿素a、叶绿素b和总叶绿素平均含量(mg/g)[20].以叶绿素平均含量乘以每株地上部分鲜重m(g),估算每个植株叶绿素总量(mg).
1.2.4 基因表达量测定
本研究使用GeneMark Total RNA Purification Kit总RNA提取试剂盒TR01提取新鲜水稻植株中的总RNA.使用天根Quant cDNA第一链合成试剂盒KR-103,以新鲜水稻植株叶片总RNA为模版,反转录合成其第一链cDNA.
反转录PCR完成后,将cDNA产物进行普通PCR验证,以实验室常用的叶绿体rbcL基因跨CDS区特异性引物(正向引物5′-TTGGCAGCATTCCGAGTAAC-3′,反向引物5′-TTCATTACCTTCACGA GCAAGA-3′)进行扩增,可以植物cDNA为模板扩增出1.2kb的特异性条带,而不能以gDNA为模板进行有效扩增,因此可用于验证反转录PCR产物的质量.扩增体系和程序使用PCR通用体系和程序.

表2 用于定量检测叶绿素合成通路关键基因表达的引物
测定目标基因GLUTR、CHLH和PORA相对表达量,引物见表2.使用Vazyme品牌的2×ChamQ SYBR Color qPCR Master Mix qPCR预混液进行荧光定量扩增反应,对SYBR荧光表达数据进行分析.PCR实验操作方法参照Fang等[18].
本研究使用BIO-RAD CFX96实时荧光定量PCR仪自带系统软件可绘制扩增曲线图,自动截取阈值对应的扩增循环数(Ct值),并通过差值Ct法计算相对定量的表达差异(N为阳性个体中的表达量与阴性个体中的表达量之比值):N=2-ΔΔCt.
1.2.5 数据分析
采用独立样本t检验分析EPSPS转基因对栽培稻杂草稻杂交后代叶绿素含量以及叶绿素合成相关基因表达量的影响.本研究数据统计和分析软件采用Microsoft Excel 2016和IBM SPSS Statistics 19.
2 结果与分析
2.1 EPSPS转基因阳性和阴性实验材料的鉴定
利用EPSPS基因特异性引物通过PCR扩增后电泳鉴定,结果表明: 转基因阴性材料只有一个固有条带(425bp),而转基因阳性材料有2个条带(425bp固有条带和279bp转基因条带)(图2).
2.2 含EPSPS转基因与不含转基因杂种后代的叶绿素含量比较
叶绿素检测实验结果表明,在两个EPSPS转基因稻与杂草稻杂交组合(WH1和WH2)的杂种F3分离群体中,含有EPSPS转基因群体(转基因阳性: WH1++和WH2++)在不同时期(种子萌发后30d和60d),幼苗叶片中的叶绿素a和b的含量以及叶绿素总量均显著高于不含EPSPS转基因的群体(转基因阴性: WH1--和WH2--)(图3,图4).
在种子萌发后生长30d的转基因阳性(WH1++和WH2++)幼苗叶片中,叶绿素a的含量分别为0.188mg和0.116mg;而叶绿素b的含量分别为0.041mg和0.036mg.在转基因阴性(WH1--和WH2--)幼苗叶片中,叶绿素a含量分别为0.102mg和0.101mg;而叶绿素b的含量分别为0.020mg和0.023mg(图3).在种子萌发后生长至60d的转基因阳性(WH1++和WH2++)幼苗叶片中,叶绿素a含量分别为7.151mg和4.900mg;而叶绿素b含量分别为2.350mg和1.580mg.转基因阴性幼苗(WH1--和WH2--)的叶绿素a含量分别为4.132mg和3.232mg;而叶绿素b的含量分别为1.365mg和1.051mg(图3).
在种子萌发后生长30d的转基因阳性(WH1++和WH2++)幼苗叶片中,叶绿素总量分别为0.228mg和0.152mg,而转基因阴性(WH1--和WH2--)幼苗的叶绿素总量分别为0.122mg 和0.124mg(图3).在种子萌发后生长至60d的转基因阳性(WH1++和WH2++)幼苗叶片中,叶绿素总量分别为9.500mg和6.480mg,而转基因阴性幼苗(WH1--和WH2--)的叶绿素总量分别为5.497mg和4.283mg(图4).
作为含有EPSPS转基因的栽培稻杂交亲本对照(EP3),其种子萌发后生长至30d幼苗的叶绿素a、叶绿素b以及叶绿素总量分别为0.125mg、0.034mg和0.159mg,均显著高于EP3的非转基因亲本栽培稻品种(MH-86)的幼苗,其叶绿素a、叶绿素b以及叶绿素总量分别为0.093mg、0.024mg、0.117mg(图5,见第190页).表明EPSPS转基因增加了栽培稻(EP3)以及栽培稻与杂草稻杂交后代的叶绿素含量.
2.3 含转基因和不含转基因杂种后代叶绿素合成关键基因的表达量
荧光定量PCR检测的实验结果表明,在EPSPS转基因栽培稻与杂草稻两个杂交组合(WH1和WH2)的杂种F3群体中,多数含有EPSPS转基因的分离群体(WH1++和WH2++),其叶绿素合成的3个关键基因(GLUTR、PORA和CHLH)表达量显著高于不含EPSPS转基因的群体(WH1--和WH2--)(图6,见第190页).
GLUTR基因的表达量,在一个转基因阳性群体(WH2+)中极显著高于其转基因阴性群体(WH2--),而在另一个转基因阳性群体(WH1++)中略高于其转基因阴性群体(WH1-),但没有显著差异.PORA基因的表达量,在两个转基因阳性(WH1++和WH2++)群体均极显著高于其转基因阴性(WH1--和WH2--)群体.CHLH基因的表达量,在一个转基因阳性群体(WH2++)中显著高于其转基因阴性群体(WH2--),而在另一个转基因阳性群体(WH1++)中略高于其转基因阴性群体(WH1--),但没有显著差异.
3 讨 论
本研究对叶绿素含量检测结果显示,与不含转基因的栽培稻×杂草稻F3杂种后代群体(WH--,对照)相比,含有过量表达EPSPS转基因的杂种后代分离群体(WH++)的叶绿素a和b含量以及叶绿素总量均有显著增加.同时,也观察到在不同组合杂种后代的分离群体中,叶绿素含量(包括总量、a和b)存在一定变异.与非转基因对照相比,培养至60d的WH1组合EPSPS转基因分离阳性群体中,叶绿素a和b的含量分别增加了73.06%和72.16%;而在WH2组合的EPSPS转基因分离阳性群体中,叶绿素a和b的含量分别增加了51.61%和50.33%.因此,EPSPS转基因分离群体的总叶绿素的含量也随之显著增加.上述结果表明,过量表达EPSPS基因能够提高栽培稻×杂草稻杂种的叶绿素的含量.
另外,作为F3杂种后代的转基因栽培稻(EP3)亲本以及培育EP3的非转基因栽培稻亲本(MH86),它们之间的叶绿素含量差异,也呈现与转基因阳性(WH++)和转基因阴性(WH--)杂种后代相似的趋势.这些结果均从不同的角度说明,含EPSPS转基因的群体中叶绿素含量增加,是因过量表达的EPSPS转基因而导致,并非由栽培稻×杂草稻的杂交过程所致.
上述系列结果充分说明,过量表达EPSPS基因能够有效提高转基因水稻与杂草稻杂种群体的叶绿素含量.因此而推论,前人观察到的过量表达EPSPS转基因栽培稻×杂草稻杂种后代群体光合速率的增加,可能与叶绿素含量的增加密切相关.上述推论是因为转基因阳性(WH++)和转基因阴性(WH--)杂种F3后代群体是由相同的杂交组合分离而形成,WH++和WH--群体之间的遗传背景一致,理论上它们的唯一差异,即是否含有过量表达的EPSPS转基因.因此,上述结果很好地回答了我们提出的第一个问题,即过量表达EPSPS基因可提高水稻叶绿素的含量,进而导致转基因杂种后代的光合速率增加[11].
根据前人研究结果,植物叶绿素含量的增加与叶绿素合成途径中编码关键酶的基因表达量上升有关[14],其中谷氨酰-tRNA还原酶基因(GLUTR)、镁螯合酶亚基CHLH合成基因(CHLH)以及原叶绿素酸酯还原酶基因(PORA)就是编码叶绿素合成途径中3个关键酶的基因[21].我们的实验结果显示,含有过量表达EPSPS转基因的栽培稻×杂草稻杂种后代(F3)群体,其叶绿素合成途径中的这3个关键基因,即GLUTR,CHLH和PORA的表达,均显著高于不含转基因的对照杂种后代群体.这些研究结果明确地回答了我们的第二个问题,即EPSPS基因的过量表达会使GLUTR,CHLH和PORA这3个叶绿素合成关键基因表达上调,从而提高了植株的叶绿素含量.
上述结果也合理解释了Wang等(2014)的发现,即含有过量表达EPSPS转基因的栽培稻与杂草稻杂种后代中光合速率显著高于不含EPSPS转基因的杂种后代,进而导致总体适合度的增加[11].由图1展示的叶绿素合成途径,我们可以得出如下推论,在转基因栽培稻与杂草稻杂种后代中,EPSPS基因的过量表达提高了杂种植株叶绿素合成通路上叶绿素合成关键基因的表达量,如GLUTR,CHLH和PORA基因,因而促进了叶绿素的合成,提高了叶绿素的含量.我们检测到的叶绿素含量增加,至少是导致光合作用速率提高的一种原因,植物通过提高光合作用提供了更充足的能量来源,于是就增加了转基因杂种植株的适合度[11].
根据前人的研究结果显示,谷氨酸是叶绿素合成途径的前体,是调控叶绿素合成途径的关键起始物质[22],而植物中的谷氨酸又是三羧酸循环通路中的产物之一,即谷氨酸由三羧酸循环的中间产物α-酮戊二酸合成[23].我们初步的实验分析结果显示,过量表达EPSPS的转基因阳性杂种群体,其L-谷氨酸含量高于转基因阴性的杂种群体(数据未显示).因此,深入研究含有过量表达EPSPS转基因的杂种后代中L-谷氨酸的含量,以及调控谷氨酸合成基因的表达量,对于进一步阐明叶绿素的合成机制、光合作用效率提高、以及揭示莽草酸与三羧酸循环之间的关系均具有重要的价值.通常EPSPS参与莽草酸合成途径中分支酸的合成,并进入下游芳香族氨基酸的合成[1].EPSPS基因过表达可以提高包括色氨酸在内的芳香族氨基酸和生长素合成速率[18],其下游的苯丙氨酸和酪氨酸含量的增加,会直接提高酪氨酸代谢通路下游的延胡索酸合成[24].延胡索酸进入三羧酸循环之后,会提高α-酮戊二酸以及叶绿素合成前体物质谷氨酸的合成速率.基于上述结果我们推测,EPSPS基因的过量表达可能是通过其产物苯丙氨酸和酪氨酸的提高或其它途径,加速了三羧酸循环的反应速率,增加了α-酮戊二酸和谷氨酸合成,进而加快了叶绿素合成并增加了光和作用的速率.这个推论还有待于实验的进一步证实.
一直以来,针对植物EPSPS基因的研究,主要集中于其表达产物EPSPS带来的抗除草剂特性、抗逆性改变[25-28]、以及EPSPS基因在植物中的进化等[29].极少有针对EPSPS基因过表达提高植物光合速率的研究,对其机制的研究目前尚未开展.本文首次揭示了水稻内源EPSPS基因的过量表达,导致叶绿素合成速率增加以及与叶绿素合成相关基因表达上调的现象.本研究结果从叶绿素合成的角度,很好解释了前人在EPSPS转基因水稻×杂草稻杂种后代(F3)中检测到光合速率提高以及适合度性状增强的现象,从分子层面初步揭示了EPSPS基因过表达对植物光合速率的影响的可能原因.同时,本研究还提出了新的假设,即: 在莽草酸通路中EPSPS基因的过量表达可能通过芳香族氨基酸产物的增加,提升三羧酸循环反应速度和中间代谢产物合成,特别是增加了α-酮戊二酸和谷氨酸的合成,进而影响叶绿素合成途径,提高植物的叶绿素含量和光合速率.尽管这一假设仍需更多的实验予以验证,但过量产生EPSPS如何通过莽草酸途径下游芳香族氨基酸等代谢产物的提高,影响三羧酸循环途径及其代谢产物合成,进而提高植物光合速率这一过程的进一步深入研究,将为揭示植物莽草酸途径和三羧酸循环两个重要的代谢通路的联系奠定基础.同时,通过植物内源EPSPS基因的修饰或过表达,可提高农作物的光合作用和产量,这是一种提高产量的农作物育种新思路,具有一定的应用前景和经济价值.
