3D打印微流控芯片技术研究进展
2016-11-19范一强王玫张亚军
范一强 王玫 张亚军

摘 要 近年来,微流控技术在生命科学和医学诊断等领域得到广泛的应用,显示出了其在检测速度、精度以及试剂损耗等方面相比传统方法的显著优势。然而,使用从半导体加工技术继承而来的微加工技术制作微流控芯片具有比较高的资金和技术门槛,在一定程度上阻碍了微流控技术的推广和应用。近年来随着3D打印技术的兴起,越来越多的研究者尝试使用3D打印技术加工微流控芯片。相比于传统的微加工技术,3D打印微流控芯片技术显示出了其设计加工快速、材料适应性广、成本低廉等优势。本文针对近年来国内外在3D打印微流控芯片领域的最新进展进行了综述,着重介绍了采用微立体光刻、熔融沉积成型以及喷墨打印等3D打印技术加工制作微流控芯片的方法,以及这些微流控芯片在分析化学、生命科学、医学诊断等领域的应用,并对3D打印微流控芯片技术未来的发展进行了展望。
关键词 微流控; 3D打印; 细胞生物学; 评述
1 引 言
微流控(Microfluidics)一词出现在20世纪90年代初,指的是在微米尺度上操作和控制流体的技术[1]。经过二十多年的发展,微流控技术从最初的单一功能的流体控制器件发展到了现在的多功能集成、应用非常广泛的微流控芯片技术,在分析化学[2,3]、医学诊断[4,5]、细胞筛选[6,7]、基因分析[8,9]、药物输运[10,11]等领域得到了广泛应用。相比于传统方法,微流控技术具有体积小、检测速度快、试剂用量小、成本低、多功能集成、通量高等特点。
目前,用于制作微流控芯片的微加工技术大多继承自半导体工业,其加工过程工序繁多,且依赖于价格高昂的先进设备。在微流控芯片的制作中常用的加工方法包括:硅/聚合物表面微加工[12](Surface Micromachining)、软印[13](Softlithography)、压印[14](Embossing)、注射成型[15](Injection modelling)、激光烧蚀[16](Laser ablation)等。这些加工过程都需要在超净间内完成,工序复杂,需占用大量空间, 且需要富有经验的设计和加工人员[17]。
近年来,随着3D打印技术的兴起,越来越多的研究者尝试采用3D打印技术直接打印制作微流控芯片,或者打印出可以使用PDMS倒模的微流控芯片的模具。采用3D打印技术,可以显著简化微流控芯片的加工过程,在打印材料的选择上也非常灵活,除了各种聚合物材料外,还可以直接打印生物材料[18,19]。一般情况下,微流控芯片的3D打印过程只需在设计完成后直接打印微流控芯片即可,相比于其它微加工技术,极大地降低了微流控芯片的技术门槛和加工成本,对微流控芯片技术的推广应用有着非常积极的意义。近年来,3D打印微流控芯片技术在生物医学检测领域的应用发展迅速,出现了很多用于细胞分析检测[20~22]、药物输运[23]、生物传感[24,25]等领域的3D打印微流控芯片。
(A)微流控领域收录在Web of Science核心合集的文献数量;(B)3D打印微流控技术领域收录在Web of Science核心合集的文献数量。
(A) Publications indexed in Web of Science Core for microfluidics; (B) Publications indexed in Web of Science Core for 3D printed microfluidics.
图1展示了从2004年到2015年11月,收录在Web of Science核心合集中的微流控技术领域的文献数量以及3D打印微流控芯片领域的文献数量。可以看到,在此期间微流控技术得到了快速稳步发展;同时,3D打印微流控芯片技术的发展也是方兴未艾,2013年以来增速逐步加快。
本文将着重介绍近年来几种发展较快和较为常见的3D打印微流控芯片技术,包括微立体光刻技术、熔融沉积成型技术以及3D喷墨打印技术,对这几种技术在分析化学、生物医学检测等领域的应用进行了综述,并对3D打印微流控芯片技术在未来的发展进行了展望。
2 3D打印微流控芯片技术简介
2.1微立体光刻技术在微流控芯片加工中的应用
微流控芯片的加工技术大多脱胎于半导体制造技术。然而,可用于微流控芯片加工的微立体光刻技术(μSL)却是源自于工业设计领域的立体光刻技术(Stereolithography, SLA)。微立体光刻技术是通过控制曝光光源,对光敏树脂进行逐层曝光固化、层层叠加而形成的三维立体结构。虽然微立体光刻技术并没有真的“打印”出需要的结构,但是其通过对液体光敏树脂的选择性逐层固化来实现微器件的加工过程非常类似于3D打印,所以本文也将微立体光刻技术归于可用于3D打印微流控芯片的技术之一。
立体光刻技术从诞生到现在已经有三十余年的历史[26]。早期的立体光刻技术,由于精度的限制,不适用于微加工领域。近年来,随着技术的进步,立体光刻技术被逐渐应用于微加工领域,常见的台式微立体光刻设备已经能够达到200 μm的精度[27,28]。新近出现的基于双光子聚合效应(Twophoton polymerization, 2pp)的微立体光刻技术[29,30],可以将精度提高10 μm。
由于制造方法便捷和拥有较高的精度,越来越多的研究者开始将微立体光刻技术应用于微流控芯片的加工中。同时,可用于微立体光刻的光源也不仅限于紫外光源(UV)[26,31,32],很多研究者开始尝试使用LED[33,34]、激光[35~37]等作为固化光敏树脂的光源。伴随着曝光光源的多样化,可用于微立体光刻的光敏树脂也不再局限于紫外光敏感的环氧树脂类和丙烯酸酯类聚合物材料,近年来, 研究者开始尝试使用聚富马酸二羟丙酯(PPF)、富马酸二乙酯(DEF)[38]、Accura60[39]等新型聚合物材料。
图2分别显示了通过传统的微加工方法和微立体光刻法加工微流控芯片的过程。常见的基于聚合物材料的微流控芯片的加工过程如图2a所示,第一步是制作模具,利用光刻等手段对旋涂在玻璃片或者硅片上的光刻胶进行加工,常用的光刻胶如SU8[40]等。第二步是利用第一步制成的模具倒模,常见的用于微流控芯片的倒模材料有PDMS等。对于具有多层结构的微流控芯片来说,每一层结构的加工都需要重复上面提到的两步。第三步需要键合另外一层材料对流道进行封闭。对基于PDMS材料的微流控芯片,键合前还需要对PDMS表面使用等离子体[41]或紫外光[42]进行表面改性,随后键合一层玻璃基底封闭微流道。最后还要加工微流道出入口的开孔,一般是利用专用的打孔机或者激光完成。
相比于上述的传统的微加工方法,微立体光刻法只需一步就可以完成整个微流控芯片的制造过程,如图2b所示。实际加工过程中,三维的微流控芯片结构通过计算机转换为具有特定厚度的截面数据,然后通过精密控制的紫外光、LED或者激光对光敏树脂进行曝光固化,同时通过升降台控制厚度,进而实现整个3D微流控芯片的加工。微流控芯片中的微通道、芯片出入口的开孔、微流道的封闭全都在同一个步骤中实现,显著提高了效率,减少了传统加工方法中人为因素造成的误差。
图3显示了Shallan等使用微立体光刻技术制作的一个浓度梯度产生器[28],芯片加工使用的是精度为50 μm的微立体光刻打印机(Miicraft, Taiwan)。为了便于观察浓度梯度,两入口处的甲醇溶液分别被染为红色和蓝色,共通过5次的分离和混合后,产生了沿着主流道垂直方向均匀分布的浓度梯度。流道的宽度为1000 μm,深度为500 μm,如果采用传统的光刻方法,制作同样具有五层结构的浓度梯度产生器,需要对其中表面有微结构的四层分别进行加工,每层都需要重复涂胶对准曝光冲洗过程。而使用微立体光刻技术可以一次性成型,成本极低,每块芯片的成本只需要5美元,整个加工过程也只需要210 min。
双光子聚合效应也被称为双光子吸收聚合效应(Twophoton absorption, TPA或TPP),可以显著提高微立体光刻的精度。实践证明,吸收单个光子的能量难以引发聚合物单体的聚合反应,而双光子却拥有足够能量激发聚合反应[43]。双光子聚合效应正是利用了这一点,使用激光聚焦引发聚焦点处的材料发生聚合反应,通过控制聚焦点和激光的扫描路径,完成微立体光刻的过程[29]。常见的通过双光子聚合效应加工微流控芯片所使用的光敏树脂有SU8[30]、SCR500[44]等。
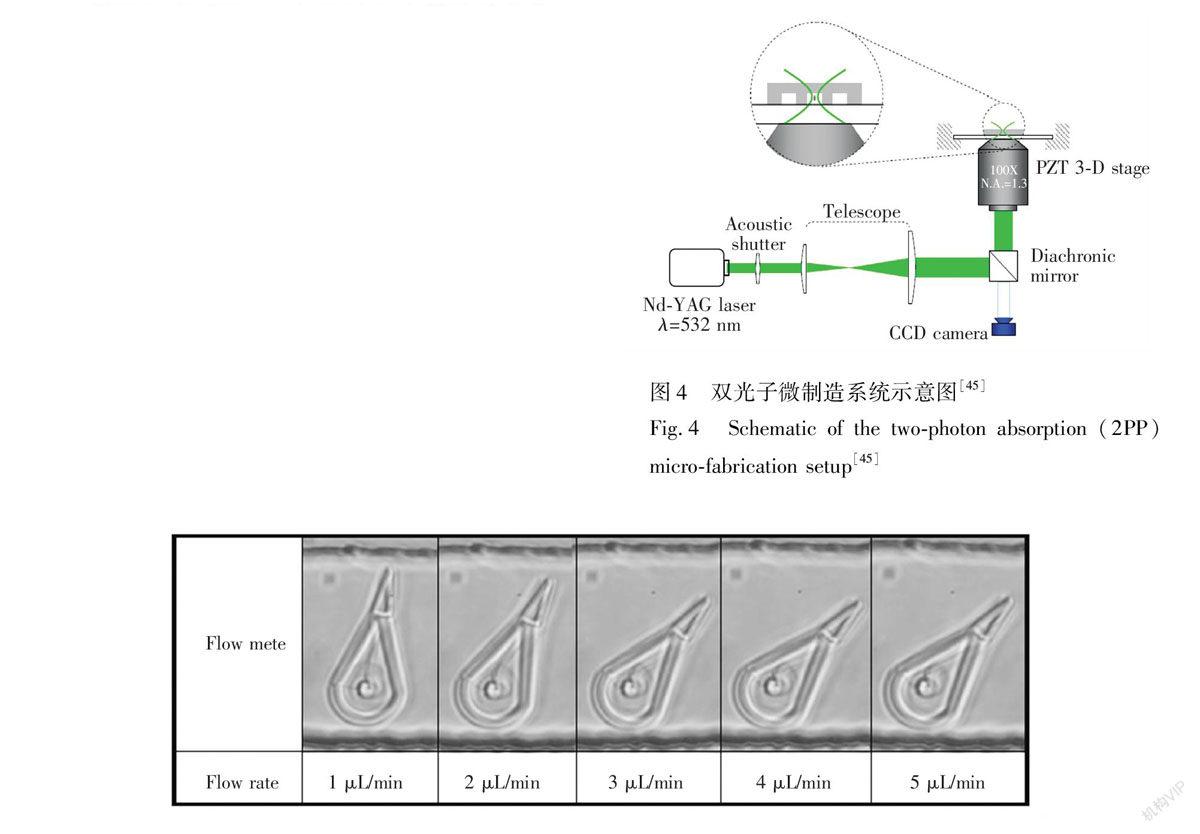
典型的双光子聚合效应微立体光刻系统如图4所示[45],双光子的激发源采用Nd:YAG绿光激光器,激光中心波长为532 nm,聚焦点的能量为0.15 mW,曝光时间为1 ms。激光通过光路开关进入倒置显微镜后,经过滤光、扩束,最后由一个数值孔径(NA)为1.3的透镜对光束进行聚焦。聚焦后的激光在光敏树脂中的三维扫描是通过载着光敏树脂平台的移动实现。载着光敏树脂的平台通过压电效应,可以实现在3个方向上的微距移动,精度很高(步距1 nm)。
图5显示的是使用双光子聚合微立体光刻方法加工的基于Photomer 3015光敏树脂的流量计[45]。得益于双光子聚合微立体光刻法较高的精度,此流量计的长度只有30 μm,宽度只有15 μm。此流量计放置于微通道中,通过观察流量计在微通道中的偏转情况,可以测得最小流量为1 μL/min,在实际测量中,微通道中的流量数据可以比照标准得知。
近年来,还出现了基于数字微镜(Digital micromirror device, DMD)装置的数字光处理(Digital light processing, DLP)3D打印机,相比于传统的微立体光刻打印机,打印速度和准确性进一步提高。在3D打印过程中,激光照射到一个由MEMS技术加工而成的微镜阵列上,通过微镜阵列对激光反射的控制达到选择性曝光光刻胶的目的。Spivey等研究者使用基于DLP技术的3D打印机加工了用于研究细胞衰老的微流控芯片,精度可以达到4 μm[46]。目前采用基于DLP技术的3D打印机加工微流控芯片的报道还很少,相信未来将是3D打印微流控芯片的重要发展方向之一。
2.2 熔融沉积成型3D打印技术在微流控芯片加工中的应用
熔融沉积成型技术(Fused deposition modeling, FDM)最早在1994年由Crump提出[47]。到目前为止,基于FDM原理,将加热软化的聚合物材料熔丝逐层打印的技术是使用最为广泛、商业化程度最高的3D打印技术之一。在各类3D打印技术的实际应用中,大部分低成本的3D打印机都是基于此项技术。在部分文献中,熔融沉积成型技术又被成为熔丝制造技术(Fused filament fabrication, FFF)[48,49]。
与其它种类的3D打印微流控芯片技术相比,在材料的选择上,FDM技术具有广泛的适应性。理论上,几乎所有的热塑性聚合物材料都可以用于熔融沉积成型技术。材料的广泛适应性给FDM技术在3D打印微流控芯片中的应用带来了很大的优势,使用中可以根据实验的实际需要(物理/化学性质、生物兼容性、抗腐蚀等)灵活选择聚合物材料,甚至可以通过更换熔丝实现由不同种聚合物材料层叠打印而成的微流控芯片。在实际的应用中,FDM技术经常使用的聚合物材料有PC[50]、PP[51]、PLA[52,53]以及工程塑料ABS[54]等,根据实际应用的特殊要求,甚至可以打印糖[55]、陶瓷[56]等特殊材料。
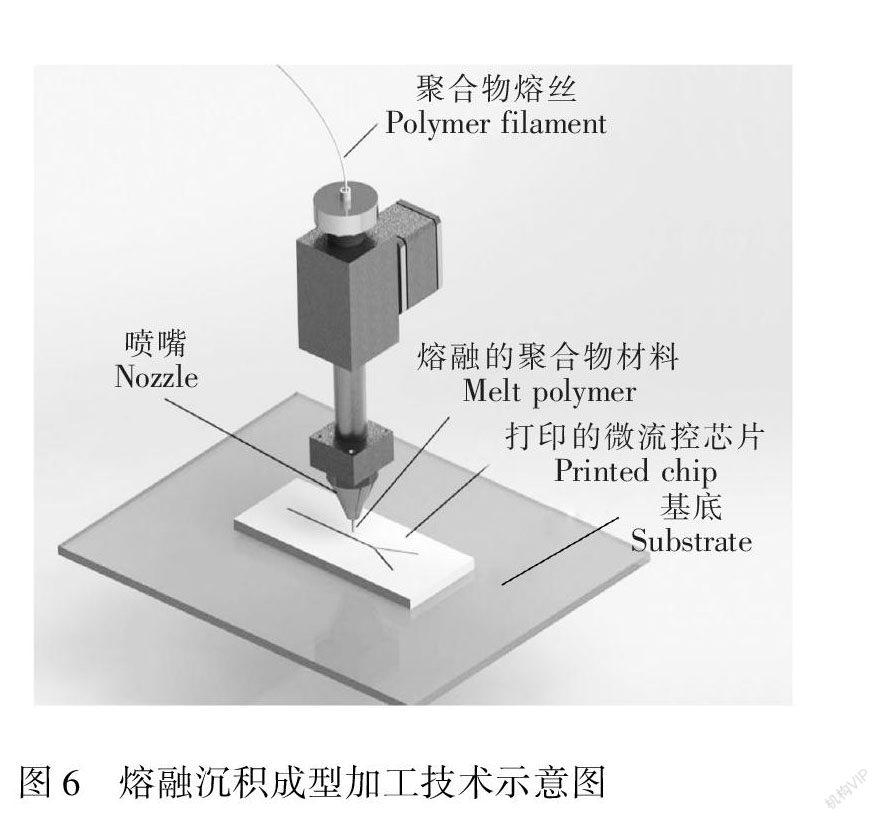
图6 熔融沉积成型加工技术示意图
Fig.6 Schematic of the fused deposition modeling (FDM) process
使用基于FDM的3D打印技术,需要对构建好的3D模型使用软件逐层解剖,每层的厚度根据打印机的不同从0.1~1.0 mm不等,然后软件对每层分别进行运算,规划喷头的合理运动路径。典型的FDM的加工过程如图6所示,聚合物材料的线材通过齿轮等机构被送入具有加热装置的金属喷头,聚合物材料被加热到玻璃转换温度以上,软化了的聚合物材料熔丝从喷头喷出到底板上降温固化成型。一般基于FDM的3D打印设备的熔丝喷头可以同时在3个方向上运动,通过熔丝的层层堆叠形成三维的结构。为了防止已打印的材料在降温过程中发生翘曲[57],有的熔融沉积成型打印装置配备了可以加热的底板。一些较为先进的熔融沉积成型打印装置甚至还配备了两个或者多个打印喷头,可以对不同种类的聚合物材料同时进行打印。
Wang等[58]使用熔融沉积成型3D打印设备(FDM3000),加工了基于ABS材料的微流控芯片,如图7所示。在微流控芯片的打印过程中,逐层打印的层高为178~356 μm,实际精度为±127 μm,作者指出,使用这种3D打印设备和ABS材料,可以非常容易加工出宽度和深度为500 μm左右的微流道。
图7 熔融沉积成型加工的微流控器件[58]
Fig.7 Microfluidic device fabricated by FDM[58]
He等[55]将熔融沉积成型3D打印机的喷头部分进行了改造,使之能通过双喷头分别打印加热后的糖纤维和液态的PDMS,其中PDMS作为打印3D结构时糖纤维的辅助支撑材料。通过这种方法加工微流控芯片的典型过程如图8所示, 使用这种方法制作微流控芯片的过程简单快捷, 成本低廉,且加工出的微流控芯片非常适于在生命科学等领域的应用。
图8 熔融沉积成型3D打印微流控芯片的过程: (a)打印基于糖材料的2D/3D模具; (b) 将液态PDMS倾倒在模具上成型固化; (c) 将糖移除, 形成微流道[55]
Fig.8 Fabrication procedures by FDM: (a) Direct 2D or 3D sugar structures are printed. (b) PDMS is poured on the structures and cured. (c) Sugar structures are removed, and microfluidic chips are obtained without further sealing[55]
基于FDM的3D打印技术在微流控芯片的加工领域显示了其对加工材料的广泛适应性以及在生命科学、化学领域的良好应用前景, 然而还存在一些缺陷需要改进克服。首先是打印精度的问题,这涉及到在水平面中(xy)方向上的打印精度和层高(z)方向上的精度两个方面,在同一水平面上的打印精度受喷嘴大小以及步进电机精度的影响,一般在200~500 μm左右。Wang等[59]通过提前加热聚合物材料等方法,将精度提高到了100 μm;在层高方面,目前较为常用的FDM打印机z轴精度在100~500 μm,但还不能完全满足微流控芯片中微通道的高度要求。另外,通过FDM技术打印的微流控芯片在微通道的表面粗糙度和壁面的垂直度相对其它加工方法也有一定劣势[57],这些都是在今后的研究中亟待解决的问题。
2.3 喷墨3D打印技术在微流控芯片加工中的应用
喷墨3D打印技术(Inkjet 3D printing)最早由Bonyr等提出[60],与普通的喷墨打印机原理类似,都是通过打印机的喷头阵列将墨水小液滴喷出附着在底板上。与普通喷墨打印机不同的是,喷墨3D打印技术一般是将光敏树脂的小微滴打印在底板上,在打印的同时,通过安装在喷头上的UV光源对树脂进行固化。与之前介绍过的FDM技术类似,喷墨3D打印技术也是通过逐层打印的方法加工出三维的结构。
图9显示了采用喷墨3D打印技术制作出的微流控芯片模具(黄色)以及倒模而成的基于PDMS材料的微流控芯片,应用于生物样本混合和运输[60]。使用的是在喷墨3D打印技术领域获得广泛认可的Eden系列喷墨3D打印机(以色列Objet公司),使用FullCure 720光敏树脂以及FullCure 705支撑材料,可以实现在xy平面40 μm的精度,以及z方向上16 μm的精度,可以满足绝大多数情况下微流控芯片的精度要求。需要指出的是,实际打印结构的精度不仅取决于机械系统在xy和z面上的运动精度,还取决于最小可喷出液滴的大小[61]。
图9 喷墨3D打印技术打印出的模具和经过倒模的基于PDMS材料的微流控器件[60]
Fig.9 Microfluidics device fabricated using inkjet 3D printing technology[60]
3 3D打印微流控系统的应用
采用3D打印技术加工的微流控系统在细胞生物学[46]、基因诊断[52]、医学检测[24,62]等方面有着广泛的应用。基于3D打印的微流控芯片加工技术具有传统微加工技术无法比拟的灵活性,通常整个设计加工过程可以在很短时间内完成,对于生命科学和医学的研究需要具有很强的适应性。另一方面,3D打印技术的应用显著降低了微流控系统的成本,对基于微流控系统的医学诊断技术等在不发达/欠发达国家和地区的推广应用有着非常积极的意义。
Spivey等[46]使用自制的基于DLP技术的3D打印机加工了PEGDA (Polyethylene glycol diacrylate)材料的模具,并使用PDMS进行倒模,制成了用于研究酵母菌细胞衰老的微流控芯片。如图10所示,含有细胞的溶液在微流控芯片的中央通道通过时,通过流道中微结构实现对特定大小酵母菌的捕获,可以同时对数百个杆状的酵母菌细胞进行捕捉和观察。对于体积更小的大肠杆菌等细菌,Lee等[63]采用3D打印技术加工了具有螺旋形流道的微流控系统(图11),并利用液体惯性和磁场的交互作用对牛奶中与抗体结合的大肠杆菌进行了分离。除此之外,Heger等[25]还使用了3D打印的微流控芯片系统对作为肿瘤标志物的金属硫因蛋白(MTs)进行了分离和荧光检测[25]。
为了防止交叉污染,在医学诊断等领域中应用的微流控芯片都是一次性使用的,为了尽量减少患者
图11 3D打印加工完成的细菌捕获分离微流控芯片 (A) 使用惯性流动对细菌进行捕获和分离; (B)截面为不规则四边形的微流道; (C) 加工完成的微流控装置的照片[63]
Fig.11 3D printed microfluidic device for bacteria separation. (A) Schematic illustration of separation of captured bacteria by inertial focusing; (B) Illustration of channel with trapezoid crosssection; (C) Photograph of 3D printed device [63]
图10 裂殖酵母的生命周期研究系统(A)细胞从中间的沟道中进入微流控装置 (B)用于PDMS倒模的PEDGA模具[46]
Fig.10 Schematic of fission yeast lifetime microdissector. (A) Cells in solution enter the device through a central trench; (B) polyethylene glycol diacrylate (PEGDA) master structure used to generate a PDMS[46]
图12 用于多重生物样本检测和液体操控的纸基3D打印微流控芯片[64]
Fig.12 Paperbased 3D printed microfluidic device for multiple bioassays and fluidic manipulation [64]
经济负担,应大力降低微流控芯片的成本。在超低成本微流控芯片加工领域,3D打印技术也显示出了其独特的优势。图12展示了一种应用于多重生物样本检测的纸基3D微流控芯片[64],整块芯片由一张层析纸打印而成,打印过程中采用了富士施乐公司的蜡打印机,通过打印在纸张上蜡的图案构成了储液池和微流道。使用过程中,在储液池(上层)中添加生物试剂,将待检测生物样品添加到下层储液池中,待下层样品通过毛细作用布满流道后, 将纸张折叠,使生物试剂与待测生物样品结合,通过显色完成检测。在这项工作,创新性地使用了折叠的办法,将2D微流控芯片变成了3D的微流控芯片,达到了超低成本检测的目的。
4 总结和展望
从目前技术的发展情况看,可供选择的3D打印微流控芯片技术很多,在实际应用中对3D打印微流控芯片技术的选择,应该从加工成本、材料成本、加工精度、材料的生物兼容性、材料的耐化学腐蚀等等方面综合考虑。
微立体光刻技术作为出现比较早、较为成熟的3D打印微流控芯片加工技术,具有打印精度较高、可以采用多种光敏树脂的特点,其缺点是打印完成之后需要加热固化处理,去除支撑性材料等后续工作,加工过程较为复杂。基于双光子聚合效应的3D打印微流控芯片技术是本文介绍的几种加工技术中精度最高的,但是其对光源的要求高,设备成本高昂,打印速度较慢,适用于需要高精度微流控芯片的应用。
图13 3D打印微流控芯片技术中使用到的各种材料的文字云图,文字的大小基于使用该种材料在3D打印微流控芯片领域的论文数量,为了增强可视化,FullCare和Accura60两种材料的文字分别放大了20和35倍
Fig.13 Word cloud for the materials used in the 3D printed microfluidics, the size of the font is based on the counting of the relevant publications, the data is based on the data mining result from Google Scholar. To ensure the visibility, the font size of FullCare and Accura60 has been enlarged 20 and 35 times, respectively基于数字微镜技术的微立体光刻技术精度较高且成本相对低廉,将是未来微立体光刻技术发展的主流技术。
相对于其它几种3D打印微流控芯片技术熔融沉积成型技术的成本最低、材料适应性最广,几乎所有热塑性聚合物材料都可以使用此技术。基于熔融沉积成型的较为成熟的商业化3D打印机也很多。但是,熔融沉积成型的最大缺点是精度较低,表面平整度不佳,比较适于制作一次性使用的且精度要求不高的微流控芯片。
图13的文字云图(Word cloud)中,包含了10种常见的应用于3D打印微流控芯片技术的材料。代表每种材料的文字的大小与这种材料在与3D打印微流控芯片相关的文献中出现的频率成正比。用于制作该云图的数据源自于对Google Scholar数据库中与3D打印技术相关的数据统计。可以看出,PDMS, PLA, PC, Wax(蜡)是使用频率最高的几种材料,而使用频率最少的两种材料(FullCare, Accura60)为了在图中可见,文字大小被分别放大了20倍和35倍。由于PDMS的使用频率很高,可以推测采用3D打印微流控芯片模具然后使用PDMS倒模的方法很普遍,基于PLA和PC材料的熔融沉积成型技术在3D打印微流控芯片中也被广为应用。
2006年,哈佛大学的Whitesides教授在写给Nature杂志的评论中说,微流控技术还处在发展的幼年期[65],十年之后的今天,虽然微流控技术得到了快速发展,在生命科学、医学诊断、分析化学等领域也得到了越来越广泛的应用,但仍处于发展的初级阶段。而相比于微流控技术的发展,3D打印微流控芯片的技术应该还处在更早的时期。图14显示了从2005年3D打印微流控芯片的技术出现到目前10年来的发展历程,以及对未来的展望。早期的基于3D打印的微流控芯片技术普遍使用倒模的方法,通过3D打印出基于ABS、PLA、PC等热塑性材料的模具,然后使用PDMS进行倒模[66]。2011~2012年,开始出现了直接打印完成的具有简单流道的微流控芯片; 2012年后,出现了基于3D打印微流控芯片的微反应器[51],除微流道外, 还增加了更多功能性器件,甚至也引入了金属电极[67]; 2013年,出现了采用3D打印而成的纸基微流控芯片[68],2014年实现了3D打印制作的可植入人体内的生物检测和药物递送芯片[69]; 2015年,3D打印微流控芯片技术的发展更加迅速,出现了整合生物传感器[70]、高通量[71]、多层芯片[72]、实时生物医学检测等多种芯片,纸基3D打印微流控芯片技术也迎来了新发展,出现了3D打印制成的具有集成金属电极的纸基微流控芯片[73]。
图14 3D打印微流控芯片技术过去10年间的发展
Fig.14 Development for 3D printed microfluidic chips during the past 10 years
3D打印微流控芯片技术的发展方兴未艾,相信随着各类3D打印技术的不断成熟和各类新材料的涌现,3D打印微流控芯片技术将呈现集成化程度更高、整合多种生物/化学传感器、精度更高、成本更低的特点,并在生命科学、分析化学、医疗检测等领域得到更为广泛的应用。3D打印微流控芯片技术的出现,也为研究者们提供了更多的思路。展望未来,基于3D打印技术必将成为微流控芯片加工领域最为重要的技术手段之一。
References
1 Squires T. Rev. Mod. Phys., 2005, 77(3): 977-1026
2 Evgenia Yu B, Frantisek F. Analyst, 2014, 140(1): 22-38
3 Weibel D B, Whitesides G M. Curr. Opin. Chem. Biol., 2006, 10(6): 584-591
4 Pagaduan J V, Sahore V, Woolley A T. Anal. Bioanal. Chem., 2015, 407: 1-12
5 Rivet C, Lee H, Hirsch A, Hamilton S, Lu H. Chem. Eng. Sci., 2011, 66(7): 1490-1507
6 Jabart E, Rangarajan S, Lieu C, Hack J, Conboy I. Sohn L L. Microfluid. Nanofluid., 2015, 18: 1-12
7 Barbulovicnad I, Yang H, Park P S, Wheeler A R. Lab Chip, 2008, 8(4): 519-526
8 Thompson A M, Paguirigan A L, Kreutz J E, Radich J P, Chiu D T. Lab Chip, 2014, 14(17): 3135-3142
9 Benedetto A, Accetta G, Fujita Y, Charras G. Lab Chip, 2014, 14(7): 1336-1347
10 Sewell W F, Borenstein J T, Chen Z, Fiering J, Handzel O, Holmboe M, Kim E S, Kujawa S G, Mckenna M J, Mescher M M. Audiol. Neurotol., 2009, 14(6): 411-422
11 Zhao C X. Adv. Drug Delivery Rev., 2013, 65(1112): 1420-1446
12 Chen W, Lam R H, Fu J. Lab Chip, 2012, 12(2): 391-395
13 Nargang T M, Lara B, Pavel Mitkov N, Dieter S, Dorothea H, Nico K, Kai S, Elisabeth W, Leonardo P, Marian D. Lab Chip, 2014, 14(15): 2698-2708
14 Yeo L P, Ng S H, Wang Z F, Xia H M, Wang Z P, Thang V S, Zhong Z W, de Rooij N F. J. Micromech. Microeng., 2010, 20(1): 837-854
15 Attia U M, Marson S, Alcock J R. Microfluid. Nanofluid., 2009, 7(1): 1-28
16 Hong T F, Ju W J, Wu M C, Tai C H, Tsai C H, Fu L M. Microfluid. Nanofluid., 2010, 9(6): 1125-1133
17 Ho C M B, Ng S H, Li K H H, Yoon Y J. Lab Chip, 2015, 15(18): 3627-3637
18 Gross B C, Erkal J L, Lockwood S Y, Chen C, Spence D M. Anal. Chem., 2014, 86(7): 3240-3253
19 Horn T J, Harrysson O L A. Sci. Prog., 2012, 95(3): 255-282
20 Xu Y, Wang X. Biotechnol. Bioeng., 2015, 112: 1683-1695
21 Spivey E C, Xhemalce B, Shear J B, Finkelstein I J. Anal. Chem., 2014, 86(15): 7406-7412
22 Kamei K I, Mashimo Y, Koyama Y, Fockenberg C, Nakashima M, Nakajima M, Li J, Chen Y. Biomed. Microdevices, 2015, 17(2): 1-8
23 Xing J F, Zheng M L, Duan X M. Chem. Soc. Rev., 2015, 44: 5031-5039
24 Gowers S A N, Curto V F, Seneci C A, Wang C, Anastasova S, Vadgama P, Yang G Z, Boutelle M G. Anal. Chem., 2015, 87(15): 7763-7770
25 Heger Z, Zitka J, Cernei N, Krizkova S, Sztalmachova M, Kopel P, Masarik M, Hodek P, Zitka O, Adam V, Kizek R. Electrophoresis, 2015, 36(1112): 1256-1264
26 Bertsch A, Lorenz H, Renaud P. Sens. Actuator A, 1999, 73(12): 14-23
27 Au A K, Lee W, Folch A. Lab Chip, 2014, 14(7): 1294-1301
28 Shallan A I, Smejkal P, Corban M, Guijt R M, Breadmore M C. Anal. Chem., 2014, 86(6): 3124-3130
29 Kim R H, Lee K S. Macromol. Symp., 2010, 298(1): 25-33
30 Wu D, Wu S Z, Xu J, Niu L G, Midorikawa K, Sugioka K. Laser Photonics Rev., 2014, 8(3): 458-467
31 Chatwin C, Farsari M, Huang S, Heywood M, Birch P, Young R, Richardson J. Appl. Optics, 1998, 37(32): 7514-7522
32 Choi J, Kang H W, Lee I, Ko T, Cho D W. Int. J. Adv. Manuf. Tech., 2009, 41(34): 281-286
33 Llobera A, Juvert J, GonzlezFernández A, Ibarlucea B, CarregalRomero E, Büttgenbach S, FernndezSnchez C. Light: Science & Applications, 2015, 4(4): e271
34 Zheng X, Deotte J, Alonso M P, Farquar G R, Weisgraber T H, Gemberling S, Lee H, Fang N, Spadaccini C M. Rev. Sci. Instrum., 2013, 83(12): 125001-125001-6
35 Lee I, Cho D W. Int. J. Adv. Manuf. Tech., 2003, 22(56): 410-416
36 Cao Y, Li D C, WU J. Rapid Prototyping J., 2010, 19(2): 100-110
37 Stampfl J, Baudis S, Heller C, Liska R, Neumeister A, Kling R, Ostendorf A, Spitzbart M, Heller C, Liska R. J. Micromech. Microeng., 2008, 18(12): 125014-125022
38 Lee J W, Lan P X, Kim B, Lim G, Cho D W. Microelectron. Eng., 2007, 84(58): 1702-1705
39 Rapp B E, Carneiro L, Lnge K, Rapp M. Lab Chip, 2009, 9(2): 354-356
40 Lorenz H, Despont M, Fahrni N, Bianca N L, Renaud P, Vettiger P. J. Micromech. Microeng., 1997, 7(3): 121-124
41 Patrito N, Mclachlan J M, Faria S N, Chan J, Norton P R. Lab Chip, 2007, 7(12): 1813-1818
42 Ma K, Rivera J, Hirasaki G J and Biswal S L. J. Colloid Interface Sci., 2011, 363(1): 371-378
43 Waldbaur A, Rapp H, Lnge K, Rapp B E. Anal. Methods, 2011, 3(12): 2681-2716
44 Jung B J, Hong J K, Cho Y H, Lee K S, Park C H, Yang D Y, Lee K S. Opt. Commun., 2013, 286(1): 197-203
45 Liu Y J, Yang J Y, Nie Y M, Lu C H, Huang E, Shin C S, Baldeck P, Lin C L. Microfluid. Nanofluid., 2015, 18(3): 427-431
46 Spivey E C, Blerta X, Shear J B, Finkelstein I J. Anal. Chem., 2014, 86(15): 7406-7412
47 Karania R, Kazmer D. J. Mech. Design., 2005, 129(12): 265-274
48 Malinauskas M, Rektytê S, Lukoeviius L, Butkus S, Baliūnas E, Peiukaityt M, Baltriukien D, Bukelskien V, Butkeviius A, Kuceviius P. Micromachines, 2014, 5(4): 839-858
49 Goyanes A, Buanz A B M, Basit A W, Gaisford S. Int. J. Pharm., 2014, 476(1-2): 88-92
50 Hutmacher D W, Schantz T, Zein I, Ng K W, Teoh S H, Tan K C. J. Biomed. Mater. Res., 2001, 55(2): 203-216
51 Kitson P J, Rosnes M H, Sans V, Dragone V, Cronin L. Lab Chip, 2012, 12(18): 3267-3271
52 Kadimisetty K, Mosa I M, Malla S, SatterwhiteWarden J E, Kuhns T M, Faria R C, Lee N H, Rusling J F. Biosens. Bioelectron., 2016, 77: 188-193
53 Drummer D, CifuentesCuéllar S and Rietzel D. Rapid Prototyping J., 2012, 18(6): 500-507
54 McCullough E J, Yadavalli V K. J. Mater. Process. Technol., 2013, 213(6): 947-954
55 He Y, Qiu J, Fu J, Zhang J, Ren Y, Liu A. Microfluid. Nanofluid., 2015, 19(2): 447-456
56 Allahverdi M, Danforth S C, Jafari M, Safari A. J. Eur. Ceram. Soc., 2001, 21(10-11): 1485-1490
57 Boschetto A, Giordano V, Veniali F. Rapid Prototyping J., 2013, 19(4): 240-252
58 Wang H, Masood S, Iovenitti P, Harvey E C. International Symposium on Microelectronics & Mems, 2001, 4590: 213-220
59 Wang F, Shor L, Darling A, Khalil S, Sun W, Güeri S, Lau A. Rapid Prototyping J., 2004, 10(1): 42-49
60 Bonyár A, Sántha H, Ring B, Varga M, Gábor Kovács J, Harsányi G. Procedia Eng., 2010, 5: 291-294
61 Hoople G D, Rolfe D A, Mckinstry K C, Noble J R, Dornfeld D A, Pisano A P. J. Micro Nano-Manuf., 2014, 2(3): 034502
62 Roda A, Guardigli M, Calabria D, Calabretta M M, Cevenini L, Michelini E. Analyst, 2014, 139(24): 6494-6501
63 Lee W, Kwon D, Choi W, Jung G Y, Jeon S. Sci. Rep., 2015, 5: 7717
64 Choi S, Kim S K, Lee G J, Park H K. Sens. Actuator B, 2015, 219: 245-250
65 Whitesides G M. Nature, 2006, 442(7101): 368-373
66 McDonald J C, Chabinyc M L, Metallo S J, Anderson J R, Stroock A D, Whitesides G M. Anal. Chem., 2002, 74(7): 1537-1545
67 Erkal J L, Selimovic A, Gross B C, Lockwood S Y, Walton E L, McNamara S, Martin R S, Spence D M. Lab Chip, 2014, 14(12): 2023-2032
68 Xiao L, Liu X, Zhong R, Zhang K, Zhang X, Zhou X, Lin B, Du Y. Electrophoresis, 2013, 34(2021): 3003-3007
69 Chi A, Curi S, Clayton K, Luciano D, Klauber K, AlexanderKatz A, D′Hers S, Elman N M. Drug Deliv. Trans. Res., 2014, 4(4): 320-333
70 Gowers S A N, Curto V F, Seneci C A, Wang C, Anastasova S, Vadgama P, Yang G Z, Boutelle M G. Anal. Chem., 2015, 87(15): 7763-7770
71 Spivey E C, Blerta X, Shear J B, Finkelstein I J. Anal. Chem., 2014, 86: 7406-7412
72 Gelber M K, Bhargava R. Lab Chip, 2015, 15(7): 1736-1741
73 Jenkins G, Wang Y, Xie Y L, Wu Q, Huang W, Wang L, Yang X. Microfluid Nanofluid, 2015, 19(2): 251-261
Recent Progress of 3D Printed Microfluidics Technologies
FAN YiQiang*, WANG Mei, ZHANG YaJun
(School of Mechanical and Electrical Engineering, Beijing University of Chemical Science, Beijing 100029, China)
Abstract In recent years, microfluidics technology has been widely used in biological and medical diagnosis, which demonstrated great advantages compared with other traditional methods. However, there are financial and technology barriers for users to benefit from microfluidics technology when using the standard microfabrication technologies inherited from IC industry. With the booming of three dimensional (3D) printing technologies in recent years, more and more researchers are trying to apply 3D printing technology to fabricate the microfluidic chips for biological and medical applications. Compared with traditional microfabrication method, 3D printing technology shows great advantages in rapid fabrication, flexibility on material selection and low cost. This paper reviewed the most recent research progresses for 3D printed microfluidic technology, especially for the application of 3D printed microfluidic devices respectively fabricated by microstereolithography, fused deposition modelling and inkjet printing method in analytical chemistry, biological and medical diagnosis. The outlook of the research trend in 3D printed microfluidic technology was also discussed.
Keywords Microfluidics; 3D printing; Cell biology; Review
(Received 29 February 2016; accepted 4 March 2016)
