血清S-100β与老年急性脑梗死患者非快速眼动期睡眠障碍及认知功能关系的临床分析
2020-05-07唐晓梅于逢春
冯 浩, 刘 伟, 唐晓梅, 于逢春
(北京大学第三医院海淀院区神经内科, 北京 海淀 100080)
急性脑梗死属临床常见神经系统功能缺损综合症,据报道,国内患病率约占脑卒中总数的60%~80%,发病突然,起病隐匿,病情进展迅速,神经系统症状及体征多于数小时或数天内达高峰,病情凶险,已成为引起老年患者致残和致死的重要病因[1]。而流行病学调查发现,急性脑梗死后往往会出现睡眠障碍,约30%~40%的患者至少存在一种睡眠障碍症状[2]。另有报道发现,急性脑梗死患者可能伴有非快速眼动期睡眠障碍,会引起机体免疫力降低,导致认知功能损害,造成焦虑症、抑郁症等情绪障碍,并诱发多个靶器官损伤,影响患者预后[3]。因此,重视急性脑梗死患者睡眠障碍、认知功能障碍早期发现及干预尤为重要。而血清生物标志物S-100β(S100 calcium binding protein β,S100β)作为神经胶质细胞的标志蛋白,有研究显示其能反映急性脑梗死患者梗死面积及神经功能缺损程度,并在一定程度上能反映慢性失眠障碍患者神经元、轴突、神经胶质细胞损伤[4]。但关于血清S-100β与老年急性脑梗死伴非快速眼动期睡眠障碍患者认知功能及睡眠的联系,目前尚无报道,故本文展开相关研究,旨在为该病临床诊治提供依据,报道如下。
1 资料与方法
1.1一般资料:纳入2015年5月至2019年5月于我院收治的216例老年急性脑梗死患者为对象,开展回顾性分析,获我院医学伦理委员会批准。按照是否出现非快速眼动期睡眠障碍,将入选的患者分为A组(伴非快速眼动睡眠期睡眠障碍,112例)、B组(不伴非快速眼动睡眠期睡眠障碍,104例),两组一般资料比较差异无统计学意义(P>0.05),见表1。
表1 两组一般资料比较
1.2纳入标准:①参考《中国急性缺血性脑卒中诊治指南2010》[5],均经头MRI、CT等检查确诊,静态状况下突然起病,发病≤72h;伴局灶性或全面神经功能缺失,症状与体征持续发生>24h;②发病前具有良好的社会适应能力,发病后2周能配合认知功能测试;③年龄≥65岁,患者意识清醒,无视力、听力障碍及严重失语,右上肢肌力为3级及以上,能配合检查。
1.3排除标准:①伴严重心、肝、肺及血液系统等原发性疾病;②各种脑出血、短暂性脑缺血发作;③合并脑积水、叶酸或维生素B12缺乏、甲状腺功能低下、梅毒、恶性肿瘤;④伴引起认知功能改变的疾病史,如感染性脑病、帕金森病及综合症、抑郁症、焦虑障碍等;⑤既往有痴呆症状、精神性药物滥用史、嗜酒;⑥既往有脑外伤、脑炎等病史;⑦昏迷或无法配合睡眠监测者;⑧伴其他睡眠障碍,如周期性肢体运动、睡眠呼吸暂停等;⑨患急性脑梗死前已确诊为睡眠障碍者。
1.4方 法
1.4.1多导睡眠图监测:选择舒适、安静、具有隔音效果的监测室,室温维持20~25℃。患者测试前7d停服安眠、镇静药物,受试日午休停止,头面部及耳后皮肤洗净后禁止使用任何护发素及护肤品,临睡前禁饮可乐、咖啡等刺激性饮料,并将金属装饰物摘掉。脑电导联运用C3/A2、C4/A1、P1/A1、P2/A2,眼动测量时于双眼外眦外右下、左上各1cm处行电极放置,并采用3M纸胶布固定。下颌肌电放置于下颌、左右两边,总共三个电极。测量过程中,监测患者呼吸、心电、血氧等基本情况。多导睡眠图记录采用N7000型多导睡眠监测系统(美国邦德安百公司),借助其自带的Profusion PSG分析软件,获取相应观察指标,包括睡眠总时间(total sleep time,TST)、睡眠潜伏期(sleep onset latency,SOL)、觉醒次数(Wake up times,WUT)、睡眠效率(sleep efficiency,SE);快速眼动睡眠期(rapid eye movement,REM)结构:包括REM期睡眠时间(REM sleep time,REMT)、REM期睡眠占总睡眠时间百分比(the percentage of REM sleep time in total sleep time,REM%);非快速眼动期(non rapid eye movement,NREM)结构:包括NREM睡眠S1期睡眠时间、NREM睡眠S2期睡眠时间、NREM睡眠S3+S4期睡眠时间。
1.4.2认知功能评估:采用Nasreddine ZS等[6]制定的蒙特利尔认知评估量表(Montreal cognitive assessment,MOCA),包括八个认知域的评估,即视空间与执行功能(包括连线、画钟表、画立方体)、命名、注意、语言(复述和语言流畅性测试)、抽象、延迟记忆(包括五个词汇,即面孔、天鹅绒、教堂、菊花、红色)、定向力(地点定向、时间定向)。量表总分为30分。若受试者受教育年限为12年及以下,则在测试得分上另加1分,总分为26分及以上时属于正常。评分越高,认知功能越好。
1.4.3血清S-100β检测:在完成多导睡眠监测仪监测的次日上午8:00左右,采集患者空腹肘静脉血2mL,采血前避免剧烈运动、过度紧张,且休息放松至少30min。完成抽血后室温下放置待血样凝固后,2h内采用5000S型低温离心机(德国Cryfuge公司)以3000r/min离心10min,上层血清分离后立即置于-80℃冰箱存储待测。采用Anthos 2010型全自动定量酶标仪(奥地利Anthos公司),运用酶联免疫吸附测定法检测血清S-100β水平,试剂盒购自深圳欣博盛生物科技有限公司。严格按仪器及试剂说明书进行操作。
1.5观察指标:对比两组睡眠参数(包括TST、SOL、WUT、SE、REMT、REM%及NREM睡眠S1期、S2期、S3+S4期睡眠时间),分析两组认知功能评分及血清S-100β水平,并分析血清S-100β与睡眠参数和认知功能的关系。

2 结 果
2.1两组睡眠参数比较:A组TST、SE、REMT、REM%及NREM睡眠S2、S3+S4期睡眠时间显著低于B组(P<0.05),SOL、WUT及NREM睡眠S1期睡眠时间显著高于B组(P<0.05),见表2。

表2 两组患者睡眠参数比较
2.2两组认知功能比较:A组视空间与执行功能、注意、延迟记忆、定向力评分及MOCA总分均显著低于B组(P<0.05),命名、语言、抽象评分较B组比较差异均无统计学意义(P>0.05),见表3。

表3 两组患者认知功能比较分)
2.3两组血清S-100β水平比较:A组血清S-100β水平为(678.65±80.60)pg/mL,明显低于B组的(640.42±70.53)pg/mL,差异有统计学意义(t=3.698,P<0.001)。
2.4血清S-100β与老年急性脑梗死伴非快速眼动期睡眠障碍患者睡眠参数和认知功能的关系:经直线相关分析显示,老年急性脑梗死伴非快速眼动期睡眠障碍患者血清S-100β与TST、SE、REMT、REM%、S2、S3+S4呈负相关(P<0.05),与SOL、WUT、S1呈正相关(P<0.05),与MOCA总分呈负相关(P<0.05),见表4。
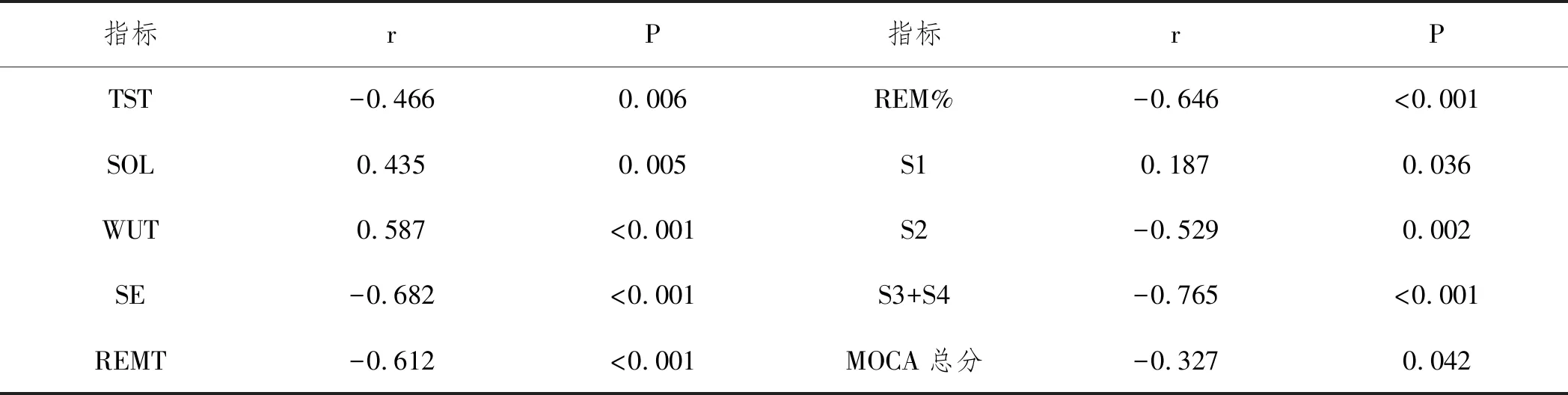
表4 血清S-100β与睡眠参数和认知功能的相关性
3 讨 论
多项研究表明,老年急性脑梗死患者可能伴非快速眼动期睡眠障碍,但无论患者有无非快速眼动期睡眠障碍,其均属轻度认知功能障碍高危人群,其中NREM对正常行为、智力发展具有重要影响,其病理基础主要依赖于丘脑及大脑皮质生物电行为[7]。
本研究结果显示,A组NREM睡眠S2、S3+S4期睡眠时间明显低于B组,NREM睡眠S1期睡眠时间明显高于B组,与Bruni O等[8]报道相似,提示老年急性脑梗死伴非快速眼动睡眠期睡眠障碍患者睡眠质量不佳;而NREM睡眠S2期在脑电上主要表现为纺锤波,预示患者脑电纺锤波数量改变,但认知能力与纺锤波数量呈正相关,预示睡眠质量不佳会造成认知功能损害。老年急性脑梗死伴非快速眼动睡眠期睡眠障碍患者NREM睡眠S2期睡眠时间较单纯老年急性脑梗死患者明显降低,预示睡眠纺锤波密度下降,而睡眠纺锤波密度增加属睡眠中依赖海马记忆巩固常规电生理标志。以往报道认为,觉醒状态时经内嗅皮质,描述性信息进入并暂存人海马CA3区,不受先前信息干扰,于NREM期睡眠时活化参与信息获取、编码的神经元细胞群,海马向大脑皮质输出这类信息;后进入慢波睡眠期,大量海马锥体细胞同步化,并基于海马θ节律及丘脑梭形波活跃情况下,钙离子内流侵入皮质锥体细胞,使这类细胞突触出现可塑性改变,诱导新近获取的记忆转化为长时记忆[9]。从睡眠结构上看,与单纯老年急性脑梗死患者相比,合并非快速眼动睡眠期睡眠障碍患者睡眠改变多表现为SOL、WUT及NREM睡眠S1期睡眠时间增加,NREM睡眠S2、S3+S4期睡眠时间减少,TST、SE、REMT、REM%减少,与既往报道[10]基本一致。而深睡眠减少可能影响记忆信息转化、提取,导致患者记忆力下降,表明睡眠与学习记忆有关,良好的睡眠利于促进患者认知功能恢复。
本研究结果显示,A组视空间与执行功能、注意、延迟记忆、定向力评分及MOCA总分均明显低于B组,而命名、语言、抽象评分较B组并无明显变化,提示合并非快速眼动睡眠期睡眠障碍患者中,其视空间与执行功能、记忆力、注意力、定向力是常累及的认知领域。丁岩等[11]也认为急性脑梗死伴非快速眼动期睡眠障碍患者存在特别突出的记忆力障碍,记忆力、注意力、定向力和执行能力明显受损,与本结论一致。分析其原因,记忆活动主要依赖于皮层及皮层下Papez环路结构、功能的完整性,而一旦皮层及皮层下记忆环路机制遭到破坏,会引起认知功能障碍。Plante DT等[12]报道发现,老年急性脑梗死伴非快速眼动睡眠期睡眠障碍患者与老年急性脑梗死患者相比,命名、语言、抽象能力未见明显差异。但也有报道发现,与急性脑梗死患者相比,合并非快速眼动睡眠期睡眠障碍者命名、语言、抽象能力可能也存在不同程度的受损,与本结论存在一定偏差,可能与样本特征差异、样本量大小、认知任务对轻微损害的敏感性较低等有关[13]。笔者认为,合并非快速眼动期睡眠障碍者认知功能损害主要表现为学习记忆及思维判断有关的大脑高级智能加工异常,而非快速眼动睡眠期睡眠障碍与认知功能有关。分析老年急性脑梗死患者非快速眼动期睡眠障碍所致认知功能改变的可能机制如下:①睡眠障碍引起0.5~2.0Hz波幅的慢波睡眠缺陷,影响脑内蛋白质合成,不利于新突触的联系建立,形成大脑皮质认知电位改变,引起认知功能受损;②患者睡眠质量差,前额皮质血流量下降,大脑半球局部血液供应障碍、结构异常,经前额皮质调节作用,影响认知功能。
而血清S-100β属神经胶质标记蛋白,反映脑损伤严重程度、预后。急性期脑梗死神经胶质细胞坏死后自细胞质中释出S-100β,基于脑缺血缺氧情况下引起毛细血管内皮细胞基底膜损伤,导致血脑屏障被破坏,使S-100β进入外周血,导致血浆S-100β显著升高。非快速眼动期睡眠障碍可能抑制成人齿状回神经的发生,引起海马角分区神经元缺失,而血清S-100β水平在一定程度上能反映非快速眼动期睡眠障碍患者神经元、轴突或神经胶质细胞损伤。本研究发现,A组血清S-100β水平明显低于B组,提示合并非快速眼动期睡眠障碍者可能存在神经胶质细胞或神经元损伤。而本研究中,血清S-100β与TST、SE、REMT、REM%、S2、S3+S4及MOCA总分呈负相关,与SOL、WUT、S1呈正相关,提示血清S-100β与合并非快速眼动期睡眠障碍者睡眠质量及认知功能相关,预示患者存在脑结构的轻微损伤。笔者推测,可能因睡眠结构紊乱(包括NREM睡眠S1期睡眠时间延长、S3+S4期睡眠时间减少等)、长期慢性间断缺氧等因素导致脑胶质细胞慢性活化,分泌大量S-100β蛋白。而血清S-100β导致认知功能障碍的可能机制如下:①血清S-100β水平影响神经突触可塑性。神经突触可塑性属记忆关键结构基础,正常情况下脑中S-100β结合主要突触结构蛋白,抑制其磷酸化,促进神经生长、轴突生长、突触再塑,但高浓度S-100β会诱发突触形态结构改变,引起记忆能力下降;②血清S-100β水平影响神经递质系统。高浓度S-100β导致活化星形胶质细胞中产生大量一氧化氮,抑制记忆机制主要模式(长时程增强),不利于神经突触可塑性形成,并经影响与记忆相关的神经递质(如多巴胺、已烯胆碱等)释放,使记忆力下降,引起认知功能损害。综上,老年急性脑梗死伴非快速眼动期睡眠障碍患者睡眠质量、认知功能与血清S-100β有关,临床应引起足够重视。但本文因收集的标本有限,未深入探讨患者睡眠质量与认知功能之间的关系,故有待今后进一步探讨。
