葫芦素D通过下调GATA6表达抑制SGC-7901胃癌细胞增殖迁移的作用机制研究
2020-05-07冯晓波李敏虹尚精娟
冯晓波, 李敏虹, 尚精娟, 周 颖
(上海市第七人民医院胃肠疾病诊疗部, 上海 200136)
胃癌细胞的增殖和转移是导致患者死亡的主要原因。虽然化疗和手术方面已经取得了一些进展,由于大多数患者被诊断为晚期疾病阶段,其预后中位数总体生存时间≤12个月[1]。因此,研究者致力于开发新的药物和研究其机制,以提高胃癌的诊疗水平。胃癌的分子机制复杂,涉及遗传因素与环境因素的相互作用。在这些机制中,GATA转录因子6(GATA6)可能是治疗人类癌症的新分子靶点。GATA6是GATA家族成员之一,表达于肺、胰腺、胃肠道等内胚层组织和心脏等中胚层组织,通过与组织内的(A/T)GATA(A/G)序列结合,调控组织中各种分化基因的表达[2]。除了分化,GATA6还与细胞增殖、细胞存活和各种细胞类型的肿瘤转化有关[3]。研究表明,GATA6在包括胃癌在内的多种癌症中过度表达;同时,GATA6的活性升高通过促进细胞增殖、细胞周期进程和细胞迁移而促进肿瘤的发生和发展[4]。葫芦素是一类四环三萜类化合物,根据结构的不同分为葫芦素A到T 17个亚型,具有抗炎、抗菌、抗肿瘤等作用。其中葫芦素B、D、E、I 具有显著的抗瘤作用,可以抑制肿瘤细胞的生长。然而,葫芦素D抗肿瘤的作用机制研究较少。本研究用不同浓度葫芦素D干预SGC-7901胃癌细胞,观察增殖和迁移情况,并检测GATA6的水平,探讨葫芦素D治疗胃癌的作用机制。
1 材料与方法
1.1主要试剂与仪器:SGC-7901胃癌细胞(批号:CK-0143,中国科学院典型培养物保藏中心昆明细胞库);葫芦素D(批号:3877-86-9,纯度≥98%,成都麦德生科技有限公司);顺铂(纯度99.99%,批号:P4394,美国sigma公司);胎牛血清(批号:TBD21HY,美国Gibco公司);RPMI-1640培养基、二甲基亚砜(DMSO)(批号:PM150210B、PM170319R,天津润泰科技发展有限公司);四噻唑蓝(Methyl tihiazolyl tetrazolium,MTT)(批号:M4016-5,美国Amresco公司);细胞凋亡检测试剂盒和细胞周期检测试剂盒(批号:CA1020、CA1047,美国BD公司);Trizol ReagentRNA提取试剂盒(批号:DP325,美国Invitrogen公司);PrimeScript RT reagent Kit Perfect Real Time RNA反转录试剂盒、UltraSYBR One Step RNA PCR Kit荧光定量PCR试剂盒(批号:RR047A、TK08045,宝生物工程大连有限公司);C170型二氧化碳细胞培养箱(德国Binder公司);3-18K型高速低温离心机(德国SIGMA公司);奥林巴斯CX43型显微镜(日本OLYMPUS公司);NanoDrop2000c型蛋白核酸检测仪(美国Thermo公司);7500Fast型实时荧光定量PCR仪(美国ABI公司);FACSCanto Ⅱ型流式细胞仪(美国BD公司)。
1.2细胞培养及实验分组:用含胎牛血清(10%)的RPMI-1640培养液在37℃、5% CO2条件下培养SGC-7901细胞,选择对数生长期细胞进行实验。根据MTT法,以5×103/孔接种于96孔板中,200μL/孔,用不同浓度葫芦素D(0、1.0、2.0、4.0、8.0、16.0、32.0 μmoL/L)培养48h后加入MTT(50μL/孔),继续培养4h,离心弃上清,加入DMSO(200μ/孔),振荡,用酶标仪在450nm处检定吸光度值(OD值),计算细胞抑制率,细胞抑制率=(对照组OD值-处理组OD值)/对照组OD值×100%。根据半数抑制率确定葫芦素D的干预剂量。实验分为对照组、顺铂组、葫芦素D低、中、高剂量组。对照组不进行处理,顺铂组给予终浓度为10.0μmoL/L的顺铂,葫芦素D低、中、高剂量组分别给予终浓度为2.0、4.0、8.0μmoL/L的葫芦素D,继续培养48h后进行相关检测。
1.3细胞划痕法检测SGC-7901细胞迁移能力:以5×104/孔接种于6孔板内,200μL/孔,待细胞贴壁后,用100μL灭菌枪头在单层细胞上呈“-”字划痕,用无血清的RPMI-1640培养基清洗3次,用不同剂量的葫芦素D干预48h,用显微镜下拍照,3-5个视野/孔,用图像分析仪测量划痕宽度,实验重复3次。
1.4实时荧光定量PCR(RT-PCR)检测miRNA-143和GATA6 mRNA表达:以5×104/孔接种于6孔板内,200μL/孔,待细胞贴壁后,用不同剂量的葫芦素D干预48h,弃培养基,根据RNA提取试剂盒操作说明书进行总RNA提取,根据RNA反转录试剂盒说明合成cDNA,再根据荧光定量PCR试剂盒说明,制备20ul反应体系进行扩增,在CFX-96 PCR扩增仪中进行扩增。GATA6、微小RNA-143(miRNA-143)和U6引物由宝生物工程(大连)有限公司合成,GATA6上游引物为5'-CACACGCTGACAGTGCTGG -3',下游引物为5'-TACAGGGCGATACAAAGCAGGAGAA-3';miRNA-143上游引物为5'-ACACTCGAGCTGGGGCTTCTCCTGGCTCTCC-3',下游引物为5'-TGGTGTGGTGGAGTCG-3';U6引物序列:上游引物为5'-CTCGCTTCGGCAGCACA-3,下游引物为:5- ACGCTTCACGAATTTGCGT -3';反应条件为预变性95℃ 30s、变性 95℃ 5s、60℃ 44s、40个循环,61 ℃时采集荧光,用实时荧光定量 PCR仪检测对其表达量进行结果分析,以U6作为内参,采用 2-△△Ct法计算miRNA-143和GATA6 mRNA的相对表达量。
1.5流式细胞术检测细胞凋亡和细胞周期情况:以5×104/孔接种于6孔板内,200μL/孔,待细胞贴壁后,用不同剂量的葫芦素D干预48h,弃培养基,消化后转移至离心管内,离心弃上清,根据试剂盒说明书步骤,用流式细胞仪检测细胞凋亡和细胞周期情况。
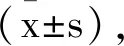
2 结 果
2.1不同浓度葫芦素D对SGC-7901细胞生长的影响:随着葫芦素D剂量增加,SGC-7901细胞抑制率增加,与0μmoL/L比较,差异有统计学意义(P<0.05)。在葫芦素剂量为8.0μmoL/L时,抑制率为53.07%,故选8.0μmoL/L作为最高干预剂量,并设2.0μmoL/L和4.0μmoL/L两个剂量,见表1。
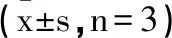
表1 不同浓度葫芦素D对SGC-7901细胞生长的影响
注:与空白对照组比较,aP<0.05
2.2葫芦素D对SGC-7901细胞迁移能力的影响:与对照组比较,顺铂组SGC-7901细胞迁移能力降低,差异有统计学意义(P<0.05);给予葫芦素D处理后,SGC-7901细胞迁移能力降低,呈剂量依赖性,但效果不如顺铂组,差异有统计学意义(P<0.05),见表2、图1。
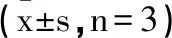
表2 葫芦素D对SGC-7901细胞迁移能力和ROS水平的影响
注:与对照组比较,aP<0.05;与顺铂组比较,bP<0.05;与葫芦素D低剂量组比较,cP<0.05;与葫芦素D中剂量组比较,dP<0.05
2.3葫芦素D对SGC-7901细胞中miRNA-143和GATA6 mRNA表达的影响:与对照组比较,顺铂组SGC-7901细胞中miRNA-143 mRNA的相对表达量增加,GATA6 mRNA相对表达量降低,差异有统计学意义(P<0.05);给予葫芦素D处理后,SGC-7901细胞中miRNA-143 mRNA的相对表达量增加,GATA6 mRNA相对表达量降低,呈剂量依赖性,但效果不如顺铂组,差异有统计学意义(P<0.05),见表3。
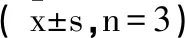
表3 葫芦素D对SGC-7901细胞中miRNA-143和GATA6 mRNA表达的影响
注:与对照组比较,aP<0.05;与顺铂组比较,bP<0.05;与葫芦素D低剂量组比较,cP<0.05;与葫芦素D中剂量组比较,dP<0.05
2.4葫芦素D对SGC-7901细胞凋亡和细胞周期的影响:与对照组比较,顺铂组SGC-7901细胞凋亡率和S期细胞比例增加,G0/G1期细胞比例降低,差异有统计学意义(P<0.05);给予葫芦素D处理后,SGC-7901细胞凋亡率和S期细胞比例增加,G0/G1期细胞比例降低,呈剂量依赖性,但效果不如顺铂组,差异有统计学意义(P<0.05),见表4。
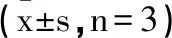
表4 葫芦素D对SGC-7901细胞凋亡和细胞周期的影响
注:与对照组比较,aP<0.05;与顺铂组比较,bP<0.05;与葫芦素D低剂量组比较,cP<0.05;与葫芦素D中剂量组比较,dP<0.05
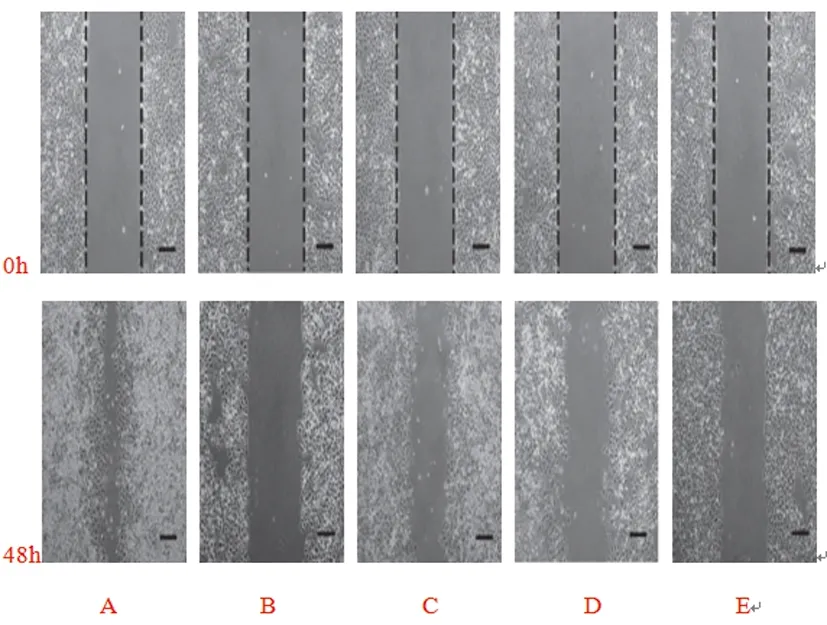
图1 葫芦素D对SGC-7901细胞迁移能力的影响
注A:对照组,B:顺铂组,C:葫芦素D低剂量组,D:葫芦素D中剂量组,E:葫芦素D高剂量组
3 讨 论
胃癌是导致癌症相关死亡的第二大最常见原因,尽管研究者对胃癌做了很多研究,但尚无有效的治疗方法。大多数侵袭性胃癌患者对手术和放疗无效,但作为姑息性治疗对全身化疗敏感。因此,开发胃癌潜在的替代化疗药物是非常令人鼓舞的。顺铂是常用一线化疗药,但其毒副作用较多。据报道,葫芦素D可以抑制不同癌细胞的增殖,包括乳腺癌细胞、细胞淋巴瘤细胞和肺鳞癌细胞[5]。本研究发现,葫芦素D对SGC-7901细胞的增殖具有抑制作用,且呈剂量依赖性。
胃癌细胞的运动性在转移过程中起着至关重要的作用。许多报道的研究已经证实了葫芦素D对不同癌症类型的迁移和侵袭的影响[6]。葫芦素D的治疗通过下调GATA6和丝裂原活化蛋白激酶(Mitogen-activated protein kinase,MAPK)通路抑制肺癌迁移[7]。在另一项研究中,葫芦素D通过体外抑制GATA6和Ras同源基因家族成员A(Ras homolog gene family member A,RhoA)的表达,抑制基质金属蛋白酶-2/9(Matrix metalloproteinase -2/9,MMP-2/9)的表达,抑制了人骨肉瘤细胞的迁移和侵袭[8]。然而,葫芦素D对胃癌SGC-7901细胞运动功能的影响尚未见报道。本研究结果显示,葫芦素D在体外降低了胃癌SGC-7901细胞迁移。因此,葫芦素D有望成为抑制肿瘤进展和转移的有效候选药物。
GATA6参与细胞周期进展、细胞生长、分化、代谢和凋亡的调控[9]。研究发现,过表达GATA6增加了MKN28胃癌细胞系的细胞增殖;同时,通过对Wnt拮抗剂Dickkopf-1进行负调控,激活Wnt信号通路,发现过表达GATA6可促进胰腺癌细胞株AsPC-1和PANC-1的增殖[10]。已有研究表明,葫芦素D对不同癌细胞的增殖抑制作用与G0/G1期、S期或G2/M期阻滞有关,而细胞阻滞在S期被认为是细胞凋亡的标志[11]。越来越多的文献表明,miRNA-143在包括胃癌在内的多种人类癌症中发挥抑癌作用,参与包括肿瘤发生和发展在内的许多生物学过程[12]。通过生物信息学分析显示,miRNA-143与GATA6的3'UTR结合,表明GATA6是miRNA-143潜在是靶基因。在胃癌的发生发展过程中,miRNA-143调控了胃癌间质成纤维细胞中Ⅲ型胶原的表达,通过靶向GATA6抑制胃癌细胞自噬,促进胃癌细胞凋亡,增强了槲皮素的化学敏感性[13]。本研究显示,葫芦素D可以上调miRNA-143的表达,从而抑制GATA6的表达,抑制了SGC-7901细胞的增殖,将SGC-7901细胞阻滞在S期,诱导SGC-7901细胞凋亡,这更激发了我们对葫芦素D潜在作用机制的探讨。
综上所述,葫芦素D能抑制SGC-7901胃癌细胞增殖和迁移,引起细胞周期阻滞和诱导细胞凋亡,具有一定的抗癌活性,其机制可能与葫芦素D通过下调GATA6表达有关,为葫芦素D治疗胃癌提供理论依据。总之,葫芦素D可能是一种有希望的抗癌药物,能够对抗胃癌的进展和转移。
