2017~2018年华中地区猪圆环病毒2型分子流行病学分析
2020-04-02邓文芳宋文博胡星星陈翔鸿喻红艳汤细彪
邓文芳,宋文博,胡星星,贾 双,陈翔鸿,喻红艳,汤细彪
(武汉科前生物股份有限公司,武汉 430070)
猪圆环病毒(Porcine circovirus,PCV)属于圆环病毒科(Circoviridae)圆环病毒属(Circovirus),其核酸是一种单股、闭合、环状DNA分子,基因组大小约为1766 bp[1]。PCV2自1998年首次被发现后就一直受到世界的关注,是引起断奶仔猪多系统衰竭综合征(posting-weaning multisystemic wasting syndrome,PMWS)的主要病原之一,可在淋巴系统内增殖引起机体免疫抑制,导致免疫力下降,并引起其他病原的继发感染[2-3]。此外PCV2常与猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)、猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory sydrome,PRRSV)、猪伪狂犬病毒(Pseudorabies virus,PRV)混合感染。
PCV2的ORF2基因主要编码衣壳蛋白(Cap蛋白),为PCV2主要免疫原性蛋白。根据PCV2 ORF2基因序列的差异,PCV2可以分为2a、2b、2c、2d、2e等基因亚型。前期研究表明,PCV2b为我国流行的主要基因亚型,具有致病性;国外学者通过基因序列分析发现PCV2流行的主要基因亚型有从PCV2b向PCV2d转变的趋势[4-7]。2016年,Xiao等[8]报道,美国PCV2d感染率从2012年37.8%上升到2017年72.0%,说明PCV2d已替代PCV2b成为主要的流行毒株。本实验采集华中地区3个省份疑似PCV2感染的样品进行检测,对其中38份阳性样品进行ORF2基因克隆和测序,并进行同源性分析和遗传进化分析,初步掌握了2017~2018年我国PCV2的分子流行趋势,为PCV2的临床防控提供了依据。
1 材料与方法
1.1 样品 2017~2018年间共采集华中地区(湖北、湖南、河南)1592份疑似PCV2感染的组织样品,包括肺脏、肾脏、淋巴结和脾脏等,放入-80℃冰箱备用。
1.2 主要试剂 病毒核酸提取试剂盒、琼脂糖凝胶DNA回收试剂盒、质粒小提试剂盒购自北京天根生化科技有限公司;2×EasyTaqPCR SuperMix购自北京全式金生物技术有限公司,pMD19-T载体和DL1000 DNA marker均购自宝生物工程(大连)有限公司;其他试剂均为国产分析纯。
1.3 病毒DNA的提取 将组织样品剪碎后,加入500 μL PBS稀释,经全自动组织研磨机混合研磨制成匀浆,-80℃反复冻融3次,6000×g离心10 min,取上清液。按照病毒核酸提取试剂盒说明书操作步骤提取病毒DNA,并置于-20 ℃冰箱保存备用。
1.4 引物的设计与合成 根据GenBank中登录的PCV2序列(GenBank登录号:AY424401.1)设计引物,见表1。F1/B1为样品PCV2检测引物,目的片段为496 bp;F2/B2为ORF2基因序列克隆引物,目的片段为958 bp,引物均由生工生物工程(上海)有限公司合成。

表1 本研究引物Table1 Primers used in this study
1.5 样品的PCR检测 以提取的病毒DNA为模板,以F1/B1为引物进行PCR扩增。反应体系(20 μL):2×EasyTaqPCR SuperMix 10 μL,F1、B1各1 μL,ddH2O 6 μL,DNA模板2 μL。反应条件:95℃预变性5 min;95℃变性30 s,55℃退火30 s,72℃延伸30 s,共35个循环;72℃延伸10 min。取5 μL扩增产物进行琼脂糖凝胶电泳,观察检测结果。
1.6 ORF2基因的克隆及测序 在鉴定为PCV2阳性的部分样品中,按月份随机选取条带较亮样品的病毒DNA,用基因克隆引物F2/B2进行ORF2基因序列扩增,反应体系(20 μL):2×EasyTaqPCR SuperMix 10 μL,F2、B2各1 μL,ddH2O 5 μL,DNA模板3μL。反应条件:94℃预变性5 min;94℃变性30 s,53℃退火40 s,72℃延伸30 s,共35个循环;72℃延伸10 min。取5 μL扩增产物进行琼脂糖凝胶电泳,观察检测结果。将胶回收产物与pMD19-T载体连接后转化,选取单个菌落,接种于含100 mg/L Amp的LB液体培养基中,37℃、300r/min振荡培养12 h,使用F2/B2引物进行菌液PCR鉴定。对鉴定为阳性的菌液进行质粒提取,送至生工生物工程(上海)有限公司测序。
1.7 序列的比对与分析 用DNAStar软件将测序得到的ORF2基因序列与GenBank中已公布的22条参考序列(表2)进行同源性分析和氨基酸多序列比对,采用MEGA 6软件绘制分子遗传进化树。

表2 本实验使用的22株PCV2参考序列Table2 The PCV2 reference sequences used in this study
2 结果
2.1 样品的PCR检测结果 运用PCV2检测引物F1/B1对样品进行PCR扩增,阳性样品能够扩增出大小为496 bp的特异性条带(图1)。样品PCR检测的结果显示:在2017~2018年采集的1592份病料中,1091份样品为PCV2阳性,阳性率为68.53%,湖北、河南和湖南3个省份猪群PCV2感染阳性率分别为68.90%、67.20%、70.70%,表明PCV2在华中地区猪群中感染较为普遍,见表3。

表3 华中地区三省份猪群PCV2感染情况Table 3 PCV2 infection in three provinces of central China
2.2 PCV2 ORF2基因的克隆 在PCV2鉴定阳性样品中按月份随机选取PCR鉴定条带较亮的38份样品(表4)进行PCV2 ORF2基因序列的克隆。利用引物F2/B2进行PCR扩增,可获得大小约为958 bp的目的条带(图2),与预期结果相符。
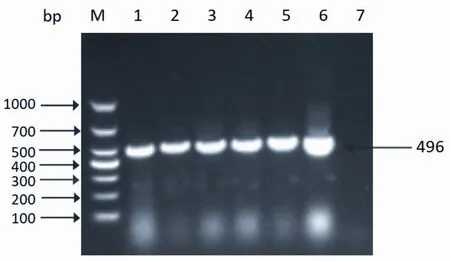
图1 部分阳性样品PCR鉴定结果Fig.1 Some positive samples were identified by PCR
2.3 PCV2 ORF2基因同源性分析 将阳性PCR产物连接至pMD19-T载体后进行测序,测序结果与22株参考序列进行同源性比对。结果显示:本研究获得的38株PCV2 ORF2序列之间的同源性为89.5%~100%,与22株参考序列的同源性为81.1%~99.9%,其中大部分序列与PCV2d亚型的参考序列KJ680369同源性最高,可达99.9%,部分毒株同源性对比结果见图3。

表4 38株PCV2序列的来源和命名Table 4 Source and name of 38 PCV2 strains

图2 部分阳性样品ORF2基因序列的PCR检测结果Fig.2 PCR results of partial ORF2 gene sequences
2.4 ORF2基因遗传进化分析 将38株PCV2 ORF2基因序列与22株参考序列进行遗传进化分析。结果显示,所获得的38株序列分布于PCV2a、PCV2b、PCV2d 3个分支,其中33株(湖北16株、河南12株、湖南5株)属于PCV2d基因型,占分离株的86.2%;4株(湖北2株、河南1株、湖南1株)属于PCV2b基因型;1株(湖北1株)属于PCV2a基因型,未发现2c和2e基因型,证明2017~2018年华中地区PCV2流行毒株以PCV2d基因型为主(图4)。
2.5 ORF2基因推导氨基酸序列分析 将38株ORF2基因推导的氨基酸序列进行多序列比对和同源性分析,各氨基酸序列之间同源性为89.4%~100%,与22株参考氨基酸序列同源性为94.4%~100%。以AF055394为参考序列对38株ORF2基因推导氨基酸序列进行多序列比对,从图5中可以看出,主要变异位点为53~91、121~151、190~210 aa。另外也存在一些散在的突变位点,如8、30、170、185、205 aa等。I53、K59、R63、N68、T90、L89、T121、N134、R/G169、D210、I215均为PCV2d区别于PCV2b的氨基酸变异位点。另外,如图5中方框位置为文献报道的Cap蛋白表位[9],其中部分毒株的氨基酸序列发生了变异,这可能和不同毒株之间的毒力差异相关。

图3 部分毒株ORF2基因同源性对比Fig.3 Homology analysis of ORF2 gene of partial strains

图4 PCV2 ORF2基因遗传进化分析Fig.4 Phylogenetic analysis of PCV2 ORF2 gene
3 讨论
近年来,我国动物病原流行病学监测结果显示,PCV2的感染率有明显的上升趋势[10-11],给养猪业造成了严重的经济损失,如何做好PCV2的防控工作成为当前的一大难题。本研究显示2017~2018年华中地区PCV2的阳性率为68.53%(1091/1592),与2010~2013年四川省PCV2的阳性率(70.7%)接近[3],然而相较于2008~2011年全国12个省市PCV2的阳性率(78.3%)较低[10],可能是由于本文的样品检测数目(1592份)远高于前者(452份),且不同地区PCV2感染率有差异。
根据PCV2近年来的分子流行病学调查研究发现,PCV2d基因型已成为我国流行的优势基因型。徐朋丽等[12]在河南省分离出的21株PCV2中,16株属于PCV2d,5株属于PCV2b基因型。本研究中38株PCV2 ORF2基因序列同源性为89.5%~100%,说明华中地区流行的PCV2分子间有差异。同时将38株PCV2 ORF2基因序列与22株参考毒株基因序列进行遗传进化树分析,进化树显示38株序列分属于PCV2a、PCV2b、PCV2d 3个分支,其中PCV2d基因型有33株,说明华中地区以PCV2d为流行基因型。

图5 PCV2 ORF2推导氨基酸序列比对Fig.5 Multiple sequence alignment of amino acid of Cap protein
PCV2的ORF2基因主要编码Cap蛋白,本研究通过比对38株ORF2基因序列推导的氨基酸序列和PCV2b Cap蛋白氨基酸参考序列(GenBank登录号:AAC35331.1)可知,Cap蛋白氨基酸序列在多个区域存在较高的变异,主要变异位点为53~91、121~151、190~210 aa,与国内外多名学者研究结果一致[13-14]。另外,Cap蛋白表面存在的潜在表位在免疫压力下易发生突变,从而改变病毒的毒力和致病性[9],本研究中在这些蛋白表位区域,不同的毒株序列存在突变,这可能会导致不同毒株之间的差异,给临床PCV2的防控带来一定的难度。目前接种疫苗是PCV2感染的主要防控手段,市场上商品化疫苗以PCV2a和PCV2b基因型为主,但PCV2a和PCV2b基因型疫苗对PCV2d基因型的免疫效果还需进一步研究分析[15]。
本研究初步掌握了2017~2018年华中地区PCV2的流行动态,并对ORF2基因特征进行了初步分析,为临床PCV2的防控提供了一定的指导,也为PCV2d疫苗的研发奠定了基础。
