积雪草酸对人牙周膜细胞增殖、迁移和成骨分化的影响
2020-04-01郝春波邓伟巩蕾谭毅王周凯欣
郝春波 邓伟 巩蕾 谭毅 王周凯欣
牙周膜细胞(PDLCs)的成骨分化对牙周组织的修复和再生至关重要,筛选PDLCs成骨分化过程进行调节的分子成为目前PDLCs成骨分化的热点[1]。
积雪草酸(asiatic acid,AA)是一种乌苏烷型五环三萜酸,主要来源于积雪草。近年来许多研究发现AA具有保肝[2]护心[3]、抗炎[4]护肤[5]、抗肿瘤[6]、抗氧化应激[7]等多种生物活性,受到学界广泛关注。
本课题组前期研究表明AA对牙龈成纤维细胞具有抗炎、抗凋亡的效果[8]。但其对间充质细胞成骨分化的作用尚未见报道。本研究旨在探讨AA对牙周膜细胞的成骨分化的影响。
1 材料与方法
1.1 主要材料和仪器
低糖DMEM培养基、胎牛血清、I型胶原酶、中性蛋白酶、0.25%胰蛋白酶消化液(Gibco,美国);β-甘油磷酸钠、地塞米松、维生素C、茜素红(Sigma,美国); 积雪草酸(瑞芬思); TriZol(Invitrogen,美国);CCK8试剂盒(Transgene);8 μm孔径Transwell小室(BD Falcon,美国);BCIP/NBT碱性磷酸酯酶显色试剂盒(上海碧云天);TaKaRa SYBR®Premix Ex TaqTMII、PrimeScriptTMRT Reagent Kit(Perfect RealTime)(TaKaRa,日本);GAPDH、OPN一抗、二抗(Proteintech,美国),RUNX2一抗(Bioworld,美国);倒置相差显微镜、正置显微镜(Leica,德国);酶标仪(Bio-Rad,美国);Nanodrop2000超微量分光光度计(Thermo Scientific,美国);PCR仪、实时荧光定量PCR仪7500型(ABI,美国)。
1.2 人牙周膜细胞的体外分离培养
中性蛋白酶和Ⅰ型胶原酶混合消化法培养原代hPDLCs,原代细胞生长至80%汇合时,用含EDTA的胰蛋白酶消化,细胞收缩变圆时吸去消化液, 收集细胞悬液, 1 000 r/min离心5 min后弃上清,加入新鲜完全培养基传代培养。实验使用第三代细胞。
1.3 细胞增殖能力检测
取第3 代对数生长期的牙周膜细胞,分为空白对照组和分别添加浓度为25、 50和100 μg/ml的AA组,以每孔1 000 个细胞的数目接种于96 孔板中,每孔加入100 μl完全培养基,每组设置5 个复孔。 37 ℃, 5% CO2饱和湿度中培养。 24 h后开始检测细胞增殖情况,共检测1~7 d共7 个时间点;多功能酶标仪检测各孔450 nm波长A值,记录数值,去除每组最大值和最小值并进行统计,绘制细胞增殖图。
1.4 细胞迁移能力检测
细胞处理分组同1.3。将各组细胞5×104个分别接种于Transwell小室的上室, 同时加入200 μl无血清培养基,下室加入600 μl含20%FBS的完全培养基, 37 ℃,5%CO2饱和湿度中培养24 h; 取出小室,甲醇固定10 min,自来水中充分漂洗1 min,轻轻擦去小室膜上层的残余细胞和水分;小室浸泡在新鲜苏木素染液中室温下染色30 min,再次漂洗、干燥;显微镜下观察下室的细胞,每小室取10 个不同视野进行拍照,进行细胞计数。
1.5 细胞成骨分化检测
以105个细胞/孔的密度接种于6 孔板中,细胞生长至约80%融合时,更换为成骨诱导培养液(完全培养基中含有10 ng/ml的地塞米松、 50 mg/ml的抗坏血酸和10 mmol/L的β-甘油磷酸钠),细胞处理分组同1.3, 每2 d换液,培养7 d后进行ALP染色,21 d后进行茜素红染色,倒置显微镜下观察各组ALP活性和矿化结节的形成情况。 随后茜素红染色的各孔加入等量西吡氯铵溶液溶解钙化结节,酶标仪检测各孔吸光度值。
1.6 细胞成骨分化相关基因表达检测
以105个细胞/孔的密度接种于6 孔板中,细胞生长至约80%融合时,更换为成骨诱导培养液, 细胞处理分组同1.3, 每2 d换液,培养14 d后TriZol裂解细胞提取细胞总RNA,分光光度计检测RNA纯度和含量后,将其逆转录成cDNA,以GAPDH为内参,实时荧光定量PCR法检测各组细胞中成骨相关功能基因的表达情况。PCR反应体系,反应条件均严格按照试剂盒说明,引物由北京奥科公司合成(表1)。 蛋白免疫印迹实验SDS-PAGE检测定量采用10%的胶,上样量20 μg, 浓缩胶采用80 V恒压30 min, 分离胶120 V恒压90 min,转膜条件为200 mA 1 h, 5%脱脂奶粉室温封闭1 h,一抗在4 ℃孵育过夜,二抗室温孵育1 h,随后进行发光检测。

表1 成骨相关基因引物序列
1.7 统计学分析
2 结 果
2.1 各组细胞增殖能力情况比较
CCK8实验结果显示,随着时间的增加,各组增殖速率由慢转快,第7天增殖速度区域平稳。但和对照组相比,添加各个浓度AA的各组无显著差异,各实验组之间也无显著差异(图1)。
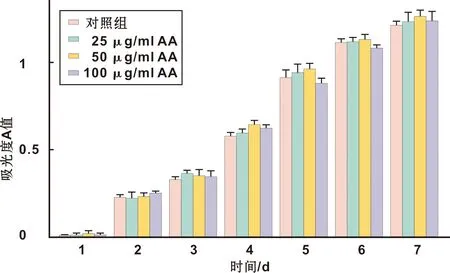
图1 AA对人牙周膜细胞增殖的影响
2.2 各组细胞迁移能力情况比较
Transwell小室迁移实验结果显示,和对照组相比,添加AA的各组穿国小室隔膜的细胞数量无显著差异,各个实验组之间亦无显著差异(图2)。
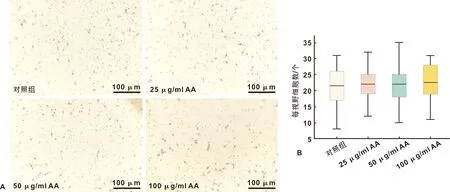
图2 AA对人牙周膜细胞迁移的影响
2.3 各组细胞矿化能力比较
ALP活性染色结果:与对照组相比,添加25 μg/ml AA的组别无显著差异, 但添加50 μg/ml和100 μg/ml的AA的2 个组别染色显著加深,其中50 μg/ml AA组的染色较100 μg/ml AA组深。茜素红染色结果和ALP染色结果一致,矿化结节溶解定量实验显示对照组和25 μg/ml AA组无显著差异(表2),而和50 μg/ml AA组的染色较100 μg/ml AA组有显著差异, 50 μg/ml AA组的定量水平较100 μg/ml AA组显著升高(图3)。
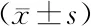
表2 各组钙结节吸光度值
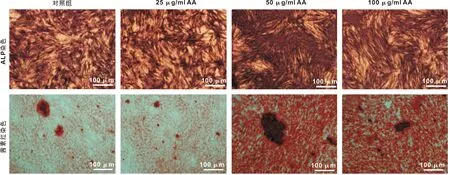
图3 AA对PDLCs矿化能力的影响
2.4 各组细胞中成骨相关基因和蛋白表达水平
7 d时的成骨相关基因RUNX2,OPN,OCN,ON表达水平较3 d为高(P<0.05)。和对照组相比, 3 d和7 d各组的RUNX2、OPN、OCN、ON表达水平均有不同程度的上调,其中添加50 μg/ml AA组上调最为显著,除3 d时的 OPN外,均较其它各组显著上调(图4)。 RUNX2和OPN蛋白表达水平和mRNA趋势一致,即在50 μg/ml AA组上调最为显著(图5)。
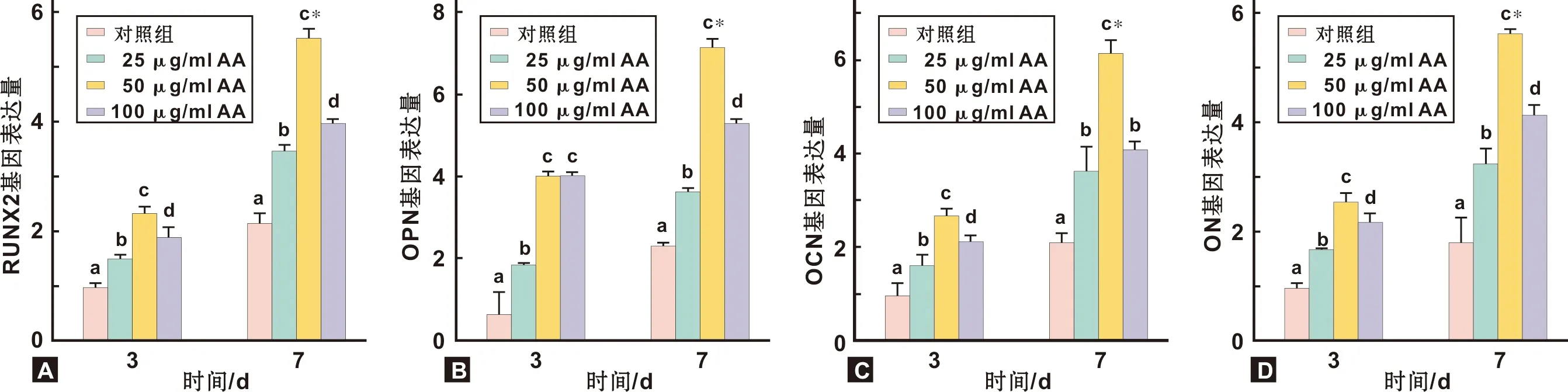
图4 各组细胞成骨分化相关基因mRNA表达量的比较(*与3 d相比,P<0.05; 同一时间点内各组两两相比,不同字母组间P<0.05)
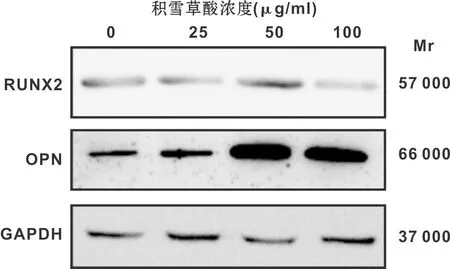
图5 各组细胞的蛋白表达
3 讨 论
牙周膜细胞的增殖、迁移和成骨分化是影响牙周组织愈合的重要因素,其中成骨分化尤为关键。本实验首次证实了50 μg/ml的AA可在矿化诱导的条件下显著促进人牙周膜细胞的成骨分化,且对细胞的增殖和迁移能力无明显影响。 根据文献回顾, 本实验首次证明AA对间充质细胞成骨分化的显著调节作用,为其在组织再生和修复方面的应用提供理论基础。
本实验证实50 μg/ml的AA在矿化诱导的条件下可增强人牙周膜细胞成骨功能,而对其增殖和迁移无明显影响。推测可能原因:①增殖和迁移实验细胞处于普通培养基微环境,而成骨诱导需要采用相应的诱导微环境,不同微环境下对细胞的特定功能影响不同;②采用更高浓度(大于100 μg/ml)的AA可能对人牙周膜细胞有显著影响,但浓度太高可能对细胞成骨分化不利。但对AA的临床使用而言,特定浓度可显著促进牙周膜细胞的成骨分化,但对增殖和迁移无影响,也可在一定程度上说明该浓度对细胞无毒性作用。
鉴于本课题组发现的AA在口腔局部可发挥抗炎[8]、促成骨的特性,可以推测,在口腔局部炎症状态下,如牙周炎、种植体周围炎和颌骨骨髓炎等,采用适宜的方法实现AA的局部递送或缓释,可发挥其抗炎功效的同时促进局部硬组织的修复,加速病损愈合。当然,这一假说需要后期大量体内实验的验证。
天然三萜烯代表一组具有药理活性且不同结构的有机复合物。对这类天然植物来源的化学物质吸引着全世界学者的关注。其中最具代表性的药物就是作为五环三萜烯的AA, 已被证实具有很广的用途和较高的药用价值。针对不同的疾病、不同病理阶段,AA及其衍生物发挥药理活性的作用机制可能不同,这已有大量文献报道[9]。AA往往通过多个通路发挥功效,在抗肿瘤方面,AA可通过平衡Smad3/Smad7信号通路调节NK细胞抗肿瘤免疫能力[10];通过降低肿瘤机制胶原从而提高肿瘤内的药物呈递作用[11];通过调节PI3K/Akt/mTOR/p70S6K信号通路抑制人结肠癌细胞的增殖和迁移,并诱导其凋亡[12];AA在结肠癌变过程中可缩短癌前病损、炎症、细胞增殖,并诱导凋亡[13]。
在改善肝功能方面,AA可通过PI3K/AKT/mTOR和Bcl-2/Bax信号通路减轻CCl4诱导的肝纤维化[14];通过抑制Notch信号通路激活减轻脂多糖诱导的损伤[15];AA通过PPARγ/NLRP3炎性体信号通路失活Kupffer细胞保护肝脏的缺血/再灌注损伤[16]。抗神经退行性方面,AA通过抑制α突触蛋白进入线粒体防止氧化应激和凋亡[17];通过调节PI3K/Akt/GSK-3β信号通路发挥对分化PC12细胞的抗凋亡作用[18];通过阻断NF-kB/STAT3/ERK信号通路和线粒体介导的凋亡通路减轻甲基苯丙胺诱导的神经炎症和毒性[19]。
除此以外,AA还可减轻高脂肪饮食诱导的生精损伤[20];有学者通过在水凝胶支架材料中加入AA复合物纳米颗粒,证实其能显著促进损伤创面上皮化、胶原纤维排列和血管化,同时发挥抗炎作用[21]。本实验证实AA促人牙周膜细胞的成骨分化,说明AA还有其它药理活性,且可能具有广阔的应用空间。
综上所述,不同浓度的AA对人牙周膜细胞的增殖和迁移均无显著影响,而中等浓度(50 μg/ml)的AA在矿化诱导的条件下可增强人牙周膜细胞成骨相关基因RUNX2、OPN、OCN、ON的表达水平,并增强其矿化能力。其具体局部应用的方式和效果,以及其具体的作用机制还需要进一步研究与证实。
