中性粒细胞外泌体诱导骨髓间充质干细胞分泌成血管相关因子的研究
2020-04-01谢纪荣黄鑫牟亚群赵路黎哲昊蔡卜磊高士军
谢纪荣 黄鑫 牟亚群 赵路 黎哲昊 蔡卜磊 高士军
大段骨缺损的修复一直是医学领域的难题,其根本原因在于新生组织内血管网络难以建立[1],从而导致缺损区域血供不足、营养缺乏、组织坏死,最终导致治疗失败[2]。大量研究也证实提高植入物血管化程度可有效促进新骨形成[3]。因此,通过促进血管网络的重建和再通来诱导大段骨缺损的修复再生,一直以来都是再生医学领域的研究热点[4]。
外泌体是一类直径为30~150 nm的脂质双层结构的细胞外囊泡,其含有蛋白、核酸等生物大分子用于细胞间信息传递,在血管、骨等多种组织再生中均具有重要作用[5]。此外,相关文献表明:中性粒细胞可募集、自由穿梭在受损组织区域[6],并可通过分泌多种细胞因子直接或间接地调控血管形成[7]。基于此,推测中性粒细胞来源外泌体(PMN-Exo)促进hBMSCs成血管相关因子表达,有望为骨组织工程血管化提供新思路。
1 材料与方法
1.1 实验动物
SPF级6~8 周龄C57小鼠,雄性,体重18~20 g(第四军医大学实验动物中心)。
1.2 主要试剂和仪器
α-MEM、RPMI 1640、胎牛血清(HyClone公司,美国);Exosome-depleted FBS Media Supplement(SBI公司,美国);OptimaTML-100 XP超速离心机(BECKMAN公司,美国)。
1.3 方法
1.3.1 hBMSCs的分离、培养及鉴定 知情同意下无菌收集第四军医大学口腔医院正颌患者颌骨块,α-MEM(10%FBS)冲洗骨髓提取原代,37 ℃、5%CO2常规培养至第三代待用。取第三代细胞PBS冲洗3 次,消化离心,一抗染色,流式检测。
1.3.2 小鼠中性粒细胞(PMN)的分离及培养 分离、暴露C57小鼠骨髓腔,RPMI 1640培养液(10%无外泌体血清)冲洗、过滤,细胞计数后免疫磁珠法提取PMN,37 ℃,5%CO2孵育。
1.3.3 小鼠PMN-Exo的提取 PMN培养24 h后收集上清,依次4 ℃条件下,1 500 r/min离心10 min,取上清4 000 r/min离心10 min,取上清10 0000×g离心30 min,取上清140 000×g离心70 min,弃上清PBS重悬后140 000×g离心70 min,弃上清,适量PBS重悬得到外泌体。
1.3.4 小鼠PMN-Exo的鉴定
1.3.4.1 形态学分析 取10 μl外泌体样品,铜网法上样,磷钨酸负染30 s,吸弃多余液体,静置5~10 min晾干,80~120 kV透射电镜成像。
1.3.4.2 粒径分析 取1 ml外泌体样品至样品池,采用纳米颗粒跟踪分析法(NTA)检测,重复3 次。
1.3.4.3 表面标志物分析 BCA法测定外泌体蛋白浓度,电泳,转膜,5%牛奶封闭1 h,TBST洗涤,CD81、CD9、TSG101一抗4 ℃孵育过夜,TBST洗涤,二抗室温孵育1 h,TBST洗涤,发光。
1.3.5 外泌体内吞观察 采用Dil标记外泌体,37 ℃与hBMSCs孵育2 h,4%多聚甲醛固定15 min,PBS冲洗,鬼笔环肽进行细胞骨架染色,DAPI染核,激光共聚焦下观察。
1.3.6 实验分组 在hBMSCs培养中分别加入PBS 10 μl和PMN-Exo 10 μl(浓度:2.9×1011/ml),作为对照组和实验组。
1.3.7 细胞增殖能力检测 1×105细胞接种24 h后加入EdU工作液。48 h后4%多聚甲醛固定,PBS(含3%BSA)冲洗,0.5%Triton X-100透化,PBS冲洗,加入适量Click-iT,室温孵育30 min,PBS冲洗后鬼笔环肽染色,Hoechst33342染核,激光共聚焦下采集图像、分析。
1.3.8 细胞迁移能力检测 分加外泌体组和不加外泌体组,接种细胞于24 孔板,细胞长满后,垂直于24 孔板底面划线,无血清培养,定时观察、拍照,对迁移率进行分析。
1.3.9 血管生成相关基因表达评估 采用QPCR检测血管生成相关基因VEGF、PDGF表达水平,从基因角度评估PMN-Exo对hBMSCs成血管的影响。引物序列见表1。

表1 QPCR引物列表(Takara)
1.3.10 成血管相关蛋白表达评估 采用WB检测成血管相关蛋白VEGF、PDGF表达水平,从蛋白角度评估PMN-Exo 对hBMSCs成血管的影响。
1.4 统计学分析
使用SPSS 20.0统计软件对数据进行统计分析,2 组间差异采用t检验。
2 结 果
2.1 hBMSCs的鉴定(流式细胞术)
CD流式鉴定结果表明:表达CD29、CD44的细胞分别占总细胞数的99.7%,99.9%,而表达CD34、CD45的细胞总细胞数占比分别为1.7%,2.2%(图1)。
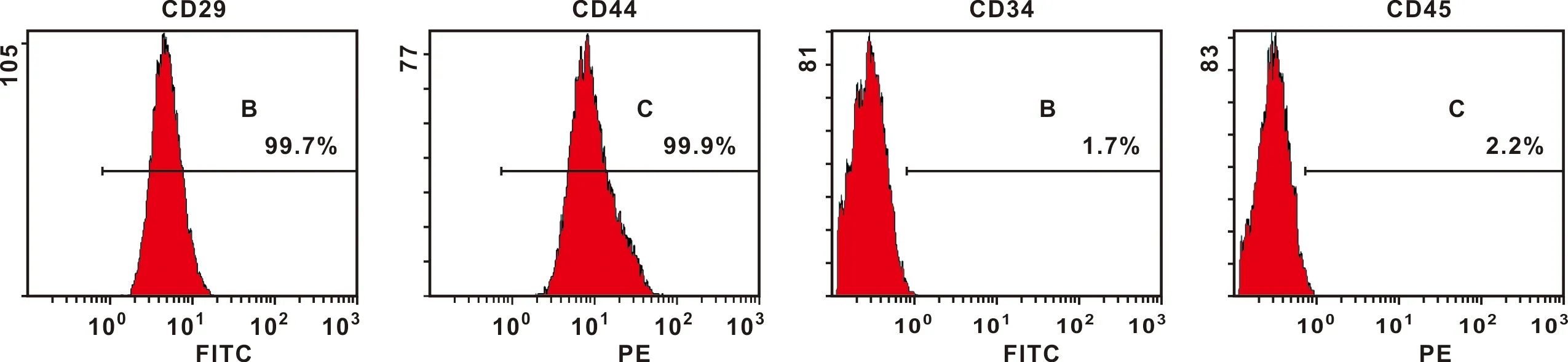
图1 hBMSCs的鉴定
2.2 PMN对hBMSCs成血管相关因子表达的影响(QPCR)
PMN、hBMSCs共培养1 d后,QPCR结果显示:与hBMSCs组相比,(PMN+hBMSCs)组成血管相关分子VEGF、PDGF表达显著上升(图2),提示PMN可有效促进hBMSCs成血管能力。
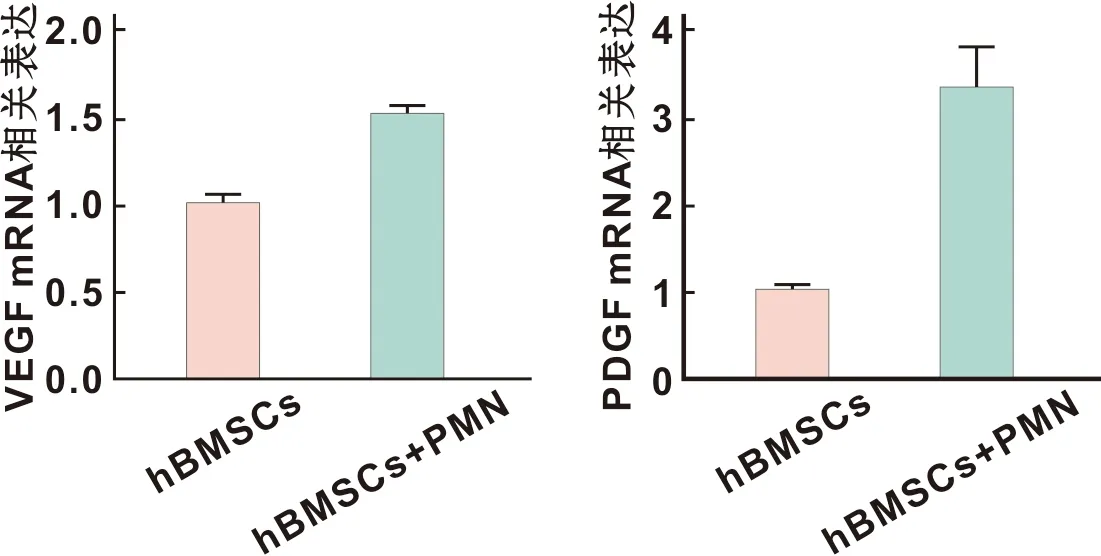
图2 hBMSCs成血管相关基因表达水平检测
2.3 PMN-Exo鉴定(TEM、WB、NTA)
透射电镜显示其双层膜结构,杯状外形,直径约100 nm;WB提示外泌体表面标志物CD9、CD81、TSG-101均有表达;粒径分析(NTA)提示90%以上外泌体大小直径在150 nm以内(图3),均符合外泌体鉴定标准。

图3 PMN-Exo鉴定
2.4 PMN-Exo内吞作用观察
结果显示:外泌体散在分布于细胞骨架区域(图4),提示PMN-Exo可成功进入hBMSCs内。

图4 PMN-Exo内吞作用(红: PMN-Exo; 绿: 细胞骨架; 蓝: 细胞核)
2.5 PMN-Exo对hBMSCs增殖能力的影响(EdU)
激光共聚焦及定量分析结果结果显示:PMN-Exo组EdU+细胞数明显多于PBS组(图5),提示PMN-Exo可显著提高hBMSCs增殖活性。

图5 细胞增殖活性检测(绿: EdU+细胞; 蓝: 细胞核)
2.6 PMN-Exo对hBMSCs迁移能力的影响(划痕实验)
结果显示:第20小时,PMN-Exo组细胞迁移距离、细胞相对迁移率明显大于PBS组(图6),提示PMN-Exo可显著提高hBMSCs迁移能力。

图6 细胞迁移能力检测
2.7 PMN-Exo对hBMSCs成血管相关因子表达的影响(QPCR、WB)
第5天,QPCR及WB结果示:PMN-Exo组血管生成相关分子(VEGF、PDGF)表达明显高于PBS组,提示PMN-Exo可显著促进hBMSCs成血管能力(图7)。

图7 hBMSCs血管生成相关分子检测
3 讨 论
目前促进组织工程骨血管化的方法主要有显微外科血管植入、支架材料复合促血管生成因子、以及支架材料复合血管内皮细胞等[8],然而,这些方法或多或少存在着移植来源乏,细胞因子作用靶点单一、控释难等一系列问题。因此,寻求一种高效促进组织工程骨血管化的策略显得尤为重要。
外泌体作为一种内含丰富物质、直径介于30~150 nm之间的功能性囊泡,可作为细胞间信号转导的靶向传递介质,从而高效调控细胞的行为和命运[5]。大量研究证实不同来源外泌体在血管、骨再生中发挥重要作用。有关学者发现:内皮祖细胞来源外泌体可通过转运miR-21-5p、抑制THBS1表达促进血管内皮细胞修复[9];Narayanan等[10]发现:hBMSCs来源的外泌体可显著提高体外细胞VEGF表达水平,促进hBMSCs成血管及成骨分化。
中性粒细胞是人血液中最丰富的白细胞,以往多认为其在炎症环境下可释放多种炎性因子促进局部血管网络发生[7],但其具体机制尚未阐明。而近年来发现中性粒细胞在炎症环境下所释放的外泌体有显著的促进组织修复的作用[11],因此推测:中性粒细胞来源外泌体(PMN-Exo)可能具有促进血管新生,加速组织修复的重要作用。
本研究首先成功鉴定hBMSCs[12],在验证PMN对hBMSCs成血管相关因子调控作用之后,分PBS组和PMN-Exo组,并对其内吞、增殖、迁移、分化能力进行了系列研究。与以往研究结论一致[7],PMN与hBMSCs共培养1 d后血管生成相关因子表达明显上升,证实了PMN可能在血管新生中有积极作用,但由于PMN自发凋亡的限制[13],难以对其进行长时间研究。本研究从多个角度对PMN-Exo进行了鉴定,并验证了其良好的hBMSCs内吞效果。细胞学结果表明:与PBS组相比,PMN-Exo组hBMSCs增殖活性更强、迁移速率更快、成血管相关因子表达更高。本研究初步证实了PMN-Exo可能是PMN加速组织内血管新生的潜在因素,后期实验将进一步验证PMN-Exo促进BMSCs表达血管再生因子的具体分子机制并在动物模型体内进行验证。
总之,中性粒细胞来源外泌体可有效促进hBMSCs成血管相关因子表达,进而可能促进血管新生,有望为骨组织工程血管化提供新思路。
