14-3-3σ蛋白在TCDD致胎鼠腭裂中的作用机制的初步研究
2020-04-01蒋亨王晨袁心刚傅跃先
蒋亨 王晨 袁心刚 傅跃先
腭裂是颅面部最常见的先天畸形之一[1]。2,3,7,8-四氯二苯二噁英(TCDD)具有发育毒性,导致小鼠胚胎腭裂高发[2]。本课题组前期以iTRAQ技术筛选TCDD与维甲酸致胎鼠腭裂发生的共同差异蛋白,发现14-3-3σ蛋白在TCDD与维甲酸致C57BL/6J胎鼠腭裂腭突标本中显著升高[3]。14-3-3蛋白家族在真核生物中广泛存在并高度保守,在多种生物过程中扮演重要角色[4]。其中14-3-3σ蛋白在调节上皮细胞增殖和分化中发挥独特作用[5]。14-3-3σ蛋白是P53的靶基因,P53通过调控14-3-3σ蛋白的表达调节细胞周期阻滞来应对DNA损伤[6]。本研究通过检测不同时期胎鼠腭突组织中14-3-3σ蛋白和mRNA、P53和磷酸化P53蛋白的表达,来探讨14-3-3σ蛋白在TCDD致胎鼠腭裂畸形中可能的作用及调控机制。本研究经重庆医科大学医学研究伦理委员会批准(编号: 20170120-2)。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 均符合实验室动物伦理标准,动物残余组织均由动物实验中心统一生物无害化处理。选择6~8 周龄、18~20 g的SPF级建康C57BL/6J小鼠雌鼠60 只,雄鼠20 只〔重庆医科大学实验动物中心[许可证号:SCXK(渝) 20050002]〕,饲养于SPF级动物实验室,温度22~24 ℃,湿度(55±5)%,循环光照明暗各12 h,普通实验室饲料、水源,自由饮水、摄食。 适应新环境2 周后,于黄昏按雌雄比例2∶1或3∶1合笼交配,次日晨雌雄分笼,检查雌鼠阴栓,称重标记;记录当天为胚胎期第0.5天(E0.5)观察体重至E10.5,体重增长小于2 g者视为未孕,重新合笼。最后获取48 只符合要求的孕鼠用于实验。
1.1.2 实验试剂 TCDD、玉米油(Sigma-Aldrich公司,美国);全蛋白提取试剂盒、BCA蛋白浓度定量试剂盒、SDS-PAGE 凝胶快速制备试剂盒和抗β-actin抗体、抗P53多克隆抗体(沈阳万类生物科技有限公司);14-3-3σ蛋白抗体(GeneTex公司,美国);DAB试剂盒、辣根过氧化物酶标记和兔二步法检测试剂盒二抗(北京中杉金桥生物技术有限公司);RNAiso Plus、SYBR®Premix EX TaqTMⅡ和PrimeScriptTMRT reagent kit with gDNA Eraser试剂盒(Takara公司,日本);PBS磷酸盐缓冲粉剂(北京鼎国昌盛生物技术有限公司);抗磷酸化P53多克隆抗体(SANTA CRUZ公司,美国)。
1.2 实验方法
1.2.1 动物处理与样本收集 将48 只孕鼠随机分为TCDD组与对照组,在E10.5时,按TCDD 28 μg/kg(以玉米油配制成5 μg/ml)给予孕鼠一次性灌胃;对照组等体积玉米油灌胃。各组孕鼠分别在E13.5、E14.5及E15.5二氧化碳麻醉处死。无菌条件下配合体式显微镜(Nikon DXM1200F)从孕鼠子宫取出胎鼠,剪取胎鼠头部,观察腭突生长情况并记录;部分完整胎头置于4%多聚甲醛溶液(4%PFA,pH 7.4)固定,腭突组织-80 ℃保存待用。
1.2.2 HE染色及免疫组组织化学染色 将2 组E13.5、E14.5及E15.5获得的胎头立即放入4%PFA(pH 7.4)中固定48 h后,胎头脱水后石蜡包埋,做头部冠状面连续切片(4 μm),部分切片常规HE染色,光镜观察拍照。用兔二步法检测试剂盒检测14-3-3σ蛋白组织表达:将切片脱蜡复水后,滴加3%过氧化氢溶液于切片上,湿盒孵育10 min,进行内源性过氧化物酶的淬灭处理。将切片浸入0.01 mol/L枸橼酸缓冲液中,微波中大火力加热至沸腾并保持8 min,取出容器,待缓冲液温度自然降到室温,反复2 次,完成抗原修复。滴加5%山羊血清,室温湿盒封闭30 min,滴加兔抗小鼠14-3-3σ蛋白的抗体(稀释1∶500)于切片上,4 ℃孵育过夜。 第2天,按照试剂盒说明书先后滴加试剂1、2,均在室温湿盒孵育15 min,漂洗后,按DAB试剂盒说明书配制DAB工作液后显色15 s左右,苏木素复染,1%盐酸酒精分化,脱水后滴加中性树脂,盖玻片封片,置于光学显微镜下观察拍照。
1.2.3 总RNA提取和实时定量PCR 用体视显微镜在无菌条件下剪取腭突。使用RNAiso Plus提取总RNA。根据说明书,使用PrimeScriptTMRT reagent kit with gDNA Eraser试剂盒进行逆转录。逆转录反应液被稀释相同倍数并作3个复孔,反应体系共10 μl: SYBR®Premix EX TaqTMⅡ 5 μl(Takara,日本),上下引物各0.4 μl(10 μmol/L),cDNA 0.8 μl,去酶水3.4 μl。反应系统:CFX96 real time system(Bio-Rad,美国)。反应条件:95 ℃ 预变性30 s,40 个循环(95 ℃变性5 s,50.4 ℃退火30 s),溶解曲线。使用2-ΔΔct方法计算相对定量值。引物的设计和合成均由上海生物工程技术公司完成,根据NCBI Nucleotide数据库,比对引物特异性。引物序列见表1。
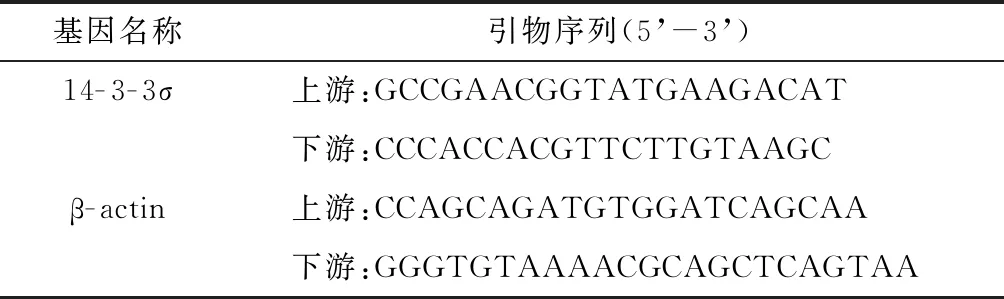
表1 小鼠14-3-3σ及内参β-actin引物序列
1.2.4 蛋白免疫印迹 将50 mg腭突组织用匀浆器冰上研磨,并按试剂说明书提取总蛋白质。使用BCA蛋白浓度定量试剂盒测定每个样品中总蛋白质的浓度。使用SDS-PAGE 凝胶快速制备试剂盒制备12%SDS-PAGE凝胶,电泳分离蛋白质(35 μg)并转移到PVDF膜。将膜浸入含5%脱脂奶粉的TBST溶液,在室温下封闭2~3 h,将膜分别与抗14-3-3σ蛋白多克隆抗体、抗P53多克隆抗体、抗磷酸化P53多克隆抗体及抗β-actin多克隆抗体,稀释比均为1∶1 000,在4 ℃孵育过夜。次日用辣根过氧化物酶标记的二抗以1∶2 000室温孵育2 h,以超敏ECL试剂显影拍照(基因,Gene Gnome5),Image J分析灰度值。目的蛋白的相对表达量用目的蛋白条带灰度值与同一总蛋白的β-actin条带灰度值的比值来表示。
1.3 统计学分析
2 结 果
2.1 对照组与TCDD组胎鼠腭部发育
E13.5~E15.5,对照组从孕鼠获得活胎鼠共计144 只,死胎和吸收胎3 只,E15.5活胎未见腭裂发生;E13.5~E15.5,TCDD组获得活胎鼠共139 只,死胎和吸收胎5 只,E14.5活胎中可见大部分双侧腭突未能接触,E15.5腭裂发生率100%。腭部冠状HE染色切片观察发现:E13.5,对照组双侧腭突垂直于舌体两侧向下生长,TCDD组两侧腭突亦垂直于舌体两侧向下生长,但较对照组腭突小且生长迟缓;E14.5,对照组两侧腭突抬升至舌体上方,呈水平位向对侧生长互相接触并形成腭中缝,TCDD组舌体下降延迟,两侧腭突亦未能抬升至水平方向;E15.5,对照组腭中缝上皮消失,双侧腭间充质部汇合,腭融合完成,形成完整腭部,将鼻腔和口部隔开,TCDD组双侧腭突虽抬升至水平位,但腭突发育迟缓,且未能在中线处相互接触和融合,形成腭裂(图1)。

P: 腭部; T: 舌体; NS: 鼻中隔; B: 脑组织; Mdb: 下颌骨
2.2 14-3-3σ蛋白在腭突组织的表达
E13.5两组均未见明显的14-3-3σ蛋白阳性表达细胞。E14.5,对照组口腔和鼻腔侧上皮三角及腭中缝上皮可见14-3-3σ蛋白阳性表达细胞;TCDD组腭突尖端与舌体接触处附近上皮有14-3-3σ蛋白阳性表达细胞。E15.5,对照组仅在腭部口腔侧原上皮三角上皮有少量14-3-3σ蛋白阳性表达细胞;TCDD组腭突内侧上皮可见局部14-3-3σ蛋白阳性表达细胞,实线框内为间充质部14-3-3σ蛋白阳性表达细胞(图2)。
实时荧光定量PCR检测结果显示:TCDD组14-3-3σ mRNA表达较对照组升高(P<0.05,表2)。
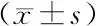
表2 胎鼠腭突组织14-3-3σ mRNA相对表达量
P: 腭突; T: 舌体; Mdb: 下颌; 箭头指示14-3-3σ蛋白阳性表达细胞
2.3 14-3-3σ蛋白及相关蛋白表达
TCDD组14-3-3σ蛋白表达为较对照组显著升高(P<0.05,表3)。
E13.5,TCDD组P53蛋白表达较对照组升高(P<0.05),E14.5和E15.5,2 组P53蛋白表达差异无统计学意义(表3)。E13.5和E14.5,TCDD组磷酸化P53蛋白表达较对照组显著升高(P<0.05);E15.5,2 组磷酸化P53蛋白表达差异无统计学意义(表3,图3)。
表3 胎鼠腭突组织14-3-3σ、P53和磷酸化P53蛋白相对表达量

N: 对照组(Control group); T: TCDD组(TCDD group)
3 讨 论
在小鼠模型中,双侧腭突的内侧边缘上皮(MEE)在E14.5时开始接触并黏附到对侧腭突,MEE形成腭中缝(MES),并最终消失。MES的消失和间充质连续性的建立对于完成腭融合过程是必不可少的[7]。通常认为MEE通过细胞凋亡、上皮-间质转化(EMT)和上皮迁移而消失,MEE细胞未能崩解,阻止两侧腭突融合导致腭裂[8]。
本课题组前期探索出TCDD 28 μg/kg是建立C57BL/6J胎鼠腭裂模型的最适剂量[9]。Yamada等[2]发现,在E14~E16,TCDD处理的胎鼠中有一部分被观察到双侧腭突互相接触,但是最终所有腭突都不会融合并且相互分离,有研究者三维重建腭器官也发现实验组双侧腭突延迟于对照组靠拢,但并未融合,形成腭裂[10]。这提示TCDD组腭突虽然生长迟缓,但亦有部分腭突接触,又分开,最后所有胎鼠呈现腭裂表型。本研究中HE切片未观察到TCDD组双侧腭突接触,可能是因为腭突从接触到分开这个过程极为短暂、不易观察。有学者发现,14-3-3σ蛋白通过介导Yap1的细胞定位来调节皮肤角质形成细胞的增殖和分化[11]。亦有研究发现,14-3-3σ蛋白基因沉默稳定c-Jun蛋白导致上皮细胞向间充质细胞转变的激活[12]。本实验免疫组化发现14-3-3σ蛋白主要表达于与腭突接触和融合密切相关的腭上皮细胞中。且14-3-3σ蛋白在TCDD组E13.5、E14.5和E15.5均较对照组表达升高。E13.5~E15.5是腭部发育关键时期,E14.5更是腭中缝上皮细胞在双侧腭突接触后形成腭中缝的关键时间点[13]。结合免疫组化的结果,少部分MEE迁移至间充质部,却因14-3-3σ蛋白持续表达而未能向间充质转化,我们推测TCDD组14-3-3σ蛋白在这一关键时期表达升高抑制了上皮间充质转化,维持MEE细胞表型,使得接触的双侧腭突复又分开,导致腭裂发生。14-3-3σ蛋白是受P53调控的G2周期调控分子,P53主要通过P21和14-3-3σ蛋白诱导细胞周期停滞[6]。磷酸化P53蛋白是P53蛋白的激活状态。在本实验中检测到E13.5时TCDD组P53蛋白表达较对照组升高,E13.5和E14.5时TCDD组磷酸化P53蛋白较对照组表达升高;推测TCDD在E10.5作用于胚胎后引起腭发育早期(E13.5)P53蛋白表达量升高,磷酸化P53在E13.5和E14.5表达量亦升高,促进14-3-3σ蛋白表达上调,诱导细胞周期阻滞,干扰正常腭发育进程。
总之,本研究提示14-3-3σ蛋白在TCDD组腭发育关键时期表达升高,可能是腭发育早期TCDD作用下P53通路激活,引起细胞周期阻滞所致。并且TCDD组14-3-3σ蛋白表达升高,可能抑制上皮间充质转化,使得腭中缝上皮持续存在,干扰了正常的腭发育进程,导致腭裂形成。但14-3-3σ蛋白在腭发育过程中所起的作用,尚需要进行更深入的研究,以期为孕期腭部发育异常的防止带来新的干预靶点。
