合并肺间质病变或恶性肿瘤皮肌炎患者的外周血差异基因表达分析
2020-03-21薛珂权晟赵茜刁立诚陈梦雅朱雪梅郑捷曹华黎皓上海交通大学医学院附属瑞金医院皮肤科0005上海交通大学医学院附属瑞金医院呼吸与危重症医学科0005上海交通大学医学院附属瑞金医院肿瘤科0005
薛珂 权晟 赵茜 刁立诚 陈梦雅 朱雪梅 郑捷 曹华 黎皓上海交通大学医学院附属瑞金医院皮肤科 0005;上海交通大学医学院附属瑞金医院呼吸与危重症医学科 0005;上海交通大学医学院附属瑞金医院肿瘤科 0005
目前把以皮肌炎(dermatomyositis,DM)典型皮损为主要表现、至少6个月没有肌炎表现或者实验室检查存在轻度异常的患者统称为临床无肌病性皮肌炎(clinical amyopathic dermatomyositis,CADM)或皮肌炎样皮病[1]。DM/CADM病因不明,临床表现呈多样性和异质性。CADM患者往往在疾病早期仅有皮肌炎的皮肤表现,而数周或数月后突然出现急进型肺间质病变(interstitial lung disease,ILD),同时伴有发热、气促,很快进展为呼吸衰竭,影像学表现为两肺弥漫性渗出伴毛玻璃影等间质性改变,从出现皮疹到死亡平均2~6个月[2]。13%~42%的DM/CADM病例伴有肿瘤,大多为实体瘤,可能在DM/CADM确诊1年或数年后出现,此时由于已使用大剂量糖皮质激素等免疫抑制剂和严重的皮肤损害、肌肉症状,可能延误手术时机[3-4]。因此早期诊断和治疗DM/CADM及其合并症可以改善预后,提高生存率。高通量RNA测序(RNA-Seq)技术可以在没有某一物种完整基因组序列的情况下,准确获取特定组织在某一状态下转录组基因的全部信息,完整记录该条件下基因表达水平、生物学过程的分子机制以及遗传标记信息等[5]。目前国内外已有报道将RNA-seq技术用于银屑病、系统性红斑狼疮、婴儿血管瘤以及硬皮病等疾病的研究[6-9]。我们通过RNA-seq技术对合并ILD或恶性肿瘤的DM/CADM进行高通量转录组测序,研究其可能的发病机制,同时为治疗提供潜在靶点。
对象与方法
一、对象
2017年1月至2018年1月于上海交通大学医学院附属瑞金医院皮肤科确诊的DM/CADM患者27例,所有患者纳入研究前均未接受治疗或1个月内仅接受小剂量糖皮质激素(泼尼松剂量不超过10 mg/d)治疗。其中女19例,男8例,年龄20~79(51.00±13.80)岁。按照合并症状分为3组,即合并ILD组10例,合并恶性肿瘤组8例,无ILD和恶性肿瘤组9例。上述患者的诊断均满足Bohan-Peter的DM分类标准[10]或Sontheimer的CADM诊断标准[11]。ILD诊断标准:①肺功能异常,具体表现为限制性通气功能障碍,弥散功能降低,CO弥散率(DLCO)<80%时具有诊断意义;②不明原因的静息或活动后气促;③不明原因干咳>3个月;④肺部听诊闻及Velcro啰音;⑤肺高分辨率CT有ILD的影像学改变。符合上述ILD诊断标准中1项及以上且发病时病原学检查排除肺部感染时诊断为ILD。同时收集7例门诊体检患者作为健康对照,均无系统性疾病和自身免疫性疾病及其家族史,其中女4例,男3例,年龄25~70(54.00± 18.65)岁,与患者组性别、年龄差异均无统计学意义(P值分别为0.656、0.373)。本研究通过上海交通大学医学院附属瑞金医院医学伦理委员会批准(2016临伦审第105号),所有受试者均签署知情同意书。
二、方法
1.样本收集:采集DM/CADM患者和健康对照者外周血2.5 ml于Paxgene RNA全血管(美国BD公司)中,保存于-80℃冰箱中直至送样测序。
2.RNA-seq测序:保存于Paxgene RNA全血管中的全血经检测合格后,利用Oligo(dT)磁珠和磁分离器分离并纯化mRNA。将mRNA打断为片段,通过PCR扩增富集得到DM/CADM患者外周血转录组cDNA文库,最后对构建好的文库进行高通量测序。测序由武汉华大医学检验所有限公司协助完成,通过BGI-SEQ-500平台共检测34个样本。对测序获得的原始数据进行过滤(即质量控制),去除原始数列中低质量、接头污染以及未知碱基N含量过高的短序列(reads)。采用滤过后序列中质量值大于20或30的碱基数占总碱基的比例(Q20/Q30)来表示数据质量,Q20和Q30越大,数据质量越高,采用HISAT软件将这些数据比对到参考基因序列,获得比对率,比对率越高,则数据结果越可靠。
3.差异基因表达及GO与KEGG通路分析:对过滤后所得数据进行差异表达基因(differential expressed genes)筛选,筛选标准:①差异表达倍数>2或<1/2,即|log2(差异倍数)|>1;②错误发现率(false discovery rate)<0.05。进一步对差异基因进行基因本体论(gene ontology,GO)功能注释和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析。GO按功能分别为分子功能、细胞组分和生物过程。
三、统计学方法
全部实验数据用GraphPad Prism 6.01统计软件处理。数据符合正态分布时,多组间比较采用单因素方差分析,两组间比较采用t检验;数据不符合正态分布时,多组间比较采用Kruskal-Wallis H检验,两组间比较采用Mann-Whitney U检验。P<0.05为差异有统计学意义。
结 果
一、RNA-seq数据质量分析
通过测序,每个样本平均产出21.71 Mb数据,比对基因集的平均比对率为79.83%,共检测到18 072条基因。数据过滤后,平均每个样本Q20达到98.56%,Q30达到91.94%。样品比对基因组的平均比对率达94.42%。
二、DM/CADM患者差异表达基因及其功能注释
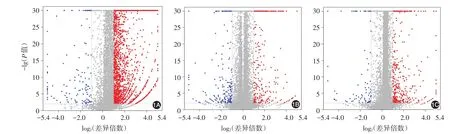
图1 皮肌炎/临床无肌病性皮肌炎(DM/CADM)患者差异基因火山图 1A:DM/CADM组与健康对照组比较,4 820条基因表达上调,137条基因表达下调;1B:合并肺间质病变组与无肺间质病变和恶性肿瘤组比较,272条基因表达上调,158条基因表达下调;1C:合并恶性肿瘤组与无肺间质病变和恶性肿瘤组比较,398条基因表达上调和68条基因表达下调
DM/CADM患者与健康对照相比,差异表达的基因共4 957个,其中4 820条基因表达上调,137条基因表达下调(图1A)。上调倍数最高的前10位基因分别为MTPN、SLC6A3、EIF3CL、HSPE1-MOB4、G0S2、C-X-C 趋化因子配体 2(CXCL2)、TBC1D3K、C-C趋化因子配体8(CCL8)、RGPD6、AREG;下调倍数最高的前10位基因分别为GAGE12B、GAGE4、STC2、GAGE2D、MAGEA6、MAGEC2、GAGE5、CSMD2、GAGE7、NPPB。通过差异表达基因的GO功能分析得到分类条目49个,其中8个(16.3%)与细胞组分相关,4个(8.2%)与分子功能相关,37个(75.5%)与生物过程相关(图2A)。
KEGG信号通路分析显示,与健康对照相比,DM/CADM患者具有43条显著差异性富集通路(P<0.05),其中前10位的通路分别为细胞周期、无翅基因(Wnt)信号通路、基底细胞癌、西罗莫司靶蛋白(mTOR)信号通路、黑素合成、RNA降解、线粒体自噬、成人T淋巴细胞白血病病毒Ⅰ型感染、肿瘤中的蛋白聚糖以及转录因子(图3A)。
三、合并ILD的DM/CADM患者差异表达基因及其功能注释
合并ILD组与无ILD和恶性肿瘤组相比,差异表达的基因共430个,其中272条基因表达上调,158条基因表达下调(图1B)。上调倍数最高的前10位基因分别为EIF3CL、CCL20、IL1A、SLC6A3、FOXD4L3、LIMS3、PTGES3L-AARSD1、ALX4、TBC1D3H、CLEC14A;下调倍数最高的前10位基因分别为 TBC1D3K、COL26A1、NPIPA7、TBC1D3F、TRIM49D2、FAM187B、POTEE、CYP26B1、TRIM64、TRIM64B。这些差异表达基因主要编码Ⅰ型干扰素诱导趋化因子(MCP-1)和表皮生长因子,参与转录和自噬。通过差异表达基因的GO功能分析得到显著富集条目157个,其中27个(17.2%)与细胞组分相关,16个(10.2%)与分子功能相关,114个(72.6%)与生物过程相关(图2B)。
KEGG信号通路分析显示,与未合并ILD和恶性肿瘤组相比,合并ILD组具有41条显著差异性富集通路(P<0.05),前10位分别为疟疾、沙门菌感染、白细胞介素17(IL-17)信号通路、肿瘤坏死因子信号通路、细胞因子及其受体相互作用、趋化因子信号通路、类风湿关节炎、Toll样受体信号通路、军团杆菌感染和百日咳(图3B)。
四、合并恶性肿瘤的DM/CADM患者差异表达基因及其功能注释
合并恶性肿瘤组与无ILD和恶性肿瘤组相比,差异表达的基因共466个,其中398条基因表达上调,68条基因表达下调(图1C)。上调倍数最高的前10位基因分别为 EIF3CL、TBC1D3H、C2CD4B、AREG、RASD2、H2AFB3、KIR2DL5B、CH25H、PALMD、GTF2H2C;下调倍数最高的前10位基因分别为TBC1D3K、CYP26B1、RIMBP3C、TRIM6-TRIM34、PCDHGA3、SYT5、WIF1、POTEE、FAM187B、SPDYE2B。通过差异表达基因的GO功能分析得到显著富集条目117个,其中11个(9.4%)与细胞组分相关,12个(10.3%)与分子功能相关,94个(80.3%)与生物过程相关(图2C)。
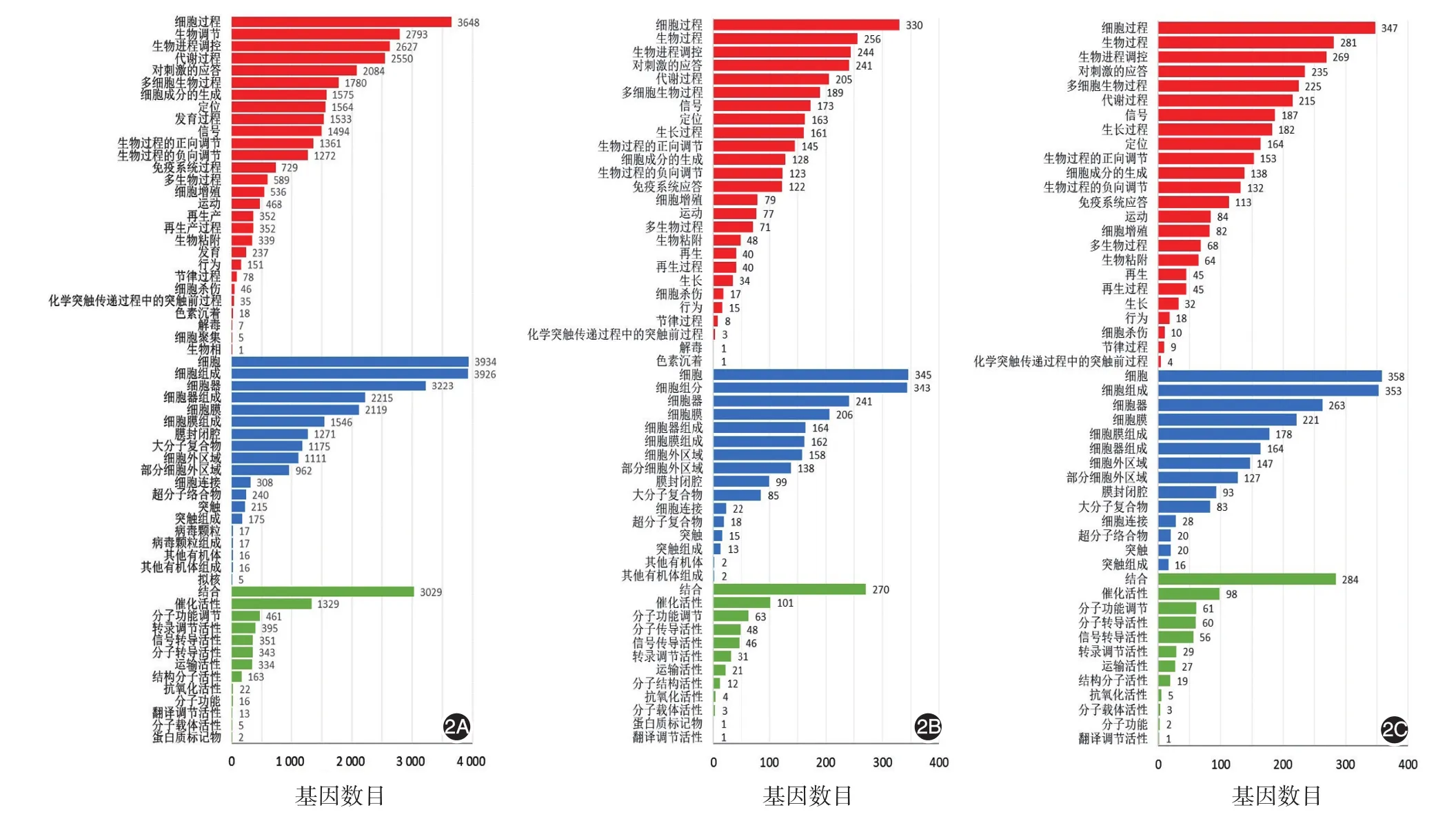
图2 皮肌炎/临床无肌病性皮肌炎(DM/CADM)患者差异基因基因本体论(GO)功能注释 2A:DM/CADM患者组与健康对照组比较;2B:合并肺间质病变的DM/CADM患者组与无肺间质病变和恶性肿瘤的DM/CADM患者组比较;2C:合并恶性肿瘤组与无肺间质病变和恶性肿瘤组比较
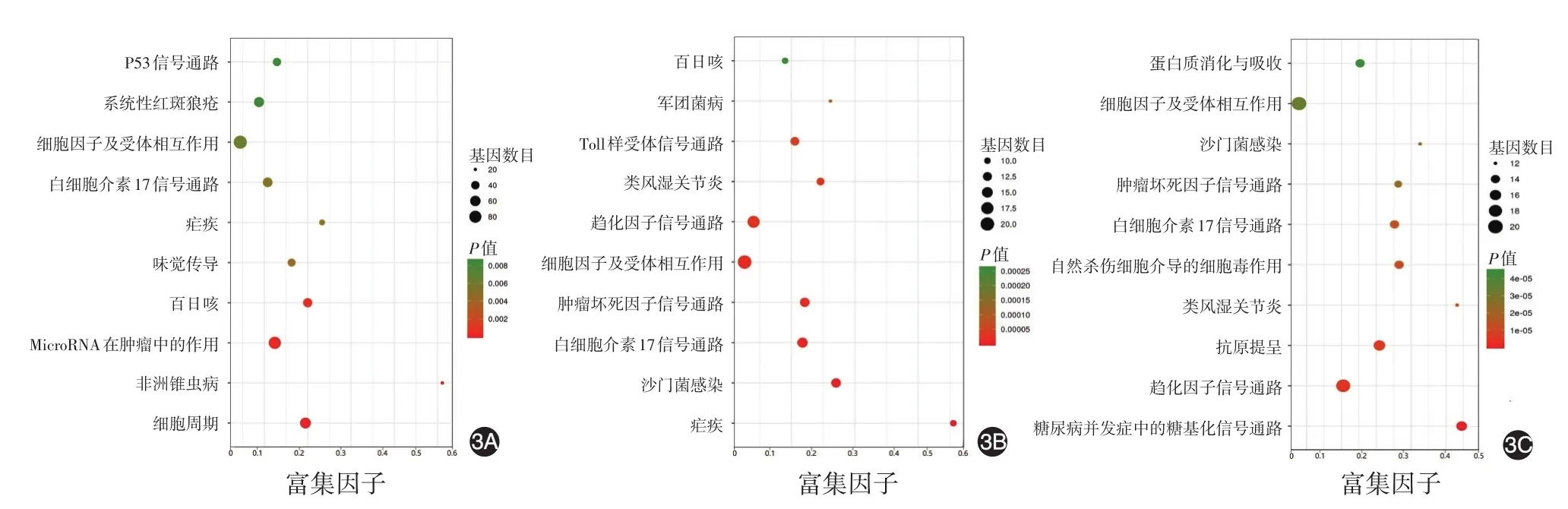
图3 皮肌炎/临床无肌病性皮肌炎(DM/CADM)患者差异基因京都基因与基因组百科全书(KEGG)通路富集分析 3A:DM/CADM患者组与健康对照组比较;3B:合并肺间质病变组与无肺间质病变和恶性肿瘤组比较;3C:合并恶性肿瘤组与无肺间质病变和恶性肿瘤组比较
KEGG信号通路分析显示,与无ILD和恶性肿瘤组相比,合并恶性肿瘤组具有显著差异性的富集通路32条(P<0.05),前10位分别为糖基化、趋化因子通路、抗原提呈、类风湿关节炎、自然杀伤细胞介导的细胞毒作用、IL-17信号通路、肿瘤坏死因子信号通路、沙门菌感染、细胞因子及其受体互相作用、蛋白质的消化与吸收(图3C)。
讨 论
DM/CADM是多种因素诱发的特发性炎症性肌病,通常认为感染、药物、遗传等因素参与其发病[12],但具体发病机制尚不清楚。目前研究表明[13],在系统性红斑狼疮、银屑病、类风湿关节炎等多种自身免疫病以及炎症性疾病中mRNA异常表达。我们通过RNA-Seq技术研究DM/CADM患者差异表达基因及其所富集的通路,发现DM/CADM患者与健康对照相比差异表达基因中上调基因占绝大部分,提示多种基因的高表达可能参与疾病的发生。这些差异表达的基因主要编码MCP-1和表皮生长因子,参与转录和自噬。Bilgic等[14]也曾报道,MCP-1在合并ILD的DM/CADM中显著高表达。已知线粒体自噬与免疫系统密切相关[15],参与病原体的识别和降解、抗原提呈及T细胞的发育、分化等多个环节,参与多发性硬化、系统性红斑狼疮、系统性硬化等自身免疫病的发病过程。自噬相关分子西罗莫司靶蛋白(mTOR)、微管相关蛋白1轻链3-Ⅱ型、低氧诱导因子1α等参与皮肌炎发病的具体机制尚不明确[16]。我们发现,在DM/CADM患者中mTOR激活分子LAMTOR1和HIF1A mRNA显著高表达,提示自噬可能参与DM/CADM的发病机制。DM/CADM患者中显著上调的通路主要涉及肿瘤、感染和免疫反应等,其中肿瘤相关通路占50%。
DM/CADM患者临床表现呈多样性、异质性,部分患者合并ILD或者恶性肿瘤。我们分析了不同临床表型DM/CADM患者的外周血差异基因及其所富集的通路。合并ILD的DM/CADM患者中,细菌感染、细胞因子/趋化因子等通路显著富集,并未见肿瘤相关通路。由于难以进行肺组织活检,ILD的致病原尚未明确。病毒感染是诱发或加重皮肌炎的重要因素[17-18],但至今未找到病毒感染的确切依据。多项研究显示,细菌感染在红斑狼疮和银屑病的发病中起重要作用[19-20]。DM患者的皮肤和肌肉组织中抗菌肽LL-37表达增加[21],结合我们RNA-Seq结果中细菌感染富集通路显著高表达,推测细菌很可能也是DM/CADM合并ILD的致病原,其机制需要进一步研究。目前认为Ⅰ型干扰素通路的活化是DM/CADM发病机制的重要环节,多项研究已发现合并急进型/亚急性ILD的DM/CADM患者血清存在相关抗体,易发生溃疡性Gottron丘疹/征,死亡率高,预后差[22]。多项研究表明,血清IL-6、IL-18、干扰素β、CCL-2、CXCL-9和CXCL10等细胞因子和趋化因子水平与DM/CADM合并ILD严重程度相关[23-26]。本研究从转录水平证实并发ILD的DM/CADM患者细菌感染和细胞因子/趋化因子通路显著富集。
目前研究表明,肿瘤的发生与交叉免疫反应、免疫功能紊乱、病毒感染以及遗传因素有关[27]。我们从基因转录水平发现,DM/CADM患者病毒感染、免疫相关通路显著富集。此外,Wnt信号通路及肿瘤代谢通路占显著富集通路的大部分(50%),提示DM/CADM患者可能在基因转录水平即有肿瘤发生的倾向。在合并恶性肿瘤的DM/CADM患者中差异基因显著富集于肿瘤相关糖基化、蛋白代谢以及自身免疫过程中的抗原提呈和细胞毒作用等通路,而非细菌感染通路。糖基化终产物结合受体即双向调节蛋白(amphiregulin)通路对肿瘤的发生十分重要,是肿瘤微环境关键调节因子,与肿瘤恶性生长、产生耐药性以及远处转移等相关,扮演着促癌角色[28]。DM/CADM患者肿瘤微环境的改变可能是肿瘤发生的直接原因,而抗原提呈和自然杀伤细胞的细胞毒作用均在抗肿瘤过程中发挥重要作用[29-30]。
DM/CADM患者易合并ILD特别是急进型ILD或恶性肿瘤,预后差,死亡率高。对DM/CADM患者早期诊断和干预治疗,有助于降低死亡率,提高生存率。肿瘤、感染、免疫反应等通路基因转录水平的改变可能参与DM/CADM的发病。细菌感染、细胞因子/趋化因子通路在合并ILD的DM/CADM患者中显著富集;而糖基化、蛋白代谢以及抗原提呈和自然杀伤细胞的细胞毒作用在合并恶性肿瘤的DM/CADM患者中显著富集。这些不同的富集通路可能为明确DM/CADM的发病机制以及为早期判断和干预合并症的发生提供潜在的标志物。然而本文为DM/CADM患者基因组的初步研究,病例数较少,将来还需要进一步扩大样本量进行研究。
利益冲突所有作者均声明不存在利益冲突
