碳钢电极和镍电极的腐蚀及钝化行为研究
2020-03-20田志美代秀霞田友华宋崇富
田志美,代秀霞,田友华,宋崇富*
(1.阜阳师范大学 化学与材料工程学院,安徽 阜阳 236037;2.潍坊文华学校,山东 潍坊 261100;3.潍坊高新技术产业开发区北海学校,山东 潍坊 261031)
在金属材料中,在周围介质的作用下,金属材料遭到破坏,这种行为称为金属腐蚀。当金属开始腐蚀时,因为金属界面上存在着多种化学反应和电化学反应,此时会有部分金属离子产生。金属的腐蚀不仅会使金属材料的外形被破坏,还会使其塑性、韧性、强度等多种性能大大降低,对金属材料的应用造成巨大的影响。金属腐蚀有化学腐蚀和电化学腐蚀两种途径。化学腐蚀一般是由于金属表面能与周围介质直接发生化学反应而引起的腐蚀;电化学腐蚀是由于金属材料与电解质溶液接触,发生电极反应而产生的腐蚀。根据数据统计,由金属腐蚀而报废的金属制品的质量几乎占全世界金属年产量的百分之三十,这个数值是非常庞大的,金属的腐蚀还会造成金属制品的破坏从而导致经济损失。总而言之,金属的腐蚀造成的损失不可估量。我们对其进行研究是非常必要的。
实验上,金属腐蚀方面的相关研究较为广泛。扈显琦等研究了交流阻抗技术的发展及应用,证明交流阻抗技术发展与应用的必要性[1];张鹏辉等研究了铁和刚在浓碱溶液中的阳极极化曲线,发现铁和钢在三种不同的碱性溶液中均有腐蚀,腐蚀情况与溶液浓度相关[2];许淳淳等使用电位扫描技术研究了X70管线钢在CO32-/HCO3-溶液中的电化学行为,讨论了HCO3-浓度对阳极极化的影响[3];徐一慧等研究了304不锈钢在硝酸环境中的腐蚀电化学行为,发现随温度的升高,304不锈钢在硝酸中的腐蚀电流密度呈增大的趋势[4];席艳君等研究了Fe-Cr-Ni电镀层在工业废水中的腐蚀行为,发现镀层对延缓电化学腐蚀性能作用较差[5];张晓东等研究了船体钢海水腐蚀研究进展,总结了影响船体钢耐腐蚀性的因素[6];赵天雷等研究了10号碳钢在NaOH溶液中的腐蚀电化学行为,证实碳钢电极可以在NaOH溶液中腐蚀和钝化[7];谷宁研究了碳钢在中碱性介质中的腐蚀行为,得出碳钢在中碱性介质中的腐蚀速率小于酸性介质[8];陈顺玉等研究了金属极化行为的影响因素,得出影响金属极化行为的因素有电解质种类,电解质溶液浓度,温度[9];线性电位扫描法测定镍在硫酸溶液中的钝化行为表明,镍片在硫酸溶液中具有化学腐蚀和极化行为,并且受KCl溶液的影响比较明显[10]。
本论文拟采用碳钢电极和镍电极,测定电极在不同电解质溶液中的极化曲线,并研究了KCl加入量对极化和腐蚀的影响。同时,改变温度和电解质溶液浓度,进一步探讨了条件改变对电极腐蚀和极化行为的影响。
1 实验部分
1.1 试样与溶液
NaOH溶液(1%、10%、20%、30%);氨水-碳酸氢铵溶液(1∶1);硫酸溶液(0.1、0.2、0.3、0.4 mol/L);KCl溶液(0.02、0.04、0.06、0.08、0.1 mol/L)。实验所用药品都是分析纯的,实验中所用蒸馏水是二次水。
1.2 实验方法
电化学实验运用HDY-I型恒电位仪完成,采用三电极体系,工作电极是碳钢电极或镍电极,参比电极是饱和甘汞电极,辅助电极是铂电极。数据处理运用origin 8.5软件。
实验开始前,首先对工作电极进行处理。用金属相砂纸将电极擦到光亮,之后将电极放入含有1 mL的H2SO4溶液的100 mL的蒸馏水中浸泡1 min,取出后用蒸馏水冲洗后再用滤纸擦干备用。
分别量取30 mL的NH4HCO3饱和溶液和浓氨水,混合后倒入电解池。工作电极表面要靠近毛细管口。
接通电源,在参比模式下,负载选择电解池,仪器接通,此时仪器显示的电位为自然电位,应大于0.8 V以上,表明电极处理得当。
将负载选择在电解池上,间隔20 mV,逐渐调大,等电流稳定时记录恒电位和电流值。电压直到调到约1.2 V为止,记录相应的电流值。
2 结果与讨论
2.1 碳钢电极在碱性溶液中极化曲线的测定
2.1.1碳钢电极在氨水和碳酸氢铵(1∶1)混合溶液中的极化曲线
在本实验中所用电解质溶液是氨水和碳酸氢铵(1∶1)混合溶液和一系列不同浓度的氢氧化钠溶液(1%、10%、20%、30%)。通过改变温度和电解质溶液的浓度来测定碳钢电极在两种溶液中的极化曲线。我们所测得的极化曲线如图1所示。由于氨水体系在较高的温度下便会分解,所以本实验设置的最高温度为25℃。本组实验有两个变量,即温度和加入NaOH的量。由图1和图2可以看出:(1) 碳钢在氨水体系中既钝化又腐蚀,而且这种趋势随着温度的增加而增加。(2) 碳钢在氨水体系中加入NaOH溶液,随着NaOH溶液加入量的增多会抑制钝化加强腐蚀,直至NaOH加入的量为8 mL时只钝化不腐蚀。在第一组实验中我们得出了NaOH溶液的加入能够抑制碳钢电极在氨水体系中的腐蚀,所以在第二组实验中我们将电解质溶液换为NaOH溶液,进一步研究碳钢电极在强碱性条件下的腐蚀与钝化。
2.1.2碳钢电极在不同浓度,不同温度的NaOH溶液中的极化曲线
第二组实验采用的NaOH溶液浓度分别为1%、10%、20%、30%(质量百分比),使用恒温水浴保持定温,研究了以下几个温度时碳钢电极的化学行为,25、35、45、55、65、75℃,结果如图3和图4所示。从图3和图4我们看出,在1%的NaOH溶液和10%的NaOH溶液中,25℃时极化曲线有峰值,即存在着微弱的腐蚀;而随着温度升高和NaOH浓度增大,极化曲线只出现非线性增长,而且增长的程度随温度和浓度增大而增大,即只存在钝化。所以我们得出的结论如下:(1)碳钢在恒定温度时随着NaOH溶液浓度的增大,腐蚀消失钝化程度增大。(2)碳钢在NaOH溶液浓度恒定时,随着温度升高,只钝化不腐蚀。
以上两组实验是关于碳钢电极在两种不同的碱性溶液中的腐蚀和钝化行为的研究。我们又探究了碳钢电极在0.1 mol/L的H2SO4溶液中的极化曲线,通过实验我们发现其极化曲线一直呈线性增长。

图1 碳钢电极在氨水体系中随温度变化的极化曲线Fig.1 Polarization curves of carbon steel electrode changing with temperature in ammonia water system

图2 不同温度碳钢电极在氨水体系改变NaOH加入的量的极化曲线Fig.2 Polarization curves of carbon steel electrode at different temperatures changing NaOH content in ammonia water system
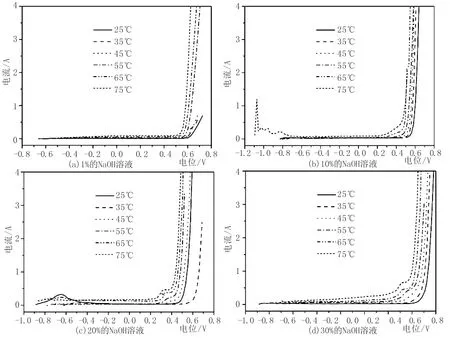
图3 碳钢电极在不同浓度的NaOH溶液中随温度变化的极化曲线Fig.3 Polarization curves of carbon steel electrode with temperature in NaOH solution of different concentration
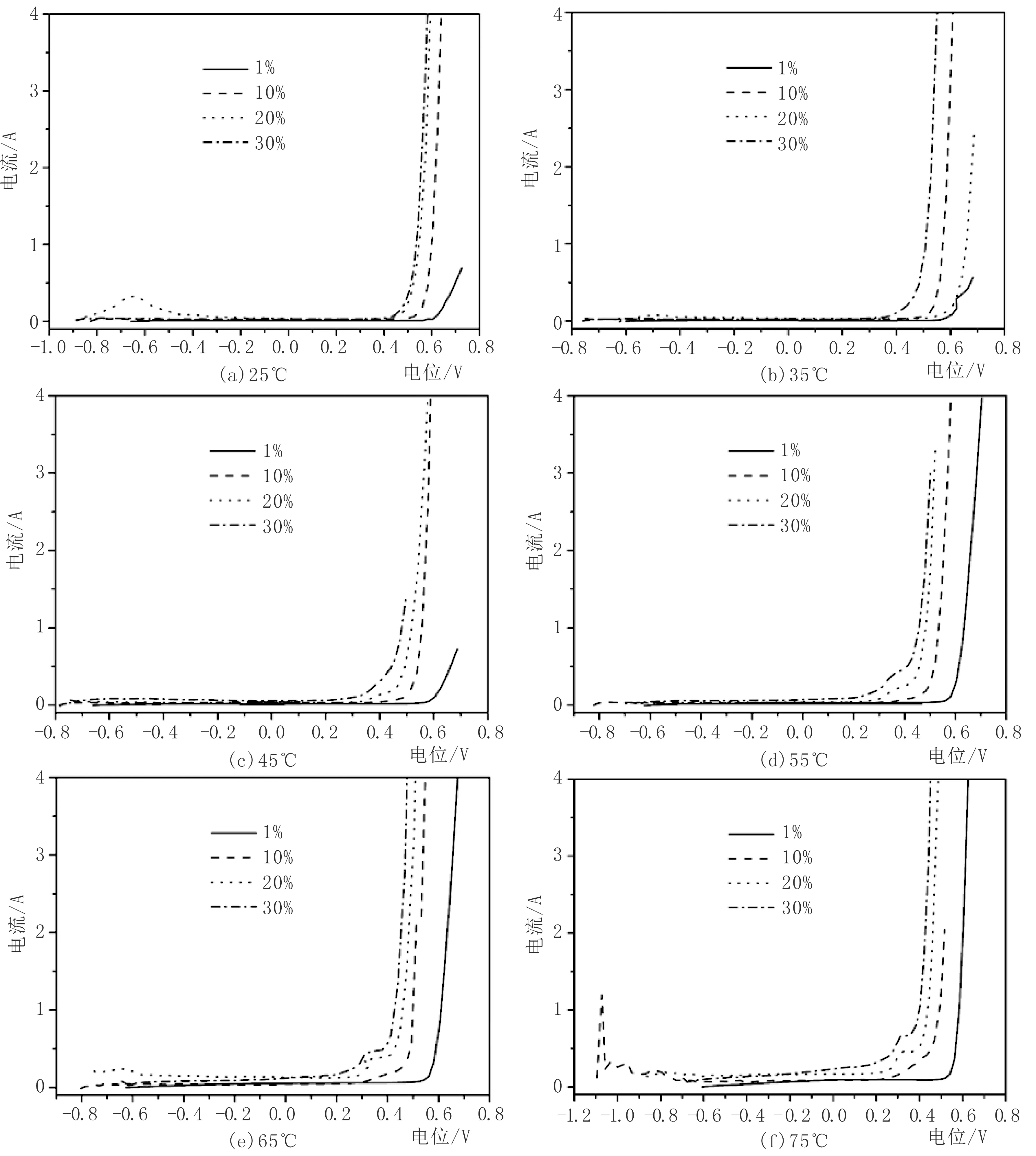
图4 不同温度时碳钢电极随NaOH溶液浓度改变的极化曲线Fig.4 Polarization curves of carbon steel electrode changing with NaOH solution concentration at different temperatures
2.2 镍电极在稀硫酸溶液中的极化曲线
在物理化学实验中,我们做过镍电极在硫酸溶液中极化曲线的测定,还进一步探讨了KCl溶液对镍电极在硫酸溶液中的极化的影响,得出了KCl溶液能够增大其腐蚀和极化程度的结论。本文将在原实验的基础上进一步进行实验。
在第三组实验中,我们采用的硫酸浓度分别为0.1、0.2、0.3、0.4 mol/L,温度分别为25、35、45℃,结果在图5中。通过图5,可以得出如下结论:镍电极在稀硫酸溶液中既钝化又腐蚀,且硫酸浓度一定时,腐蚀和钝化的程度随温度增高而增大;温度一定时,腐蚀和钝化的程度随温度增高而增大。在第四组实验中我们将每次实验的温度固定,研究硫酸溶液的浓度增加对镍电极极化和腐蚀行为的影响(图6)。通过图6,得出镍电极在稀硫酸溶液中腐蚀和极化随温度和硫酸溶液的浓度的增加而增大。
在第五组实验中,我们将温度恒定为25℃,电解质溶液是3 mL浓度分别为0.02、0.04、0.06、0.08、0.1 mol/L的KCl溶液与50 mL 0.1 mol/L的H2SO4溶液的混合溶液,研究了KCl溶液的加入量对镍电极在硫酸溶液中化学行为的影响,结果如图7所示。由图7可以看出,加入KCl溶液可以增强镍电极在稀硫酸溶液中的钝化和腐蚀程度,其钝化和腐蚀程度随KCl溶液浓度的增大而增大。
在第六组实验中,电解质溶液组成固定为50 mL的0.1 mol/L硫酸溶液中与3 mL 0.1 mol/L KCl溶液的混合溶液,改变温度,结果如图8所示。通过图8可以得出以下结论:加入KCl溶液可以加强镍电极在稀硫酸中的钝化和腐蚀程度,加入KCl溶液浓度一定时,腐蚀和钝化程度随温度增大而增大。

图5 镍电极在不同浓度的H2SO4溶液中随温度变化的极化曲线Fig.5 Polarization curves of nickel electrode with temperature in different concentration of H2SO4 solution

图6 不同温度时镍电极随H2SO4溶液浓度变化的极化曲线Fig.6 Polarization curves of nickel electrode with concentration of H2SO4 solution at different temperatures

图7 25℃镍电极在3 mL不同浓度的KCl溶液与50 mL 0.1 mol/L H2SO4溶液的混合溶液中的极化曲线Fig.7 At 25℃,polarization curves of nickel electrode in mixed solutions of 3 mL KCl solution of different concentration and 50 mL 0.1 mol/L H2SO4 solution

图8 镍电极在50 mL 0.1 mol/L的H2SO4溶液与3 mL 0.1 mol/L的KCl溶液的混合溶液随温度变化的极化曲线Fig.8 Polarization curves of nickel electrode in mixed solutions of 50 mL 0.1 mol/L H2SO4 and 3 mL 0.1 mol/L KCl with temperature
由以上实验可以得出,镍电极在稀硫酸溶液中可以腐蚀和钝化,镍电极能否在碱性溶液中腐蚀和钝化呢?带着这一疑问,我们对镍电极在氨水和碳酸氢铵(1∶1)混合溶液及其在NaOH溶液中的化学行为进行了实验探究。实验结果表明,镍电极在氨水和碳酸氢铵(1∶1)混合溶液中电位稍微偏离内给定电压时,电流已经非常大,超出量程,无法实验;而镍电极在NaOH溶液中不钝化。
3 结论
本文采用恒电位法,分别对碳钢电极和镍电极在酸性电解质溶液和碱性电解质溶液中的化学行为进行了实验探究。结论如下:碳钢电极在NaOH溶液中只腐蚀不钝化,在氨水和碳酸氢铵混合溶液中既腐蚀又钝化,在硫酸溶液中不腐蚀也不钝化;镍电极在NaOH溶液中只腐蚀不钝化,在氨水和碳酸氢铵混合溶液中不腐蚀也不钝化,在硫酸溶液中既腐蚀又钝化。影响电极腐蚀和钝化的因素有温度与电解质溶液浓度。温度越高,电极腐蚀和钝化行为越强;电解质溶液浓度越大,电极腐蚀和钝化行为越强。
