Notch1通过非经典的Notch信号通路调节胰腺星形细胞的活化*
2020-03-03宋海岩周志新张玉祥
宋海岩, 周志新, 张玉祥
(1新乡医学院基础医学院, 2新乡医学院, 河南 新乡 453003; 3首都医科大学生物化学与分子生物学系, 北京 100069)
胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)是一种侵袭性强,恶性程度高,死亡率高,预后较差的恶性肿瘤,一半以上的晚期患者5年生存率不足2%[1]。研究显示PDAC最主要的特征是严重的肿瘤间质增生性反应(间质纤维化),而在这种结缔组织增生反应中,肿瘤相关的成纤维细胞(cancer-associated fibroblasts,CAFs),也称为活化的胰腺星形细胞(pancreatic stellate cells,PSCs)起着主导作用[2-3]。通过抑制PSCs的活化,使其恢复至静息状态,进而抑制其在PDAC中的作用,可能是PDAC治疗中一条新的有效途径。经典的Notch信号通路中Notch1受体的NICD段与其下游转录因子CSL结合形成的转录激活复合体参与肺纤维化中肌成纤维细胞的分化,调节细胞中α平滑肌肌动蛋白(alpha smooth muscle actin,α-SMA)的表达[4],我们前期的研究结果显示Notch3依赖经典的Notch信号通路参与调节PSCs的活化[5],Notch1是否也参与PSCs的活化还未见报道。本研究利用人PDAC组织检测Notch1的表达情况,利用原代培养的小鼠胰腺星形细胞检测Notch1 siRNA对其活化程度及迁移能力的影响,从而探讨Notch1在PSCs活化中的作用机制。
材 料 和 方 法
1 实验动物
SPF级野生型C57BL/6J小鼠购自于北京维通利华实验动物技术有限公司,体重20~25 g,雌雄不限,光照时间为昼夜更替12 h∶12 h[许可证号为SCXK(京)2016-0011和SYXY(豫)2014-0005],在室温条件下自由饮食,直至实施实验。
2 试剂
抗Notch1抗体和抗HES1抗体购自Santa Cruz;抗α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)抗体购自Abcam;抗纤连蛋白(fibronectin)抗体和抗Ⅰ型胶原(collagen type Ⅰ, ColⅠ)抗体购自Proteintech;抗GAPDH抗体购自Sigma;Alexa Fluor 594-conjugated donkey anti-rabbit IgG、Alexa Fluor 488-conjugated donkey anti-mouse IgG和LipofectamineTM2000转染试剂购自Invitrogen;DAPI购自Sigma;辣根酶标记山羊抗兔IgG(H+L)购自北京中杉金桥生物技术有限公司;Western blot荧光 II 抗donkey anti-rabbit IgG购自LI-COR;胎牛血清(fetal bovine serum, FBS)和DMEM/F12培养基购自Gibco;人胰腺癌组织购买于西安艾莉娜生物科技有限公司。
3 方法
3.1石蜡切片免疫组织化学染色 常规脱蜡、水化后,3%过氧化氢(H2O2)室温下封闭30 min以灭活内源性的过氧化物酶活性,微波炉热抗原修复,5%驴血清室温封闭1 h,抗Notch1抗体(1∶100)孵育(阴性对照组加PBS),4 ℃过夜,按照中杉金桥二步法免疫组化检测试剂盒操作孵育,DAB显色,苏木素复染细胞核,脱水、透明,中性树胶封片后室温晾干,显微镜下观察,采集图像。
3.2石蜡切片免疫荧光染色 常规脱蜡、水化后(如前),抗Notch1抗体(1∶100)和抗α-SMA抗体(1∶100)孵育(阴性对照组加PBS),4 ℃过夜,抗兔荧光Ⅱ抗Alexa Fluor 594或抗小鼠荧光Ⅱ抗Alexa Fluor 488 1∶1 000稀释,室温避光孵育1.5 h,DAPI(1∶2 000稀释)室温避光孵育5 min,PBS洗3次,每次10 min。滴加抗荧光淬灭封片剂1滴,盖玻片封片后,显微镜下观察,采集图像。
3.3小鼠PSCs原代培养 取出小鼠胰腺,移至超净台内操作,用预冷的PBS洗2遍以洗去组织上所带血液,剪去多余的脂肪组织后,将胰腺放在DMEM/F12培养液中。剪碎小鼠胰腺,多次剪切使其碎至直径0.5~1 mm大小,用无菌吸管将其吸至培养皿中,加入少量的培养液充分铺开胰腺组织块,37 ℃、5% CO2培养箱中培养1 h(利于组织贴壁)后加入足量的培养液继续培养,以后每隔1 d换液。利用油红O染色,对未活化与活化的PSCs进行鉴定。
3.4Notch1 siRNA及阴性对照(negative control, NC) siRNA转染至PSCs 取生长状态良好的活化PSCs,培养板中的细胞融合度达70%~80%。混合siRNA与LipofectamineTM2000,并将siRNA-LipofectamineTM2000复合物加入6孔板中,轻轻摇晃培养板,使液体均匀覆盖细胞(Notch1 siRNA的终浓度为50 nmol/L,阴性对照siRNA终浓度为50 nmol/L),空白对照组只加1 mL无血清DMEM/F12培养液,37 ℃、5% CO2细胞培养箱中培养5 h后,各组均更换含20% FBS的DMEM/F12培养液继续培养,转染24 h和48 h后进行下一步的检测。
3.5Western blot实验 收集培养5 d未活化的PSCs与培养14 d活化的PSCs;收集转染Notch1 siRNA(48 h),NC siRNA(48 h)及空白对照组的PSCs,利用RIPA裂解液提取总蛋白,12 000×g、4 ℃离心30 min,取上清,利用BCA蛋白检测试剂盒测定蛋白浓度,SDS-PAGE分离蛋白并转移至硝酸纤维素膜上,10%脱脂奶粉室温封闭1 h,Ⅰ抗[抗Notch1抗体(1∶500),抗α-SMA抗体(1∶1 000),抗fibronectin抗体(1∶500),抗ColⅠ抗体(1∶500),抗HES1抗体(1∶500),抗GAPDH抗体(1∶10 000)]4 ℃孵育过夜,荧光II抗(1∶1 000)室温避光孵育2 h后,Odyssey曝光,ImageJ软件分析灰度值。
3.6RT-qPCR实验 收集培养5 d未活化的PSCs与培养14 d活化的PSCs,利用TRIzol试剂提取总RNA,利用NanoDrop® 2000检测RNA浓度及纯度,按照逆转录试剂盒提供的说明书进行操作,将RNA逆转录成cDNA,所用引物均由生工生物工程(上海)股份有限公司合成(表1)。PCR条件为:94 ℃ 30 s; 94 ℃ 5 s,55 ℃ 15 s,72 ℃ 10 s,40个循环。

表1 RT-qPCR引物序列
3.7划痕实验 取生长状态良好的活化PSCs,弃去培养液,PBS洗2遍。用0.25% 的胰酶室温消化3 min。加入2 mL含有20% FBS的DMEM/F12培养液终止消化。900 r/min 离心3 min后重悬细胞。按照约2×105个细胞的密度种于6孔板中。培养24 h后用1 mL的无菌蓝色吸头在孔的中间划痕,尽量保证每一个孔中划痕的宽度一致。弃去培养液,每孔加入1 mL无血清培养液以洗去悬浮的细胞。按照前面3.4所述的方法将Notch1 siRNA及NC siRNA转染细胞。分别在转染后24 h与48 h于镜下观察细胞愈合面积并采集图像,利用ImageJ软件测量愈合面积。
3.8CCK-8检测PSCs的细胞活力 将生长状态良好的活化PSCs接种于24孔板中,按照方法3.4步骤转染细胞。分别取转染Notch1 siRNA及 NC siRNA 24 h,48 h和72 h的PSCs。弃去孔中的培养液,每孔新加入200 μL培养液。每孔加入20 μL CCK-8溶液,37 ℃、5% CO2培养箱中孵育2 h。设置酶标仪,在450 nm处测吸光度(A)值。
4 统计学处理
采用GraphPad Prism 5软件对实验数据进行统计分析。每次实验结果均重复3次以上,实验计量数据以均数±标准差(mean±SD)表示。两组间比较的实验设计采用t检验,多组间比较在方差齐性检验的基础上行方差分析,并用Bonferroni校正的t检验进行各组均数间的两两比较。以P<0.05为差异具有统计学意义。
结 果
1 Notch1在PDAC组织中表达的检测
对24例PDAC患者来源的肿瘤组织进行免疫组织化学染色,结果显示Notch1高度表达于PDAC中,阳性率达91.7%,Notch1不仅表达于肿瘤细胞中,同时也表达于间质细胞中,见图1A。为了检测Notch1受体在胰腺癌间质中的表达部位,利用免疫荧光双标的方法进一步检测了Notch1与PSCs活化标志物α-SMA的共表达情况,结果显示,Notch1表达于α-SMA阳性的PSCs中,见图1B。
2 小鼠原代PSCs的培养与鉴定
培养5 d之内的PSCs细胞形态呈现多种形态,三角形或星形,镜下观察细胞折光性较强,在胞质中可见脂肪滴,见图2A。油红O染色结果显示,培养3 d的PSCs细胞胞浆中可见橙红色颗粒;随着培养时间的推移,PSCs的形态发生较大改变,细胞形态呈典型的星状外形,伪足扩展明显,胞浆中的脂滴逐渐消失,随后细胞胞体变细长,并开始呈现成肌成纤维细胞样形态,细胞胞浆中未见橙红色颗粒,见图2B。Western blot结果显示,在蛋白水平,培养5 d的PSCs中α-SMA、fibronectin及ColⅠ蛋白的表达较低;而培养14 d的PSCs中α-SMA、fibronectin及ColⅠ的表达显著升高(P<0.01),见图2C。同时,RT-qPCR结果显示,在mRNA水平,培养5 d的PSCs中α-SMA、fibronectin及ColⅠ的mRNA表达较低;而培养14 d的PSCs中α-SMA、fibronectin及ColⅠ的mRNA表达显著升高(P<0.01),见图2D。这些结果表明PSCs的原代培养成功,可进行下一步实验。
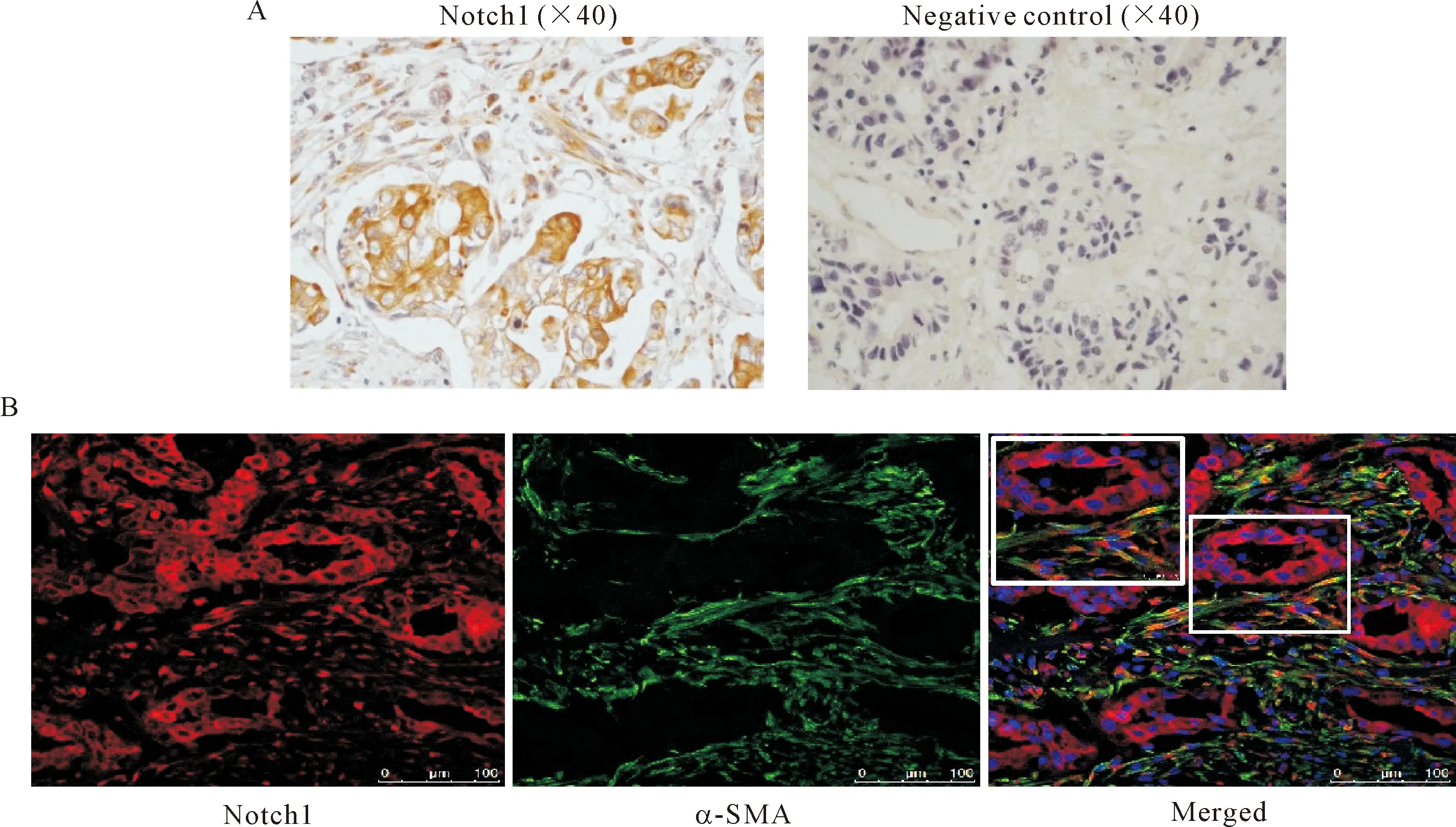
Figure 1. The expression of Notch1 in the PDAC tissues. A: immunohistochemical staining was used to detected the Notch1 expression in PDAC tissues; B: immunofluoresence double staining was used to detected the Notch1 expression in PDAC tissues.
图1 Notch1在PDAC间质的表达
3 Notch1及HES1在小鼠原代PSCs中的表达
Western blot结果显示,Notch1蛋白在未活化PSCs中表达较低,在活化的PSCs中的表达显著升高(P<0.01),Notch信号通路的下游靶蛋白HES1在未活化PSCs中较低,而在活化的PSCs中显著升高(P<0.01),见图3A;RT-qPCR结果显示,与未活化PSCs相比,Notch1和HES1的mRNA在活化的PSCs中表达均显著升高(P<0.01),见图3B。
4 抑制Notch1表达对小鼠原代PSCs活化的影响
与阴性对照组相比较,转染Notch1 siRNA组中,活化的PSCs标志物α-SMA和ColⅠ蛋白的表达均显著降低(P<0.05),但是fibronectin及Notch信号通路的下游靶蛋白HES1的表达并无显著变化,见图4。这些结果提示,Notch1 siRNA干扰48 h在一定程度上可降低PSCs的活化程度,促使PSCs恢复未活化的状态,并且Notch1参与PSCs的活化并不依赖经典的Notch信号通路。
5 抑制Notch1对小鼠原代PSCs细胞活力与迁移的影响
划痕实验结果显示,转染后24 h与48 h,空白对照组与阴性对照组,细胞的愈合面积分别达到60.21% 和78.48%及46.12% 和73.22%,而在Notch1 siRNA转染24 h和48 h组,细胞的愈合面积分别只有14.43% 和6.04%,与阴性对照组相比较,Notch1 siRNA组细胞愈合面积显著降低(P<0.01),见图5。这说明Notch1 siRNA可抑制PSCs的划痕愈合,抑制PSCs迁移。
CCK-8实验结果显示,在转染后24 h,Notch1 siRNA组450 nm处A值与阴性对照组相比较无显著变化(P>0.05);在转染后48 h,Notch1 siRNA组450 nm处A值与阴性对照组相比较显著降低(P<0.05);在转染后72 h,Notch1 siRNA组450 nm处A值与阴性对照组相比较显著降低(P<0.01),见图6。这说明Notch1 siRNA转染可使PSCs细胞活力受到抑制,且具有时间依赖性。
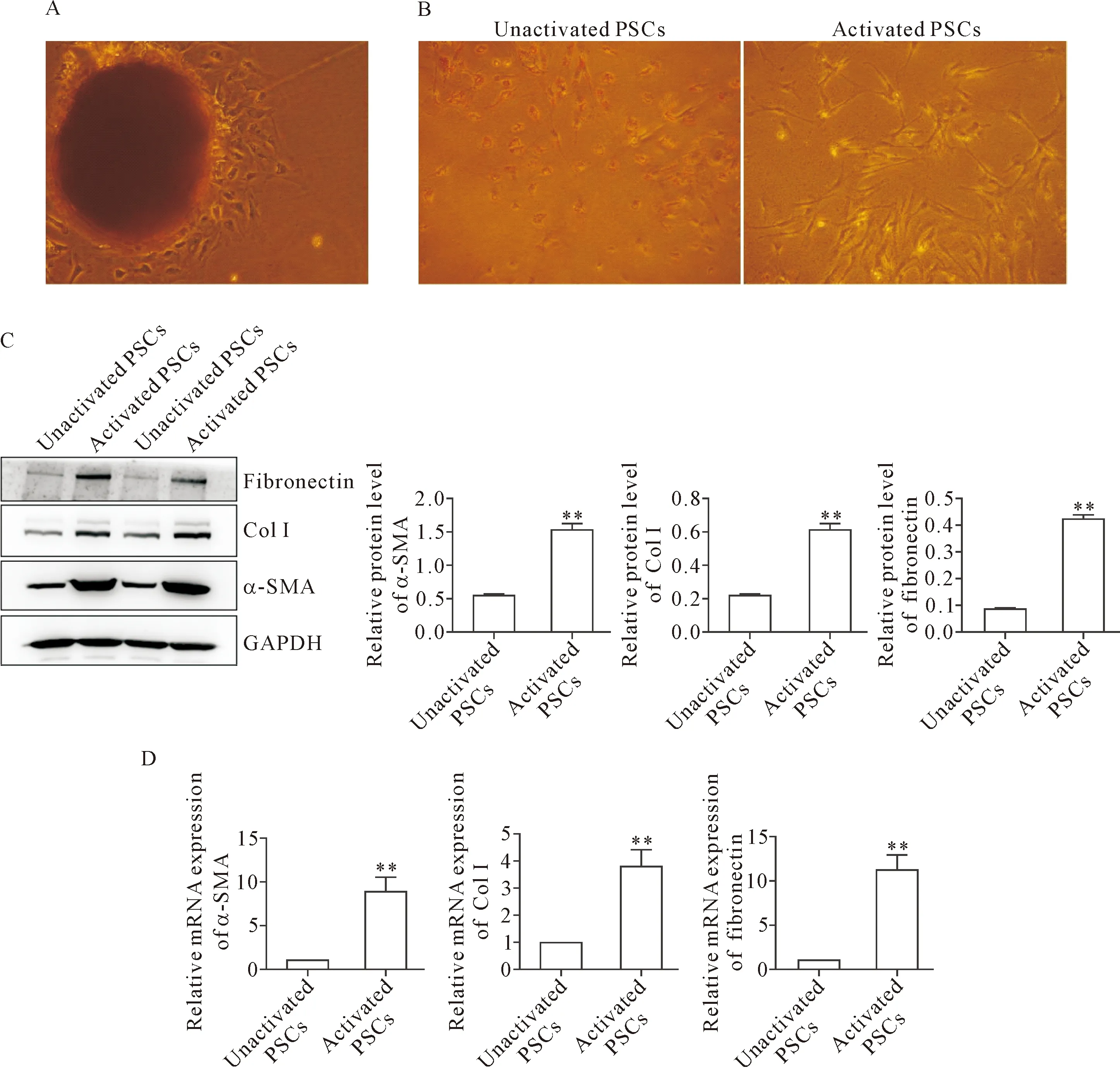
Figure 2. Culture and identification of primary PSCs in mice. A: the morphological changes of PSCs cultured for 24 h (×40); B: oil red O staining was used to idenify the PSCs (×40); C, D: Western blot and RT-qPCR were used to detect the expression of α-SMA, ColⅠ and fibronectin. Mean±SD.n=5.**P<0.01vsunactivated PSCs.
图2 小鼠原代PSCs的培养与鉴定
讨 论
目前,联合应用细胞毒性药物来杀死肿瘤细胞已取得较好的治疗效果,然而PDAC患者的生存时间及生存质量并没有得到较大的改善[6]。PDAC最显著的特征为肿瘤间质的结缔组织增生反应,在肿瘤细胞周围包绕着丰富的间质,而活化的PSCs是引起胰腺炎与胰腺癌间质结缔组织增生的主要细胞[7-11]。PSCs在正常的胰腺组织中处于静息状态,分泌少量的ECM。在胰腺损伤,炎症或肿瘤时,静息状态的PSCs可被细胞因子,生长因子或氧化应激产物所激活,比如血小板源性生长因子(platelet-derived growth factor,PDGF)和转化生长因子β1(transforming growth factor-β1, TGF-β1)等,转变为具有成肌纤维细胞样特征的细胞[7],细胞获得增殖能力,可分泌大量的细胞因子和细胞外基质,重构胰腺间质[3],活化的PSCs表达α-SMA及ColⅠ等。
Notch基因是1917年Morgan及其同事在果蝇中发现的一个高度保守的基因家族,编码4个跨膜受体,即Notch1、Notch2、Notch3和Notch4。Notch受体能够被Notch配体家族所激活,通过相邻细胞的Notch配体与受体相互作用可激活Notch信号,在多种酶的作用下Notch蛋白的NICD段被剪切释放入细胞质,并进入细胞核与转录因子CSL结合,形成NICD/CSL转录激活复合体,从而激活HES和HEY等转录抑制因子家族的靶基因,发挥生物学作用[12]。

Figure 3. The protein (A) and mRNA (B) expression of Notch1 and HES1 in unactivated and activated PSCs was detected by Western blot and RT-qPCR. Mean±SD.n=5.**P<0.01vsunactivated PSCs.
图3 Notch1受体及HES1蛋白在未活化与活化PSCs中的表达

Figure 4. Western blot was used to determine the effects of Notch1 siRNA on expression of PSC activation markers such as α-SMA, fibronectin and ColⅠ, as well as Notch target protein HES1. Mean±SD.n=5.*P<0.05,**P<0.01vsNC siRNA group.
图4 Western blot检测Notch1 siRNA转染PSCs后各相关蛋白的表达变化
Figure 5. The effect of Notch1 siRNA on the migration ability of PSCs at 24 h and 48 h using scratch test (×20). Mean±SD.n=5.**P<0.01vsNC siRNA group.
图5 利用划痕实验检测在转染Notch1 siRNA 24 h与48 h后PSCs迁移情况
Figure 6. The effect of Notch1 siRNA on the viability of PSCs was measured by CCK-8 assay at 24 h, 48 h and 72 h. Mean±SD.n=5.*P<0.05,**P<0.01vsNC siRNA group.
图6 利用CCK-8实验检测在转染Notch1 siRNA 24 h、48 h和72 h后PSCs细胞的活力
研究显示,经典的Notch信号通路中Notch1受体的NICD段与CSL结合形成的转录激活复合体参与肺纤维化中肌成纤维细胞的分化,调节细胞中α-SMA的表达[4]。动物实验显示,Notch1/Jagged1-HES1信号通路参与心肌成纤维细胞向肌成纤维细胞的转化[13]。在肝纤维化中,Notch-HES1参与肝星形细胞的活化[14]。我们前期的研究结果也显示,Notch信号通路的受体Notch3高表达于PDAC组织中,且Notch3通过经典的Notch/HES1通路调节PSCs的活化[5],而Notch1受体是否参与PSCs的活化还未见报道。
本研究中,免疫组化结果显示,Notch1在PDAC中表达的阳性率达91.7%,Notch1不仅表达于肿瘤细胞中,同时也表达于间质细胞;免疫荧光双标结果显示,Notch1表达于α-SMA阳性的PSCs中,这就提示Notch信号通路可能参与PSCs的活化。
进一步我们对小鼠胰腺星形细胞进行分离培养,并利用油红O染色,Western blot及RT-qPCR技术对未活化与活化的PSCs进行鉴定,结果显示,我们成功培养了小鼠原代PSCs,为下一步的实验做好了准备。
我们利用Western blot与RT-qPCR对Notch1及其下游靶基因HES1在未活化与活化的小鼠PSCs中的表达情况进行了检测,结果显示,Notch1及Notch信号通路的下游靶基因HES1在未活化PSCs中较低,而在活化的PSCs中显著升高;我们进一步利用Notch1 siRNA转染PSCs 48 h后,Western blot结果显示,活化PSCs的标志物α-SMA和ColⅠ蛋白的表达均显著降低,但是,fibronectin及Notch信号通路的下游靶蛋白HES1的表达并无显著变化。这些结果提示,Notch1 siRNA干扰48 h在一定程度上可降低PSCs的活化程度,促使PSCs恢复未活化的状态,并且Notch1参与PSCs的活化而不依赖经典的Notch信号通路。我们利用划痕实验及CCK-8实验检测了转染Notch1后 PSCs的变化,结果显示Notch1 siRNA可抑制PSCs的划痕愈合能力,抑制PSCs的迁移能力及活力。
综上所述,Notch1参与调节PSCs的活化,抑制Notch1的表达可抑制活化PSCs标志物α-SMA和ColⅠ的表达,降低PSCs的活化程度、迁移能力和细胞活力,并且Notch1调节PSCs的活化不依赖经典的Notch信号通路。
