CHOP在索拉菲尼联合辛二酰苯胺异羟肟酸诱导人肝癌细胞MHCC97L凋亡中的作用*
2020-03-03陈雨丝赵金有谢汝佳
蔡 爽, 韩 冰, 郑 璐, 汤 雷, 陈雨丝, 杨 毅, 赵金有, 杨 婷, 杨 勤, 谢汝佳
(贵州医科大学贵州省常见慢性疾病发病机制及药物研究重点实验室,基础医学院病理生理学教研室,贵州 贵阳 550025)
肝细胞癌(hepatocellular carcinoma,HCC)是肝脏中最常见的原发性恶性肿瘤,被认为是世界上第5大常见肿瘤,也是肿瘤死亡的第3大原因。现今,HCC治疗正朝着特定靶点的靶向治疗方向发展[1]。索拉菲尼(sorafenib, SOR)是一种多靶点口服抗肿瘤药物,于2007年被FDA批准用于治疗晚期HCC。辛二酰苯胺异羟肟酸(suberoylanilide hydroxamic acid,SAHA)是一种广谱组蛋白脱乙酰酶(histone deacetylases, HDACs)抑制剂,它以微摩尔浓度即可抑制HDAC1、HDAC2、HDAC3和HDAC6的活性并显著提高核心组蛋白的乙酰化水平,从而诱导肿瘤细胞生长停滞、分化或凋亡[2],目前主要用于临床血液系统恶性肿瘤的治疗。内质网应激(endoplasmic reticulum stress, ERS)是近年来新发现的一条凋亡信号通路,区别于死亡受体和线粒体途径介导的凋亡途径,它通过自身信号传导通路来诱导细胞发生凋亡。已有大量文献报道,索拉菲尼与SAHA联合应用时可显著促进肝癌细胞的凋亡[3-5],但其具体的分子机制是否与内质网应激有关尚未见报道。CCAAT/增强子结合蛋白同源蛋白(CCAAT/enhancer-binding protein homologous protein, CHOP)是一种多功能转录因子,在ERS诱导的多条凋亡信号通路中都充当了下游凋亡信号分子的角色,因此,CHOP被认为是ERS过程中一个重要的促凋亡蛋白。本研究主要探讨CHOP在索拉菲尼联合SAHA诱导人肝癌细胞MHCC97L凋亡中的作用,从而为索拉菲尼联合SAHA治疗肝癌提供新的理论依据。
材 料 和 方 法
1 细胞
MHCC97L细胞来自中国科学院典型培养物保藏中心上海细胞库。细胞送上海翼和应用生物技术有限公司用Axygen的基因组抽提试剂盒提取DNA,采用21-STR扩增方案扩增,在ABI 3730XL型遗传分析仪上对STR位点和性别基因AMELX进行检测。本次检测在该细胞系中未发现多等位基因、未与数据库收录的其它细胞相关STR信息发生匹配,未发现交叉污染,细胞系无异常。
2 实验试剂
索拉菲尼由贵州医科大学附属医院肛肠外科詹玮博士惠赠;SAHA(Abcam);胎牛血清(ScienCell);DMEM培养基(Gibco);胰酶(Biological Industry);彩虹 Marker(北京索莱宝科技有限公司);DMSO(Sigma);CCK-8(BBI Life Sciences);细胞裂解液、蛋白酶抑制剂、BCA蛋白定量试剂盒、Annexin V-FITC/PI细胞凋亡检测试剂盒和细胞周期试剂盒(江苏凯基生物技术有限公司);兔抗GAPDH、兔抗葡萄糖调节蛋白78(glucose-regulated protein 78,GRP78)、兔抗蛋白激酶R样内质网激酶(protein kinase R-like endoplasmic reticulum kinase,PERK)、兔抗活化转录因子4(activating transcription factor 4,ATF4)和兔抗CHOP(Abcam);CHOP siRNA(上海吉玛公司);Lipofectamine 2000(Thermo)。
3 主要方法
3.1细胞鉴定及培养 首先通过短串联重复DNA分析对MHCC97L细胞进行鉴定后进行后续实验。MHCC97L细胞用含10%胎牛血清和1%双抗(青霉素和链霉素)的DMEM培养基进行培养,培养皿置于37 ℃、5% CO2及饱和湿度的培养箱中培养,2~3 d换一次液;当细胞密度为80%~90%时,用含EDTA的胰酶消化细胞,以1 ∶2传代,取对数生长期细胞用于实验。
3.2CCK-8法检测细胞活力 取对数生长期的MHCC97L细胞,以每孔1×104个细胞的密度接种于96孔板,置于37 ℃、5% CO2的培养箱中培养。待细胞贴壁后,加入不同浓度的索拉菲尼(0.5、1、3、6、12、25和50 μmol/L)、SAHA(0.5、1、3、6、12、25和50 μmol/L)及索拉菲尼联合SAHA (剂量同前)处理细胞,同时设置阴性对照组和空白对照组,每个浓度均设5个复孔,继续培养48 h后,每孔加入CCK-8工作液 10 μL,37 ℃ 孵育2 h后在酶联免疫检测仪450 nm处测定各孔的吸光度(A)值,计算各组细胞活力并绘制生长曲线。细胞活力(%)=(实验组A值-空白组A值)/(对照组A值-空白组A值)×100%。
3.3流式细胞术检测细胞周期 取对数生长期的MHCC97L细胞,随机分为对照(control)组、索拉菲尼(12 μmol/L)组、SAHA(6 μmol/L)组以及索拉菲尼联合SAHA组。给药48 h后收集细胞,经过75%乙醇4 ℃固定过夜,PBS洗涤后加入500 μL的PI/RNase A(9 ∶1)染色工作液,室温避光30~60 min后用流式细胞仪进行检测。
3.4流式细胞术检测细胞凋亡 细胞分组同3.3,给药48 h后,使用不含EDTA的胰酶消化各组细胞,用PBS洗涤细胞2次,2 000 r/min离心5 min后,加入500 μL的binding buffer悬浮细胞,每组细胞中加入5 μL Annexin V-FITC混匀后,再加入5 μL PI混匀,室温避光反应15 min后用流式细胞仪进行检测。
3.5Western blot法检测GRP78、PERK、p-PERK、ATF4和CHOP蛋白水平的变化 收集对照组和药物处理48 h后的实验组细胞,PBS洗涤3次,加入适量蛋白裂解液提取细胞总蛋白,使用 BCA 蛋白定量试剂盒进行蛋白定量。取40 μg总蛋白上样,10 % SDS-PAGE分离蛋白,电泳结束后湿转蛋白至PVDF膜上,用5 %脱脂奶粉封闭90 min,用TBST洗膜3次后,加入相应Ⅰ抗4 ℃孵育过夜。第2天用TBST洗膜3次后加入Ⅱ抗,室温孵育90 min,TBST洗膜3次,ECL发光成像,Bio-Rad 凝胶成像系统获取图像。用Image Lab图像分析软件对每个条带进行定量分析。
3.6采用 CHOP siRNA沉默CHOP后,检测索拉菲尼联合SAHA对MHCC97L细胞凋亡的影响 取对数生长期的MHCC97L细胞,以每孔1×105个细胞密度接种于6孔板中。随机将细胞分为3组:SAHA+SOR组、control siRNA+SAHA+SOR组和CHOP siRNA+SAHA+SOR组。当细胞密度达到30 %~50 %时,根据 Lipofectamine 2000 说明书开始转染。转染48 h后,弃去含转染试剂的培养基,改用含索拉菲尼(12 μmol/L)联合SAHA(6 μmol/L)的培养基继续培养细胞48 h。经AnnexinV-FITC/PI双染色后,采用流式细胞仪检测各组细胞凋亡率。所用CHOP siRNA序列见表1。

表1 人CHOP siRNA序列
4 统计学处理
以上实验重复至少3次。实验数据采用均数±标准差(mean±SD)表示,使用GraphPad Prism 5统计软件进行单因素方差分析(one-way ANOVA),以P<0.05表示差异有统计学意义。
结 果
1 索拉菲尼联合SAHA对MHCC97L细胞活力的影响
CCK-8法结果显示,与对照组比较,不同浓度的索拉菲尼和SAHA均能明显抑制肝癌细胞MHCC97L的活力,且呈明显的剂量依赖性。与单独的索拉菲尼和SAHA组比较,索拉菲尼联合SAHA对肝癌细胞活力的抑制作用更为显著 (P<0.05),见图1。根据CCK-8实验结果,后续实验中选择12 μmol/L索拉菲尼、6 μmol/L SAHA以及12 μmol/L索拉菲尼联合6 μmol/L SAHA处理细胞。

Figure 1. The changes of the viability of MHCC97L cells treated with SOR or/and SAHA. Mean±SD.n=3.*P<0.05vs0 μmol/L group;#P<0.05vsSOR group;&P<0.05vsSAHA group.
图1 SOR、SAHA及两药联合对MHCC97L细胞活力的影响
2 索拉菲尼联合SAHA对MHCC97L细胞周期的影响
与对照组比较,12 μmol/L索拉菲尼、6 μmol/L SAHA 以及两药联合组的细胞周期分布均发生了明显的变化,细胞周期均被阻滞在 G1期,S期与G2/M期的细胞减少,其中以联合用药组变化最为显著,见图2、表2。
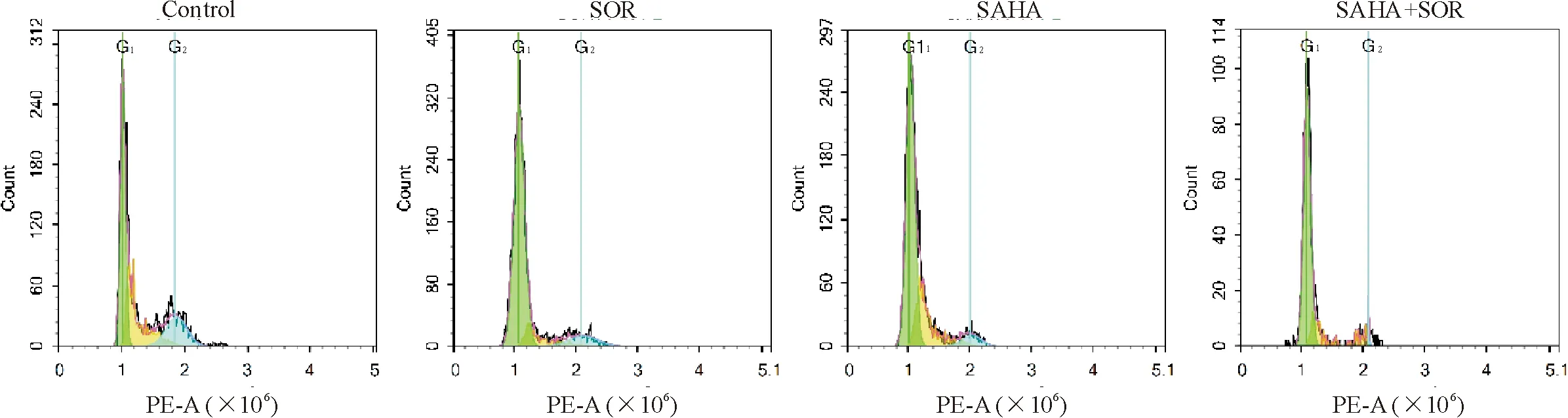
Figure 2. The effects of SOR, SAHA and their combination on the cycle distribution of MHCC97L cells anayzed by flow cytometry.
图2 流式细胞术检测SOR、SAHA及两药联合对MHCC97L细胞周期分布的影响
表2 SOR、SAHA与联合用药对MHCC97L细胞周期分布的影响
Table 2. The effects of SOR, SAHA and their combination on the cell cycle distribution of MHCC97L cells (%. Mean±SD.n=3)

GroupG1SG2/MControl46.32±6.1232.86±5.2320.35±0.77 SOR70.49±2.82*24.89±0.344.91±2.80SAHA70.19±9.09*22.14±12.287.64±3.62SOR+SAHA74.01±2.63*20.53±4.671.25±0.20
*P<0.05vscontrol group.
3 索拉菲尼联合SAHA对MHCC97L细胞凋亡的影响
经流式细胞术检测发现,与对照组比较,12 μmol/L索拉菲尼、6 μmol/L SAHA 以及两药联合均能明显诱导MHCC97L细胞发生凋亡(P<0.05),凋亡率分别为(12.18±1.84)%、(13.18±1.08)%和(37.88±7.68)%,其中以联合用药组凋亡率最高,与索拉菲尼和SAHA单药组比较差异具有统计学意义(P<0.05),见图3。
4 索拉菲尼联合SAHA对MHCC97L细胞中GRP78、PERK、p-PERK、ATF4和CHOP蛋白水平的影响
与对照组比较,12 μmol/L索拉菲尼和6 μmol/L SAHA 可在一定程度上调GRP78、p-PERK、ATF4和CHOP蛋白的水平,两药联合上述效应更加显著(P<0.05),见图4。索拉菲尼、SAHA及两药联合对PERK蛋白的水平无明显影响。
5 CHOP siRNA转染MHCC97L细胞后对CHOP表达的影响
采用CHOP siRNA-1、CHOP siRNA-2及CHOP siRNA-3分别转染MHCC97L细胞后,Western blot检测结果显示, CHOP siRNA-3组的CHOP表达下降最显著(P<0.05),见图5。故后续实验选用CHOP siRNA-3进行转染。
6 CHOP siRNA沉默CHOP基因后,索拉菲尼联合SAHA对MHCC97L细胞凋亡的影响
经流式细胞术检测细胞凋亡发现,SOR+SAHA组、control siRNA+SOR+SAHA组和CHOP siRNA+SOR+SAHA组的凋亡率分别为(35.50±2.52)%、(36.10±6.15)%和(18.93±1.37)%,CHOP siRNA+SOR+SAHA组的凋亡率显著下降(P<0.05),见图6。
讨 论
内质网广泛存在于真核生物细胞中,主要进行蛋白质合成、折叠、聚集和转运,也是细胞内Ca2+的主要储存场所。在一些病理性因素作用下,如缺血、缺氧、毒素刺激和氧化应激等都可导致内质网应激的发生[6]。ERS早期可通过未折叠蛋白反应(unfolded protein response,UPR)缓解应激对细胞造成的损伤,对细胞发挥保护作用。目前认为ERS主要涉及3种内质网跨膜效应蛋白:肌醇需求酶1(inositol-requiring enzyme 1,IRE1)、PERK和活化转录因子6(activating transcription factor 6,ATF6)。在正常情况下,这3种ERS受体蛋白均与内质网伴侣GRP78结合而处于无活性状态。当发生ERS时,由于内质网腔中有大量未折叠蛋白或错误蛋白堆积,GRP78与IRE1、PERK和ATF6解离,转而与未折叠蛋白或错误蛋白结合,并帮助这些蛋白质进行正确折叠[7]。此外,与GRP78解离后的PERK、IRE1和ATF6也可通过各自的途径被激活,从而降低未折叠/错误折叠蛋白在内质网腔的聚集,例如PERK与GRP78解离后可通过自身二聚化和磷酸化被激活,被激活的PERK进一步磷酸化其下游的真核翻译起始因子2α(eukaryotic translation initiation factor 2α,eIF2α)的Ser51位点,从而抑制蛋白质的合成,减轻内质网的负荷。虽然ERS状态下细胞能够启动UPR来促进细胞的存活,但如果当ERS持续或严重得不到缓解时,内质网无法恢复自身稳态,则会通过ERS诱导的凋亡通路而触发细胞凋亡[8]。因此,通过激活ERS凋亡通路促使肿瘤细胞发生凋亡,有望成为肿瘤治疗的新方法、新靶点[6]。本研究发现,索拉菲尼联合SAHA能显著抑制MHCC97L细胞的活力,且细胞生长被阻滞在G1期;流式细胞术检测结果表明两药联合能显著促进肝癌细胞凋亡,说明两药联合在抑制肝癌细胞增殖的同时还促进了肝癌细胞凋亡,成为其抗癌的重要机制,上述结果与Park等[4]的研究结果一致。为进一步深入阐明两药联合促进肝癌细胞凋亡的机制,本研究通过Western blot检测发现索拉菲尼组、SAHA组和联合用药组的GRP78、p-PERK和ATF4的蛋白水平均较对照组显著上调,且索拉菲尼联合SAHA能进一步促进上述蛋白水平的增加,说明索拉菲尼、SAHA均可激活ERS信号通路,且两药联合有一定的协同作用。
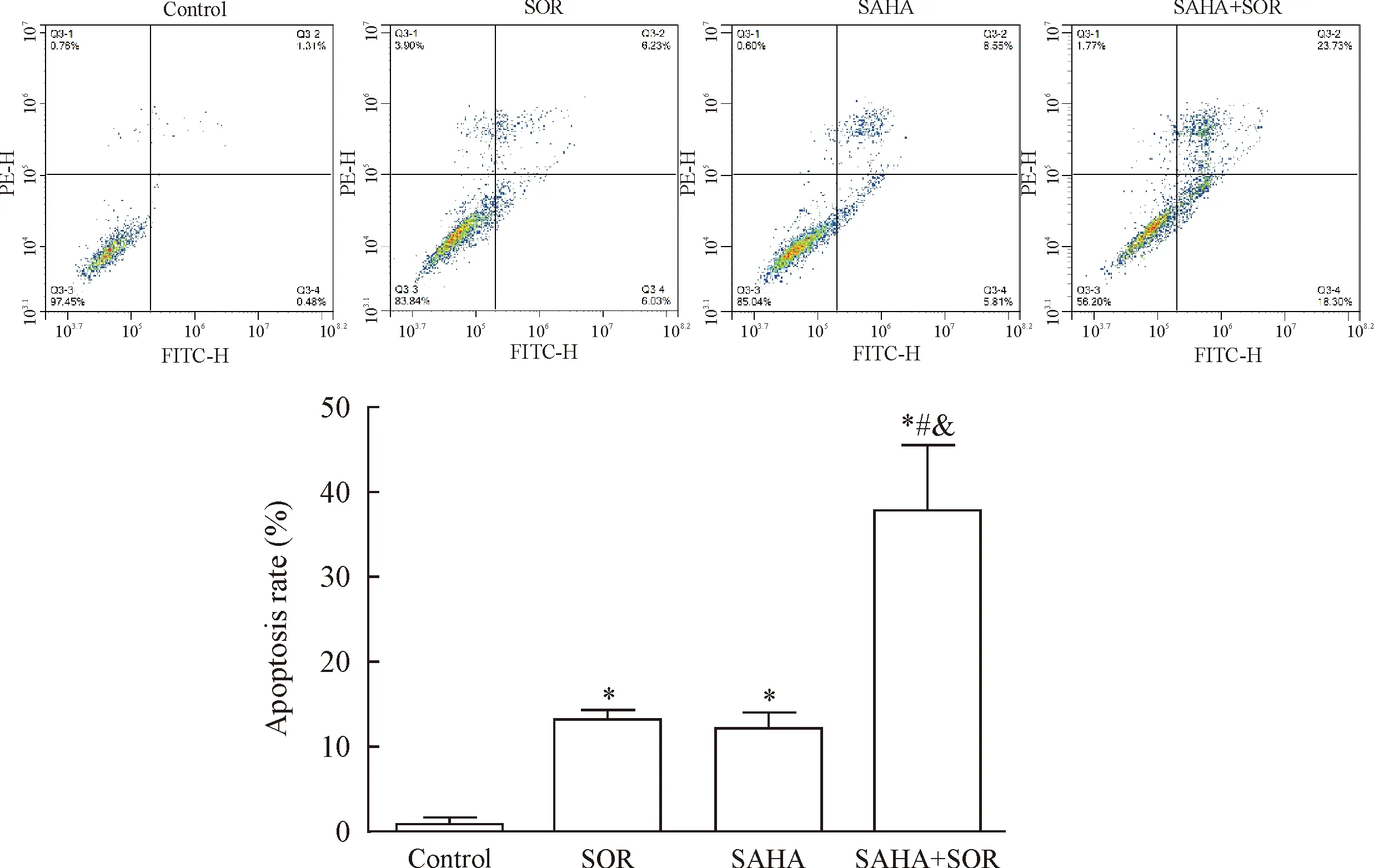
Figure 3. The effect of treatment with SOR or SAHA alone, or their combination for 48 h on the apoptosis of MHCC97L cells. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsSOR group;&P<0.05vsSAHA group.
图3 SOR、SAHA及两药联合对人肝癌MHCC97L细胞凋亡的影响
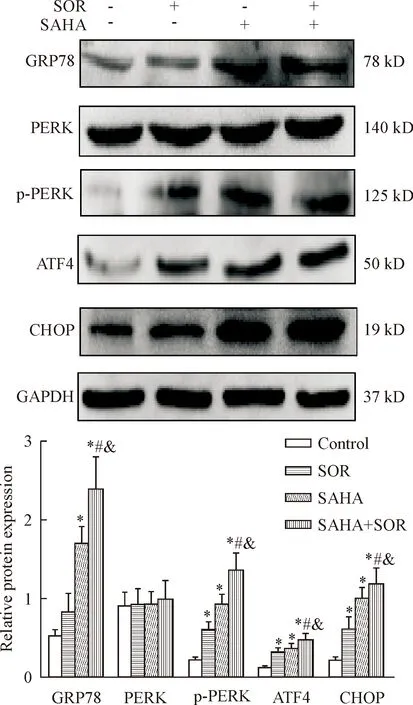
Figure 4. The protein levels of GRP78, PERK, p-PERK, ATF4 and CHOP in the MHCC97L cells exposed to SAHA or SOR alone, or their combination for 48 h. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsSOR group;&P<0.05vsSAHA group.
图4 SOR、SAHA及两药联合处理MHCC97L细胞48 h后GRP78、PERK、p-PERK、ATF4和CHOP的蛋白水平

Figure 5. The change of CHOP expression after transfection of CHOP siRNA detected by Western blot. Mean±SD.n=3.*P<0.05vscontrol group.
图5 Western blot检测转染CHOP siRNA后CHOP表达的变化

Figure 6. The effects of sorafenib combined with SAHA on the apoptosis of MHCC97L cells afterCHOPexpression was knocked-down. Mean±SD.n=3.*P<0.05vsSOR+SAHA group;#P<0.05vscontrol siRNA +SOR+SAHA.
图6 CHOP沉默后,索拉菲尼联合SAHA对MHCC97L细胞凋亡的影响
CHOP属于C/EBP转录因子家族,是内质网应激特异性的转录因子。在正常情况下,细胞质内CHOP的表达较低;当发生ERS时,PERK介导其下游的eIF2α发生磷酸化,p-eIF2α进一步激活下游的ATF4及CHOP的表达[9-11]。本研究显示,经索拉菲尼、SAHA及两药联合处理细胞后,MHCC97L细胞中CHOP的蛋白水平显著升高。有研究发现CHOP在调控ERS引起的细胞凋亡中扮演重要角色,它能下调抗凋亡蛋白Bcl-2的表达[12-13],而且还可以通过促进内质网应激相关蛋白的合成和诱导氧化应激导致细胞凋亡[14],故CHOP被认为是ERS过程中一个由抗凋亡走向促凋亡的关键信号分子。最近Lei等[15]的研究表明,在内质网应激条件下,特异性敲除CHOP基因后,可显著降低ERS诱导的细胞凋亡。为进一步明确CHOP在索拉菲尼联合SAHA诱导肝癌细胞凋亡中的作用,我们采用CHOP siRNA敲减MHCC97L细胞中CHOP的表达,观察CHOP表达下调对索拉菲尼联合SAHA诱导的肝癌细胞凋亡的影响,结果发现,CHOP表达下调能显著抑制索拉菲尼联合SAHA诱导的肝癌细胞凋亡,这说明CHOP参与了索拉菲尼联合SAHA诱导肝癌细胞发生凋亡的过程。
综上所述,索拉菲尼联合SAHA能够通过激活内质网应激凋亡通路促进肝癌细胞MHCC97L发生凋亡,且CHOP在此过程中发挥着关键性作用。
