右美托咪定对抑郁症大鼠行为及海马BDNF和mTOR蛋白表达的影响*
2020-03-03张建英李先伟
张建英, 汤 娟, 张 倩, 李先伟△
(皖南医学院 1医学影像学院, 2药学院药理教研室, 安徽 芜湖 241002)
抑郁症是一类精神障碍性疾病,其发病机制尚不明确[1]。大量研究表明海马神经元的结构可塑性损害,特别是海马神经元树突萎缩、缺失,可能是导致抑郁症关键因素[2]。而抑郁症介导的海马神经元可塑性损伤与脑源性神经营养因子(brain-derived neurotrophic factor, BDNF)的表达变化有关[3]。临床研究发现抑郁症患者死后大脑海马BDNF表达下调[4]。而向抑郁症动物模型的海马内注入BDNF,能够促进原肌球蛋白相关激酶B(tropomyosin-related kinase B, TrkB)磷酸化而产生抗抑郁效应,这些研究表明抑郁症的发生与BDNF/TrkB表达水平有关[5]。近期研究发现哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)表达异常导致的突触传递障碍与抑郁症的发生有关,而氯胺酮通过激活磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase, PI3K)/蛋白激酶B(protein kinase B, Akt)/mTOR信号通路,增加突触传递功能从而产生快速抗抑郁作用[6-7]。Tao等[8]研究发现甘草素通过上调大鼠海马BDNF/TrkB表达水平,进而激活PI3K/Akt/mTOR信号通路产生抗抑郁作用。以上结果提示BDNF/TrkB及其下靶点游PI3K/Akt/mTOR信号通路的表达异常与抑郁症的发生密切相关。
前期研究发现右美托咪定(dexmedetomidine, DEX)具有镇静、抗焦虑、催眠和镇痛等作用[9]。目前还发现DEX通过抗炎、上调BDNF和TrkB的表达而减轻脑缺血再灌注损伤导致的海马神经元损伤[10-11]。另外,Zhang等[12]发现DEX通过激活PI3K/Akt/mTOR信号通路对缺血再灌注损伤的心肌产生保护作用。基于以上的研究背景,本实验采用双侧卵巢摘除加慢性不可预知性温和应激抑郁症大鼠模型,以BDNF及其下游PI3K/Akt/mTOR信号通路为切入点,探讨DEX对抑郁症模型大鼠行为变化及空间学习和记忆能力的影响并探讨其机制。
材 料 和 方 法
1 动物
雌性 Sprague-Dawley (SD)大鼠,体质量 400~500 g。购于南京青龙山动物试验中心,许可证号为SCXK(苏)2016-0001。
2 药物及主要试剂
DEX注射液(国药准字H20090248,江苏恒瑞医药股份有限公司);Nissl染色试剂盒(上海碧云天);抗白细胞介素1β(interleukin-1β, IL-1β)、IL-6、肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)及甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)抗体(Santa Cruz);抗蛋白激酶A(protein kinase A, PKA)、磷酸化PKA (p-PKA)、cAMP 反应元件结合蛋白(cAMP response element-binding protein, CREB)、磷酸化CREB (p-CREB)、BDNF、TrkB、磷酸化TrkB (p-TrkB)、Akt、磷酸化Akt (p-Akt)、mTOR和磷酸化mTOR(p-mTOR)抗体(Abcam);抗PI3K和磷酸化PI3K(p-PI3K)抗体(CST);反转录试剂盒和RT-qPCR荧光定量试剂盒(北京宝日医生物技术有限公司);PCR引物设计合成(上海生工)。
3 方法
3.1抑郁症大鼠模型的制备及实验分组 根据文献采用双侧卵巢摘除与慢性不可预知性温和应激两步法复制抑郁症动物模型[13]。实验分为:假手术(sham)组、模型(model)组及DEX(2.5、5和10 μg/kg)组,每组12只大鼠。DEX各剂量组腹腔注射给药,连续给药21 d。sham组和model组给予等体积生理盐水。各种应激方法参照文献[14],每日给予1种应激刺激。
3.2强迫游泳实验 末次应激刺激后48 h内进行强迫游泳实验,具体方法详见参考文献[14]。让大鼠强迫游泳6 min,记录后4 min 内大鼠强迫游泳不动时间(forced swimming immobility time, FSIT)。
3.3旷场实验 末次应激刺激后48 h内进行旷场实验,具体方法详见参考文献[15]。记录6 min内大鼠在旷场内垂直运动(大鼠双前足离地1 次为1 分)和水平运动(3 或4 只足同在一个格内计1 分或穿越1 格计1 分)得分。
3.4Morris水迷宫实验 给药后第15 d开始对各组大鼠进行为期5 d的游泳训练,第20 天进行正式实验,具体方法详见参考文献[14]。数据采集和处理由Morris水迷宫视频追踪系统完成。
3.5海马病理检测 腹主动脉放血处死大鼠,多聚甲醛腹主动脉灌流固定10 min,开颅取脑,参照《大鼠脑读片提要及图谱》分离海马组织。固定、包埋、切片后,按尼氏染色步骤进行染色,光镜下观察病理变化。
3.6RT-qPCR检测大鼠海马IL-1β、IL-6和TNF-α mRNA的表达 RT-qPCR操作方法及反应条件参照我们前期的研究结果[16]。用StepOnePlus System SDS Software分析数据,统计各组2-ΔΔCt值,计算相应RQ值,比较各组mRNA的表达水平。引物序列见表1。

表1 RT-qPCR的引物序列
3.7Western blot检测大鼠海马相关蛋白的表达 低温条件下提取海马组织总蛋白,BCA法测定蛋白浓度。Western Blot具体操作方法详见我们前期研究成果[16]。I抗分别为IL-1β(1∶1 000)、IL-6(1∶1 000)、TNF-α(1∶1 000)、PKA(1∶1 000)、p-PKA(1∶500)、CREB(1∶1 000)、p-CREB(1∶1 000)、BDNF(1∶1 000)、TrkB(1∶1 000)、p-TrkB(1∶500)、PI3K(1∶1 000)、 p-PI3K(1∶500)、Akt(1∶1 000)、p-Akt(1∶500)、mTOR(1∶1 000)、p-mTOR(1∶500)及GAPDH(1∶2 000),相应II抗稀释度为1∶2 000~1∶5 000。用ImageJ 1.43软件进行灰度值测量并分析蛋白表达情况。
4 统计学处理
数据以均数±标准差(mean±SD)表示。采用单因素方差分析(one-way ANOVA)及Newman-Keuls-Student多重比较q检验进行统计学分析。以P<0.05为差异有统计学意义。
结 果
1 DEX对抑郁症大鼠FSIT的影响
大鼠FSIT由sham组的(81.2±9.1) s增加到model组的(121.9±11.8) s (P<0.01),提示抑郁症模型制备成功;与model组相比,DEX各剂量组大鼠FSIT明显降低(P<0.05或P<0.01),见表2。
2 DEX对抑郁症大鼠自发活动的影响
大鼠在旷场内水平运动得分和垂直运动得分由sham组的87.1±6.8和38.6±4.5分别降低到mo-del组的40.4±3.7和18.8±2.2(P<0.01),提示抑郁症模型制备成功;与model组相比,DEX各剂量组大鼠水平运动与垂直运动呈剂量依赖性的增加(P<0.05或P<0.01),表明DEX对大鼠抑郁样症状具有一定的改善作用,见表2。
表2 右美托咪定对抑郁症大鼠强迫游泳不动时间、水平运动及垂直运动的影响
Table 2. Effects of dexmedetomidine (DEX) on forced swimming immobility time, horizontal ambulation and vertical ambulation in depressive rats (Mean±SD.n=12)

GroupForced swimming immobility time (s)Horizontal ambulationVertical ambulationSham81.2±9.187.1±6.838.6±4.5Model121.9±11.8**40.4±3.7**18.8±2.2**DEX (2.5 μg/kg)110.2±12.350.2±4.8#24.5±2.9DEX (5 μg/kg)103.9±10.2#55.4±5.4##26.9±3.1#DEX (10 μg/kg)99.3±9.8##60.8±5.6##30.2±3.4##
**P<0.01vssham group;#P<0.05,##P<0.01vsmodel group.
3 DEX对抑郁症大鼠空间学习与记忆能力的影响
大鼠逃避潜伏期由sham组的(7.6±1.4) s增加到model组的(15.9±3.7) s而穿越平台次数由sham组的(4.8±1.3) min-1降低到model组的(1.7±0.8) min-1(P<0.01);与model组相比,DEX各剂量组大鼠逃避潜伏期明显降低而穿越平台次数明显增加(P<0.05或P<0.01),表明DEX能够改善抑郁症大鼠空间学习与记忆能力,见表3。
表3 右美托咪定对抑郁症大鼠空间学习与记忆能力的影响
Table 3. Effects of dexmedetomidine (DEX) on the spatial learning and memory ability in depressive rats (Mean±SD.n=12)

GroupEscape latency (s)Times of crossing the flat (min-1)Sham7.6±1.44.8±1.3Model15.9±3.7**1.7±0.8**DEX (2.5 μg/kg)12.0±3.52.9±1.0DEX (5 μg/kg)10.8±2.9#3.3±1.2#DEX (10 μg/kg)9.9±2.6##3.8±1.1##
**P<0.01vssham group;#P<0.05,##P<0.01vsmodel group.
4 DEX对抑郁症大鼠海马神经元病理变化的影响
尼氏染色显示sham组海马神经元形态正常,而模型组海马神经元,排列紊乱,分层不清,胞膜皱缩,染色质聚集、胞核不清楚;而给予不同剂量(2.5、5和10 μg/kg)DEX干预21 d后,上述病理损伤明显减轻,表明DEX对抑郁症大鼠海马神经元具有一定的保护作用,见图1。

Figure 1. Pathological changes of hippocampal neurons in each group (×400).
图1 各组大鼠海马神经元病理形态学变化
5 DEX对抑郁症大鼠海马炎症因子IL-1β、IL-6及TNF-α表达的影响
与sham组相比,model组大鼠海马IL-1β、IL-6及TNF-α mRNA和蛋白表达水平均明显升高(P<0.01);与model组相比,DEX(2.5、5、10 μg/kg)各剂量组IL-1β、IL-6及TNF-α mRNA和蛋白表达水平均明显降低(P<0.05或P<0.01),表明DEX具有一定的抗炎作用,见表4、图2。
表4 右美托咪定对抑郁症大鼠海马IL-1β、IL-6及TNF-α mRNA表达的影响
Table 4. Effects of dexmedetomidine (DEX) on IL-1β, IL-6 and TNF-α mRNA expression in hippocampal tissues of depressive rats (Mean±SD.n=8)

GroupIL-1βIL-6TNF-αSham1.01±0.101.03±0.111.02±0.09Model5.32±0.43**3.95±0.48**4.84±0.42**DEX (2.5 μg/kg)4.46±0.38#2.87±0.43#4.08±0.43#DEX (5 μg/kg)4.13±0.37##2.54±0.36##3.86±0.37##DEX (10 μg/kg)3.67±0.29##2.38±0.31##3.78±0.33##
**P<0.01vssham group;#P<0.05,##P<0.01vsmodel group. Dexmedetomidine: DEX.
6 DEX对抑郁症大鼠海马p-PKA、p-CREB、BDNF及p-TrkB蛋白表达的影响
与sham组相比,model组大鼠海马p-PKA、p-CREB、p-TrkB及BDNF蛋白表达水平均明显降低(P<0.01);与model组相比,DEX各剂量组大鼠海马PKA、CREB、TrkB蛋白磷酸化水平及BDNF蛋白表达水平明显升高(P<0.05或P<0.01),见图3。
7 DEX对抑郁症大鼠海马PI3K/Akt/mTOR信号通路蛋白表达的影响
与sham组相比,model组大鼠海马p-PI3K、p-Akt 及p-mTOR蛋白水平均明显降低(P<0.01);与model组相比,DEX各剂量组海马PI3K、Akt及mTOR蛋白磷酸化水平均明显升高(P<0.05或P<0.01),见图4。
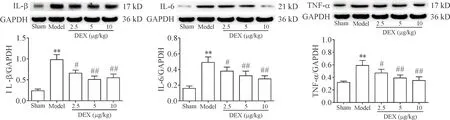
Figure 2. Effects of dexmedetomidine (DEX) on IL-1β, IL-6 and TNF-α protein expression in rat hippocampus detected by Western blot. Mean±SD.n=8.**P<0.01vssham group;#P<0.05,##P<0.01vsmodel group.
图2 Western blot检测各组大鼠海马IL-1β、IL-6及TNF-α蛋白表达情况
讨 论
DEX是一种新型的高选择性α2-肾上腺素受体激动剂,主要用于ICU镇静和辅助镇痛[17]。最近研究发现DEX通过促进神经营养因子的释放,维持脊髓星形胶质细胞活力而减轻脊髓缺血再灌注损伤导致的神经元损伤[18]。动物实验也发现DEX对大鼠颅脑创伤后的脑损伤具有脑保护作用,其机制与其抗炎、抗凋亡,减轻脑水肿有关[19]。而最近通过临床和动物实验发现DEX对预防术后认知功能障碍有积极作用[20]。以上结果表明DEX具有一定的神经保护作用。而本研究发现,与抑郁症模型组相比,DEX各剂量组给药21 d后,通过强迫游泳实验发现抑郁症大鼠强迫游泳不动时间明显降低,通过旷场实验发现抑郁症大鼠自发活动明显增加,通过Morris 水迷宫实验空间学习与记忆能力明显增强。这些研究结果表明右美托咪啶具有一定的抗抑郁作用。
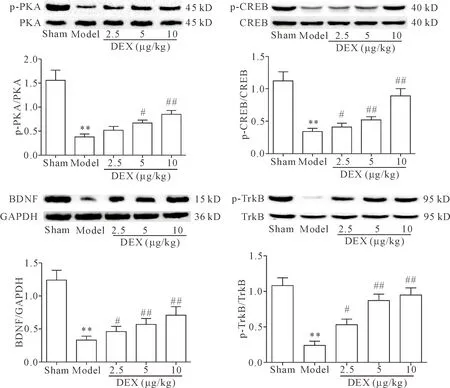
Figure 3. Effects of dexmedetomidine (DEX) on p-PKA, p-CREB, BDNF and p-TrkB protein levels in rat hippocampus detected by Western blot. Mean±SD.n=8.**P<0.01vssham group;#P<0.05,##P<0.01vsmodel group.
图3 Western blot检测各组大鼠海马p-PKA、p-CREB、BDNF 及p-TrkB蛋白表达情况
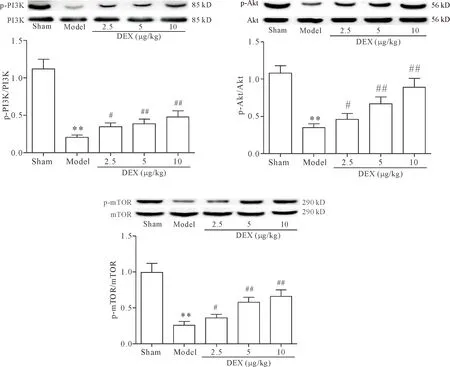
Figure 4. Effects of dexmedetomidine (DEX) on p-PI3K, p-Akt and p-mTOR protein levels in rat hippocampus detected by Western blot. Mean±SD.n=8.**P<0.01vssham group;#P<0.05,##P<0.01vsmodel group.
图4 Western blot检测各组大鼠海马p-PI3K、p-Akt 及p-mTOR蛋白表达情况
BDNF是神经营养因子家族的主要成员之一。研究发现BDNF及其受体TrkB参与了神经突触的可塑性调节,参与了情绪障碍相关疾病的病理生理学过程[21]。动物实验发现氟西汀的抗抑郁作用除了抑制突出间隙的5-HT再摄取外,还与其增加CREB磷酸化水平、上调BDNF的表达有关[22]。另外Ge等[23]研究表明白藜芦醇通过抗炎、上调CREB的磷酸化水平和BDNF的表达而抑制脂多糖诱导的小鼠抑郁样行为。临床研究进一步发现沃替西汀可能通过增加抑郁症患者血浆BDNF水平,进而影响BDNF相关信号通路而发挥抗抑郁作用[24]。另外有研究证实DEX通过抑制NF-κB信号通路的激活、降低促炎因子TNF-α和IL-6的水平而减轻脂多糖诱导的急性大鼠肺损伤[25]。同时Zhu等[26]研究表明DEX能够减轻大鼠术后认知障碍,其机制与其减轻海马炎症反应、激活cAMP/PKA/CREB信号通路有关。综上可知,DEX可能通过抗炎、激活cAMP/PKA/CREB信号通路、上调BDNF的表达和增加TrkB磷酸化水平而产生神经保护作用。本研究结果发现DEX处理21 d后,海马神经元损伤明显减轻,同时海马炎症因子IL-1β、IL-6及TNF-α的表达水平明显降低,而PKA和CREB的磷酸化水平均显著升高,同时BDNF的表达水平和TrKB磷酸化水平也显著提高。这些结果表明右美托咪啶可能通过影响BDNF相关信号通路而发挥抗抑郁作用,但具体机制有待进一步研究。
mTOR是一种高度保守的丝/苏氨酸激酶。近年来研究发现由mTOR信号异常引起的海马神经元突触蛋白缺陷与抑郁症的发生密切相关[27]。而氯胺酮的抗抑郁效应与其激活mTOR信号通路有关[7]。Koskimaki等[28]研究发现BDNF 是mTOR信号通路参与突触可塑性和突触传递的重要调节因子。另外Lima等[29]研究还发现丙戊酸通过激活BDNF/TrkB信号通路,活化PI3K/Akt,进一步激活mTOR信号通路,促进突触可塑性和神经生长而起到效抗抑郁作用。本研究发现不同剂量DEX均能上调海马PI3K、Akt和mTOR的磷酸化水平,提示右美托咪啶可能通过调节海马BDNF的蛋白表达、激活PI3K/Akt/mTOR信号通路而产生抗抑郁作用。
综上所述,DEX能够改善抑郁症大鼠行为及认知功能,其机制可能与其抗炎、上调海马PKA和CREB磷酸化水平、提高BDNF的表达水平、促进TrKB磷酸化,进而活化PI3K/Akt/mTOR信号通路有关,但具体机制还有待进一步研究。
