鲍曼不动杆菌荚膜通过抑制PI3K/Akt/mTOR信号通路促进鼠巨噬细胞自噬和凋亡
2020-03-02韩长鸣戴晓玥段前梅仇圣刚石立新夏雯邹治情DinshKumar吴亮阴晴许化溪
韩长鸣,戴晓玥,段前梅,仇圣刚,石立新,夏雯,邹治情,Dinsh Kumar K, 吴亮,阴晴,许化溪
(1.江苏大学医学院,江苏 镇江 212013;2.扬州市江都人民医院神经内科,江苏 扬州 225200;3.江苏大学附属医院检验科,江苏 镇江 212001)
鲍曼不动杆菌(Acinetobacterbaumannii)属于机会致病菌,是目前临床中重要的多重耐药菌,广泛存在于医院环境中,可引起免疫力低下患者的严重感染。近年来,住院患者中该菌的分离率上升迅速,并且耐药性也呈快速上升趋势,甚至出现了对碳青霉烯酶和多粘菌素耐药的“超级细菌”[1]。现有的研究多关注于该菌迅速获得耐药性的机制,但对其毒力因子和致病机制研究却极少关注,临床工作对于严重鲍曼不动杆菌感染患者仍缺乏有效治疗手段,患者死亡率极高[2]。
巨噬细胞是人体第一道免疫屏障的重要组成,也是重要的抗原递呈细胞,在抵抗鲍曼不动杆菌感染中发挥重要作用[3]。细胞的自噬和凋亡都属于程度性死亡,均可以由病原体感染所调控,是病原体逃避宿主免疫系统清除的重要手段。病原体通过各种细胞信号通路调控宿主巨噬细胞自噬和凋亡,其中,PI3K/Akt/mTOR信号通路是目前研究的热点[4]。PI3K/Akt/mTOR信号通路是重要的细胞生存通路之一,在促进细胞增殖、运动、侵袭和转移,以及抑制细胞自噬和凋亡中发挥重要作用,多种病原体在宿主体内增殖和致病过程均与其激活或抑制密切相关[5]。鲍曼不动杆菌的侵入也可以诱导宿主巨噬细胞的自噬和凋亡,但其诱导机制目前仍不清楚。本研究探讨鲍曼不动杆菌调控鼠巨噬Raw 264.7细胞PI3K/Akt/mTOR信号通路活化,及其诱导Raw 264.7细胞自噬和凋亡的相关机制。
1 材料和方法
1.1 材料
1.1.1 菌株和细胞株 鲍曼不动杆菌分离于江苏大学附属医院患者痰液,分纯菌株冻存于15%脱脂牛奶中;鼠巨噬Raw 264.7细胞购于上海中科院细胞库;哥伦比亚琼脂培养基购自青岛海博生物技术有限公司;羊血购自贝瑞特生物公司;刚果红染料购自上海生工公司;结晶紫染液购自北京索莱宝生物公司;RPMI 1640培养基(HyClone公司);胰蛋白酶(1 ∶250)、胎牛血清(美国Gbico公司);Annexin V-FITC/PI检测试剂盒购自南京Vazyme公司;内参抗体GAPDH抗体、HRP标记羊抗兔和抗鼠抗体、兔抗鼠一抗p-PI3K和PI3K抗体,p-Akt和Akt抗体,以及p-m-TOR和m-TOR抗体均购自武汉博士德公司;磷酸化酶抑制剂(美国Roche公司);其他化学试剂均购自上海生工公司。
1.2 实验方法
1.2.1 鲍曼不动杆菌荚膜厚度检测 采用吴亮等[6]刚果红染色法染色临床分离的鲍曼不动杆菌。具体方法如下,取刚果红染料0.8 g溶于20 mL蒸馏水中备用,另配5% HCl用于脱色。将刚果红染液与胎牛血清按4 ∶1比例混合后取1滴滴加于玻片上,取血平板上过夜生长的鲍曼不动杆菌菌落与上述液体充分混合,按推制血片的方法制成推片,自然干燥。滴加数滴5% HCl 室温下脱色1 min,经流水冲洗,再加结晶紫染液1 min,洗水冲洗,空气中干燥后镜检。根据镜检结果选择出两株荚膜厚度差异明显的菌株,分别命名为厚荚膜菌株(Ab-H株)和薄荚膜菌株(Ab-B株)用于后续实验。
1.2.2 Raw 264.7细胞培养和细菌感染 用含10%胎牛血清的RPMI 1640培养液培养Raw 264.7细胞,待细胞生长融合至70%~80%时消化细胞,接种于6孔板,置于37℃ 5% CO2环境中培养。Ab-H株和Ab-B株分别于LB培养基中扩增培养,经10 h振摇培养后获得新鲜菌液,以无菌PBS洗涤并调整细菌密度为1×109/mL[D(600 nm)=1]。在生长融合至70%的Raw 264.7细胞中分别加入鲍曼不动杆菌Ab-H株和Ab-B株(细菌数量 ∶细胞数量=10 ∶1),继续置于37℃ 5% CO2环境中培养。于感染后1 h、3 h和6 h时收集细胞,用于免疫印迹检测和流式细胞术分析。
1.2.3 免疫印迹检测 免疫印迹检测PI3K、Akt和mTOR在鲍曼不动杆菌Ab-H株和Ab-B株感染后的磷酸化水平,以及自噬相关蛋白LC-3和Beclin-1表达水平。检测步骤如下:收集细胞1×106个,以1 500 r/min离心5 min,弃上清液,加入无菌PBS洗涤3次;在细胞沉淀中加入100 μL RIPA裂解液,以及PMSF(100 mmol/L)1 μL、Na3VO4(200 mmol/L)0.5 μL、NaF(0.5 mmol/L)0.2 μL、磷酸化酶抑制剂15 μL,细胞悬浮混匀,在冰上静置20 min。于4℃中以15 000 r/min离心15 min;取上清液,采用BCA法测定样本蛋白浓度。行SDS-PAGE,120 V电泳2 h;350 mA恒流转印90 min,使蛋白转移至PVDF膜;5%脱脂奶粉封闭2 h;所有一抗稀释度为1 ∶100,内参GAPDH抗体稀释度为1 ∶1 000,4℃下孵育过夜;次日以TBST缓冲液洗涤3次,每次10 min;二抗采用羊抗兔HRP-IgG,抗体稀释度为1 ∶2 000,于室温下孵育1 h;以TBST缓冲液充分洗涤3次,每次10 min;滴加ECL底物显色液,避光显色1 min;照相记录并以仪器自带Quantity One软件分析目的条带灰度。
1.2.4 流式细胞术检测细胞凋亡率和活性氧生成 Annexin V-FITC/PI法检测细胞凋亡,严格按照试剂盒操作说明书进行。先以不含EDTA的胰酶细胞消化液消化细胞,精确计数1×106个细胞,以1 500 r/min离心5 min;取细胞沉淀,加入195 μL Annexin-V-FITC结合缓冲液重悬细胞,加入5 μL Annexin-V-FITC和10 μL PI溶液,置于37 ℃温箱避光孵育15 min后立即行流式细胞术检测。DCFH-DA荧光探针法检测细胞活性氧时,严格按照试剂盒操作说明书进行。以无血清细胞培养液按1 ∶1 000稀释DCFH-DA荧光探针原液,其终浓度为10 μmol/L,胰酶消化收集细胞并调整细胞密度为1×106个/mL。各组细胞中加入DCFH-DA荧光探针工作液,37 ℃中孵育20 min。孵育结束后,以无血清细胞培养液洗涤细胞3次,采用流式细胞仪检测细胞DCF荧光强度。
1.3 统计学分析

2 结果
2.1 鲍曼不动杆菌荚膜厚度检测
鲍曼不动杆菌经刚果红染色后,细菌菌体染成紫黑色,背景染成橘红色,细菌荚膜不着色,可以很清晰地分辨细菌荚膜厚度(图1)。染色重复3次并在显微镜下反复观察比较,选择出两株荚膜厚度差异显著的鲍曼不动杆菌,分别命名为厚荚膜株(Ab-H株)和薄荚膜株(Ab-B株),用于后续实验。
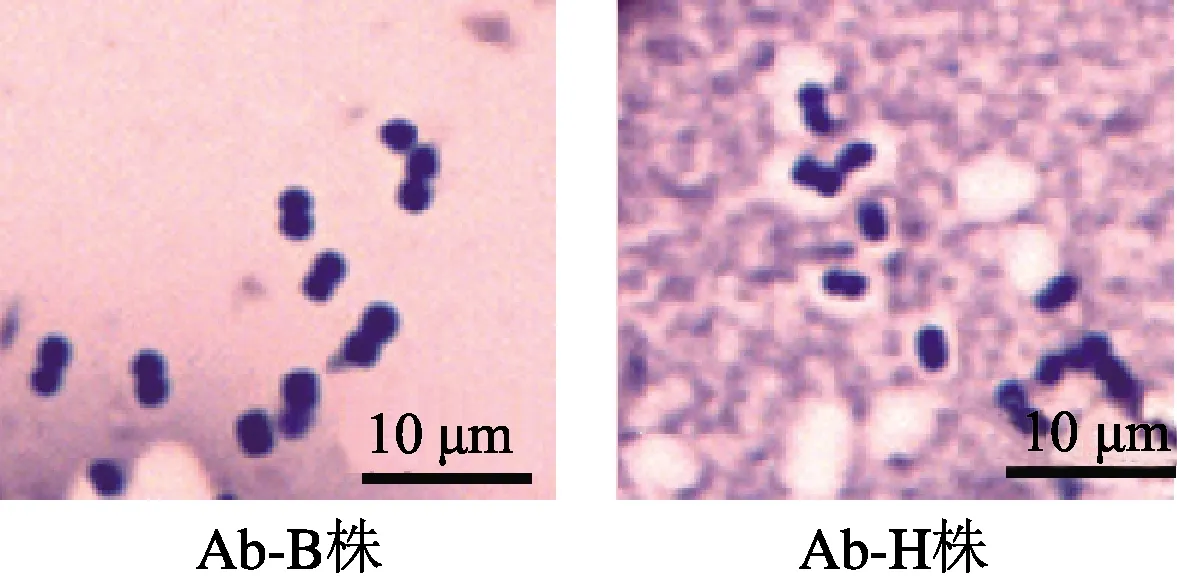
图1 刚果红染色法检测鲍曼不动杆菌荚膜
2.2 不同荚膜厚度鲍曼不动杆菌诱导Raw 264.7细胞自噬和凋亡比较
Ab-H株和Ab-B株均可诱导Raw 264.7细胞不同程度的自噬和凋亡(图2和图3)。Raw 264.7细胞自噬相关蛋白LC-3Ⅱ在感染后1 h时未被检出,但随感染时间延长其表达量在各组细胞均增加。感染后3 h和6 h时,Ab-B组和Ab-H组细胞LC-3Ⅱ表达量显著高于对照组(3 h,Ab-B组:t=-6.24, Ab-H组:t=-6.76,P均<0.05;6 h,Ab-B组t=-4.27, Ab-H组t=-10.73,P<0.05),Ab-B组和Ab-H组细胞LC-3Ⅱ表达量差异无统计学意义(3 h,t=-1.76,P>0.05;6 h,t=-3.87,P>0.05)。两株细菌感染Raw 264.7细胞1 h、3 h和6 h时,自噬相关蛋白Becline-1表达量和细胞凋亡率均显著高于对照组(P均<0.05),且Ab-H组相关蛋白表达量和细胞凋亡率均明显高于Ab-B组(P均<0.05)。
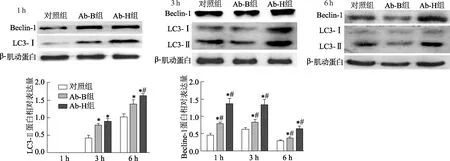
*:P<0.05,与对照组比较;#:P<0.05,与Ab-B组比较
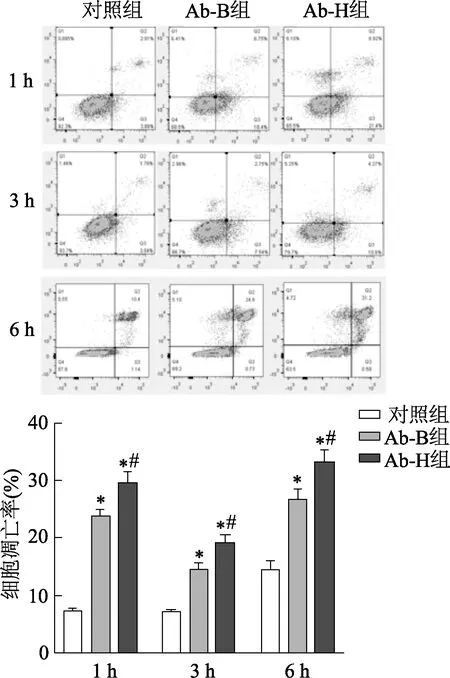
同一时间内,*:P<0.05,与对照组比较;#:P<0.05,与Ab-B组比较
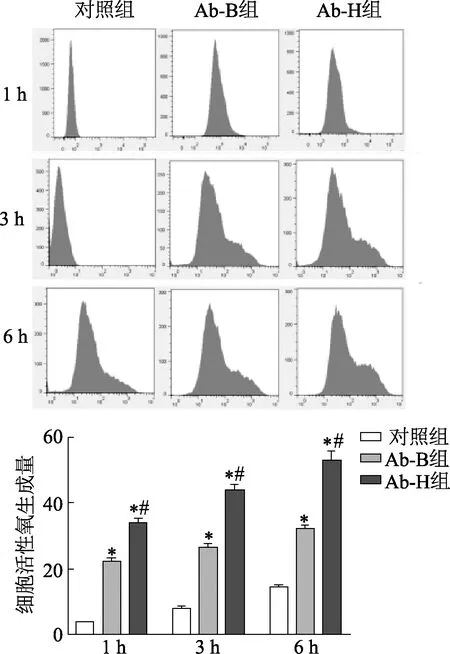
2.3 不同荚膜厚度鲍曼不动杆菌诱导Raw 264.7细胞活性氧生成增加
两株鲍曼不动杆菌感染后1 h、3 h和6 h时,Raw 264.7细胞活性氧生成量均较对照组显著增加(P均<0.05),且Ab-H组活性氧生成量显著高于Ab-B组(1 h,t=-9.25,P<0.05;3 h,t=-13.61,P<0.05;6 h,t=-11.39,P<0.05)。见图4。
2.4 不同荚膜厚度鲍曼不动杆菌抑制PI3K/Akt/mTOR信号通路的活化
两株不同荚膜厚度鲍曼不动杆菌感染Raw 264.7细胞后,细胞PI3K、Akt和mTOR的磷酸化水平显著受到抑制,且抑制作用随着时间延长而增强(P<0.05)。以Ab-H株作用Raw 264.7细胞1 h和3 h时,细胞PI3K磷酸化水平显著低于Ab-B株作用(1 h,t=3.20,P<0.05;3 h,t=3.57,P<0.05),作用6 h时Ab-B组和Ab-B组细胞PI3K磷酸化水平差异无统计学意义(t=0.346,P>0.05);以Ab-H株作用Raw 264.7细胞3 h时,细胞Akt磷酸化水平显著低于Ab-B株作用(t=3.01,P<0.05),1 h和6 h时Ab-B组和Ab-B组细胞Akt磷酸化水平差异无统计学意义(P均>0.05);以Ab-H株作用Raw 264.7细胞1h、3 h和6 h时,细胞mTOR磷酸化水平均显著低于Ab-B株作用(1 h,t=3.90,P<0.05;3 h,t=4.56,P<0.05;6 h,t=2.93,P<0.05)。见图5。
同一时间内,*:P<0.05,与对照组比较;#:P<0.05,与Ab-B组比较
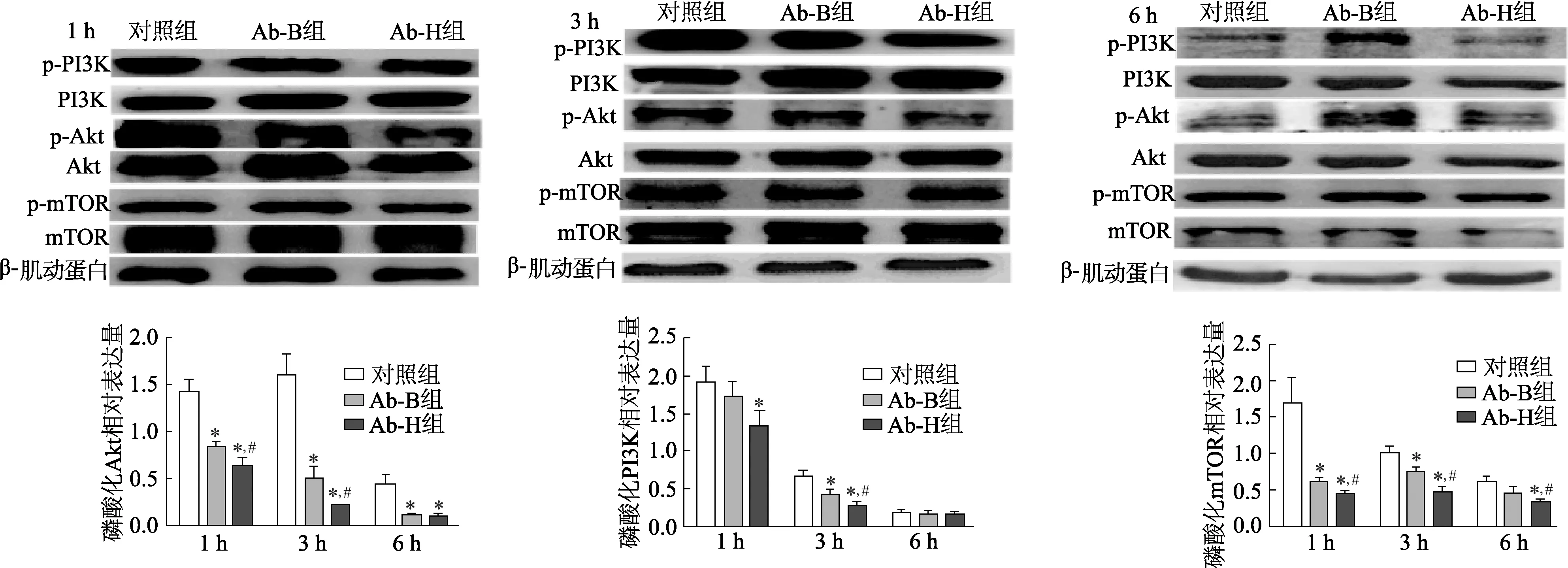
同一时间内,*:P<0.05,与对照组比较;#:P<0.05,与Ab-B组比较
图5 各组Raw 264.7细胞PI3K、Akt和mTOR蛋白磷酸化水平检测
3 讨论
多重耐药和泛耐药鲍曼不动杆菌是造成医院内感染和呼吸机相关性肺炎的主要病原菌,但不同菌株的致病力差异显著,目前尚无鲍曼不动杆菌毒力评估方法,无法为临床治疗提供支持[7]。荚膜是鲍曼不动杆菌的重要毒力因子,可以发挥保护细菌并抵抗宿主免疫细胞吞噬清除的功能。研究表明,细菌荚膜是重要的病原相关分子模式,可由宿主模式识别受体识别,并经过复杂途径激活宿主免疫系统[8]。在上述过程中宿主为抵御病原体会产生大量活性氧,活性氧在炎症损伤的发生和发展中发挥着重要作用。本研究结果表明,厚荚膜菌株(Ab-H株)诱导鼠巨噬细胞产生活性氧能力显著高于薄荚膜菌株(Ab-B株),其造成的炎症损伤也更强。
现有的鲍曼不动杆菌荚膜研究集中于疫苗研制以及提高患者抗感染能力[9],缺乏致病机制研究[10]。新生隐球菌外部厚重的荚膜不仅可以抵御外界不良环境,保护细菌自身不被宿主白细胞吞噬清除,还能够直接活化宿主巨噬细胞向M1极化,分泌大量IL-1β、IL-6和TNF-α等炎症因子,并引起巨噬细胞的“呼吸爆发”和大量活性氧生成,造成肺部细胞凋亡、自噬和坏死[11]。由此认为鲍曼不动杆菌荚膜也存在类似生物学功能。研究发现,鲍曼不动杆菌的感染能够诱导Raw 264.7细胞自噬和凋亡,且细胞自噬和凋亡程度与细菌荚膜厚度呈正相关。自噬和凋亡都是细胞的两种特殊死亡现象。自噬是细胞吞噬自身细胞质蛋白或细胞器并使其包被进入囊泡,与溶酶体融合形成自噬溶酶体,降解其所包裹的内容物的过程,通过自噬可以实现细胞本身的代谢需要和某些细胞器的更新[12]。凋亡是细胞为维持内环境稳定,发生由基因控制的自主有序死亡。宿主巨噬细胞是固有免疫的重要组分,病原菌通过诱导宿主巨噬细胞的自噬和凋亡可以有效地降低宿主免疫力,有助于细菌在宿主体内存活[13]。本研究结果显示,Ab-H株诱导Raw 264.7细胞自噬和凋亡能力显著强于Ab-B株,表明厚荚膜菌可以诱导更多宿主巨噬细胞自噬和凋亡,减弱宿主免疫能力,有利于细菌的增殖。
活性氧是细胞自噬和凋亡重要的诱导剂,可以通过多条通路如atg4、过氧化氢酶和线粒体电子传递链引发细胞自噬和凋亡[14]。PI3K/Akt/mTOR信号通路是哺乳动物细胞重要生存通路之一,其中Akt分子作为PI3K/Akt/mTOR信号通路的关键分子,在促进细胞增殖、侵袭和转移,抑制细胞自噬和凋亡中发挥核心作用。活性氧可以通过抑制PI3K/Akt/mTOR信号通路激活[15],促进各种炎症因子的分泌,诱导细胞自噬和凋亡的发生[16]。本研究结果表明,两株鲍曼不动杆菌均可以抑制Raw264.7细胞PI3K/Akt/mTOR信号通路的激活,而厚荚膜菌株抑制能力显著强于薄荚膜菌株。
综上所述,鲍曼不动杆菌荚膜是诱导宿主巨噬细胞自噬和凋亡的重要因子,其机制是通过诱导宿主巨噬细胞产生大量活性氧,抑制巨噬细胞PI3K/Akt/mTOR信号通路的激活,造成宿主巨噬细胞大量凋亡或自噬,致鲍曼不动杆菌逃避宿主免疫系统清除并大量增殖。并且,鲍曼不动杆菌诱导活性氧产生和巨噬细胞的凋亡或自噬以及抑制细胞PI3K/Akt/mTOR信号通路的激活,与其荚膜厚度呈正相关。
