福建省产毒素多杀性巴氏杆菌的分离鉴定及致病性研究
2020-01-17饶秋华周伦江罗土炎王隆柏
饶秋华,刘 洋,周伦江,罗土炎,王隆柏*
(1.福建省农业科学院农业质量标准与检测技术研究所,福建福州350003;2.福建省农业科学院畜牧兽医研究所,福建福州350013)
猪传染性萎缩性鼻炎(Swine infectious atrophic rhinitis,AR),是由产毒素多杀性巴氏杆菌(ToxigenicPasteurellamultocida,T+Pm)引起的一种慢性接触性呼吸道传染病[1]。宿主在感染多杀性巴氏杆菌(Pasteurellamultocida,Pm)发病的过程中,脂多糖(Lipopolysaccharide,LPS)起到了重要的作用,根据LPS 基因编码的不同,将其分为8 种LPS 基因型(L1~L8),研究表明,当LPS 的结构被破坏后,Pm在宿主体内的毒力降低[2-3]。此外,荚膜也是Pm 的主要致病因子之一,根据其荚膜抗原可将其分为A、B、D、E、F 5 个血清型,导致AR 的Pm 其主要为血清D 型,少数为血清A 型[4-5]。血清D 型的菌株能分泌一种由toxA基因编码的巴氏杆菌毒素,直接引起猪的鼻梁变形,鼻甲骨萎缩,同时诱发其他病原微生物感染,严重的可导致死亡,给养殖业带来了严重的经济损失[6-8]。
为查明福建南平市某猪场患病猪的主要病原,本研究通过采集患病猪的鼻腔拭子,对病原菌进行分离和鉴定,并对分离菌株的血清型和致病性进行分析,为今后该病原的致病机理、流行病学调查和防控提供依据。
1 材料与方法
1.1 主要试剂 瑞氏染色液购自OXOID 公司;麦康凯琼脂培养基和改良马丁琼脂培养基均购自北京索莱宝科技有限公司;TaqDNA 聚合酶、PCR 试剂、DNA Marker 购自宝生物工程(大连)有限公司;细菌DNA 提取试剂盒购自TianGen 公司;细菌微量生化反应管和药敏纸片购自杭州微生物试剂有限公司;40 日龄巴氏杆菌阴性实验猪购自福州某种猪场。
1.2 细菌分离培养与纯化 采集福建南平市某猪场30 份发病猪鼻腔拭子划线涂布于麦康凯琼脂培养基平板和改良马丁琼脂培养基平板上培养,37 ℃培养20 h 后,根据在显微镜下45°折光观察到的形态特征挑取单个可疑菌落在改良马丁肉汤培养基上继续培养20 h 后经瑞氏染色观察。
1.3 分离菌株荚膜型及其毒力基因的鉴定 按照基因提取试剂盒说明书提取分离细菌的DNA,参照文献[9]引物建立的PCR 方法鉴定其荚膜基因型,采用25 μL 反应体系,PCR 反应程序如下:94 ℃2 min;94 ℃ 30 s、55 ℃ 30 s、72 ℃ 60 s,35 个循环;72 ℃7 min。参照文献[10]引物建立的PCR 方法对分离菌毒力基因toxA进行鉴定,采用25 μL 反应体系,PCR 反应程序如下:94 ℃ 2 min;94 ℃ 30 s、55 ℃30 s、72 ℃ 48 s,35 个循环;72 ℃ 7 min,引物由吉林库美生物技术有限公司合成。反应结束后PCR产物经琼脂糖凝胶电泳检测。
1.4 分离菌株的LPS 基因型检测 按照基因提取试剂盒说明书提取分离细菌的DNA,参照文献[2]引物建立的PCR 方法对其进行LPS 基因型鉴定,采用25 μL 5 反应体系,PCR 反应程序如下:94 ℃2 min;94 ℃ 30 s、55 ℃ 30 s、72 ℃ 1 min 12 s,35 个循环;72 ℃7 min。反应结束后PCR 产物经琼脂糖凝胶电泳检测。
1.5 分离菌株的生化试验 将分离菌增菌液按照细菌微量生化反应管说明书操作,进行葡萄糖、果糖、甘露醇、麦芽糖、乳糖、鼠李糖、吲哚、MR、VP 等生化试验,置于37 ℃培养48 h 后,观察其主要生化特性。
1.6 分离菌株的药敏试验 挑取纯化的单菌落进行药敏试验,将其接种于改良马丁肉汤培养基上37 ℃培养24 h 后,用液体培养基稀释至最终浓度为3.0×108cfu/mL。用灭菌棉拭子均匀涂布在固体改良马丁琼脂培养基上进行药敏试验,37 ℃培养24 h~48 h后判定结果。
1.7 分离菌株对猪的致病性试验 将4 只40 日龄巴氏杆菌阴性猪平均分成2 组,随机挑选分离好一株血清型为D 型的T+Pm 进行致病性试验,一组滴鼻 + 肌注各 1 mL F5 代 D 型的 T+Pm 培养物,细菌含量为1.2×1010cfu/mL,另一组为PBS 对照,感染后连续观察7 d,记录临床症状和死亡率。采集鼻拭子并进行致病菌的分离,猪发病致死和扑杀后取肺组织固定于10 %福尔马林溶液中,HE 染色观察肺组织的病理变化。
2 结果与讨论
2.1 病原菌分离鉴定结果 采集发病猪鼻腔拭子划线涂布于麦康凯琼脂培养基平板和改良马丁琼脂培养基平板上37 ℃培养20 h 后,改良马丁琼脂培养基上观察到4 种不同形态特征的菌落,麦康凯培养基上无菌落生长,疑似巴氏杆菌的菌落肉眼观察为灰白色,油滴状,边缘整齐,可见光折射下呈蓝色;在显微镜下45°折光观察,菌落呈现强烈荧光,边缘有红蓝黄虹彩(Fg 型),瑞氏染色镜检可见大量两极浓染的单个菌体。表明分离出的可疑菌落形态学特征完全符合Pm 的特征。从30 份发病猪鼻拭子样品中共分离出28 株Pm。
2.2 分离菌株血清型和毒力因子检测结果 对分离的巴氏杆菌进行特异性PCR 检测,结果显示,共有27 株菌株D 型和toxA检测结果为阳性,A 型结果为阴性(图1A),表明分离到27 株D 型T+Pm;一株分离菌A 型结果为阳性,而toxA基因和D 型结果为阴性(图1B),结果表明分离出1 株表膜A 型Pm。综上,表明致福建南平某猪场发病的主要病原菌为D 型 T+Pm。
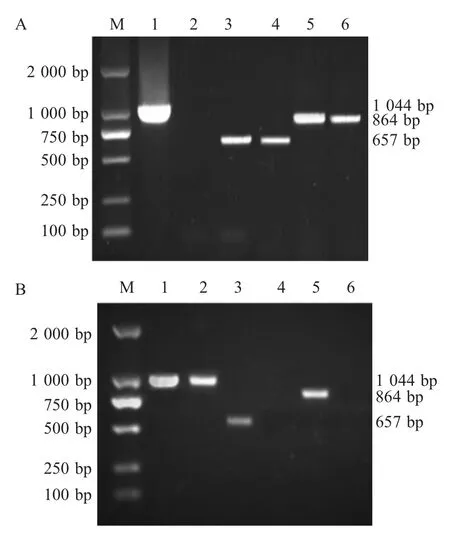
图1 巴氏杆菌血清型和毒力因子检测结果Fig.1 The identification of Pasteurella serotypes and virulence factors
2.3 分离菌株的LPS 基因型检测 将分离的28 株Pm 利用PCR 方法对其LPS 基因型进行鉴定,仅鉴定出L6 型LPS,表明该猪场感染的Pm LPS 基因型单一,L6 型Pm 是导致AR 的重要致病菌。但AR的发生与Pm 基因型之间的关系需要更多地区AR的流行病学数据进行验证。
2.4 分离菌株的生化反应特性及药敏性试验 分离菌株培养48 h 后,发现该分离菌可分解葡萄糖、果糖、甘露醇,产酸不产气,不能分解麦芽糖、乳糖、鼠李糖,吲哚还原试验阳性,MR、VP 试验均为阴性。符合Pm 的生化特性。
荚膜A 型分离菌株药敏结果显示,分离的菌株对诺氟沙星、头孢拉定等敏感,对青霉素、氟苯尼考、庆大霉素耐药,荚膜D 型分离菌株的耐药性结果显示对诺氟沙星、头孢拉定敏感的菌株有27 株,对青霉素耐药的菌株有24 株、对氟苯尼考耐药的有12 株、对庆大霉素耐药的有20 株,从上述结果可以推断出该养殖场存在抗生素滥用的情况,抗生素用药不规范导致巴氏杆菌的耐药性增加,AR 的治疗效果下降[8]。
2.5 分离菌对猪的致病性试验结果 D 型分离菌感染猪后48 h,一只滴鼻+ 肌注实验猪突然死亡,死前口吐白沫,剖检发现肺脏呈熟肉样病变,气管内有大量白色泡沫液体,并且在肺组织中分离到大量巴氏杆菌,经检验发现该分离株与感染菌种为同一菌株。另一头实验猪感染后48 h 出现发热症状,体温最高时达40.7 ℃,生长停滞(感染后21 d 迫杀,体重几乎没有增加)。剖检时肺脏也呈熟肉样病变,在肺组织中分离到大量巴氏杆菌。对照组没有表现出临床症状。病理组织切片显示感染猪肺胸膜脏层轻度水肿,少量炎性细胞浸润,伴少量散在出血,对照组的猪肺组织没有病理变化(图2)。结合以上药敏试验结果,致病性分析结果表明,Pm 在养猪业实际生产过程中存在耐药性增强、致病性增强的趋势,因此在治疗该病的临床用药过程中,需要设计合理的给药方案,减少耐药菌株的产生。
本实验通过菌株的分离鉴定为该地区AR 的流行病学调查、预防及治疗提供了参考依据。
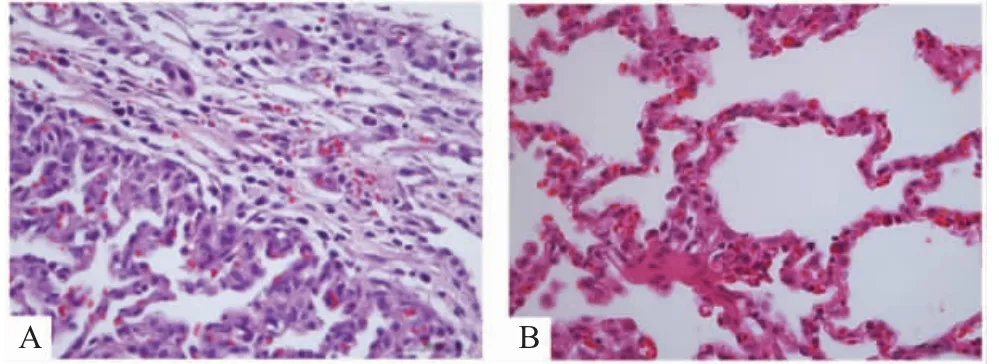
图2 猪猪肺组织病理变化Fig.2 Histopathology of lungs from pigs
