鹅星状病毒LAMP快速检测方法的建立与应用
2020-01-17张玉霞杨金兴蔡李萌袁小远王友令
张玉霞,杨金兴,孟 凯,蔡李萌,袁小远*,王友令*
(1.山东省农业科学院家禽研究所,山东济南250100;2.青岛农业大学动物医学院,山东青岛266109)
2017 年,我国暴发了一种主要引起雏鹅痛风症状的传染病。该病可导致5 日龄~20 日龄雏鹅发生腹泻、跛行或瘫痪,剖检可见内脏器官和关节有大量的尿酸盐沉积,给我国的养鹅业造成了严重经济损失。多位学者研究初步证实鹅星状病毒(Astrovirus,AstV)是该次疫病的主要病原体[1-2]。鹅AstV属于星状病毒科星状病毒属,基因组分析显示:该次分离的病毒株与已发表的火鸡和鸭感染的AstV株明显不同,属于新的基因型[3-4]。目前,实验室检测该病毒的方法主要有RT-PCR 和荧光定量PCR 方法,这些检测方法需借助昂贵的仪器、成本较高,不适用于基层应用[5-6]。
环介导等温扩增技术(Loop-mediated isothermal amplification,LAMP)是一种新型的核酸扩增方法,其反应过程始终维持在恒定的温度下进行。和其它传统的检测方法,如病毒分离鉴定、ELISA、PCR等相比,具有操作简便、高效快速、不需要昂贵仪器的特点,已广泛用于多种动植物的病原微生物检测中[7-8]。本研究针对鹅AstV 的ORF1b 基因序列,设计特异性LAMP 引物,建立了该病毒的快速特异LAMP 检测方法。
1 材料与方法
1.1 主要实验材料 鹅AstV SD17 株、鹅细小病毒GPV-E 株、鹅副黏病毒YG 株和鸭坦布苏病毒HB株由山东省农业科学院家禽研究所SPF 鸡研究中心分离和鉴定;鹅源H9N2 亚型禽流感病毒S2 株由华南农业大学兽医学院提供。
38 份疑似样品于2017 年~2018 年采自山东、江苏、安徽、河南等不同地区养鹅场。发病鹅均临床具有痛风症状,其中5 份为肾脏组织,其它均为肝脏组织。所有样品置于-80 ℃保存。
病毒DNA/RNA 提取试剂盒、RT 试剂盒及一步法RT-PCR 试剂盒购自TaKaRa 公司;LAMP 扩增试剂盒购自日本荣研化学株式会社;TE 可视染料购自天津捷易特生物科技有限公司。
1.2 引物设计与合成 参考GenBank 登录的多株鹅源 AstV 株 ORF1b 序列,在线 website: http://primerexplorer.jp/e/ 设计扩增该基因的LAMP 引物,包括内引物FIP/BIP、外引物F3/B3 和环引物LB/LF(表1)。同 时 利 用 Primer premier 5.0 软 件 设 计RT-PCR 扩增引物PCR-F/PCR-R,预期扩增400 bp。引物由北京擎科生物科技有限公司合成。
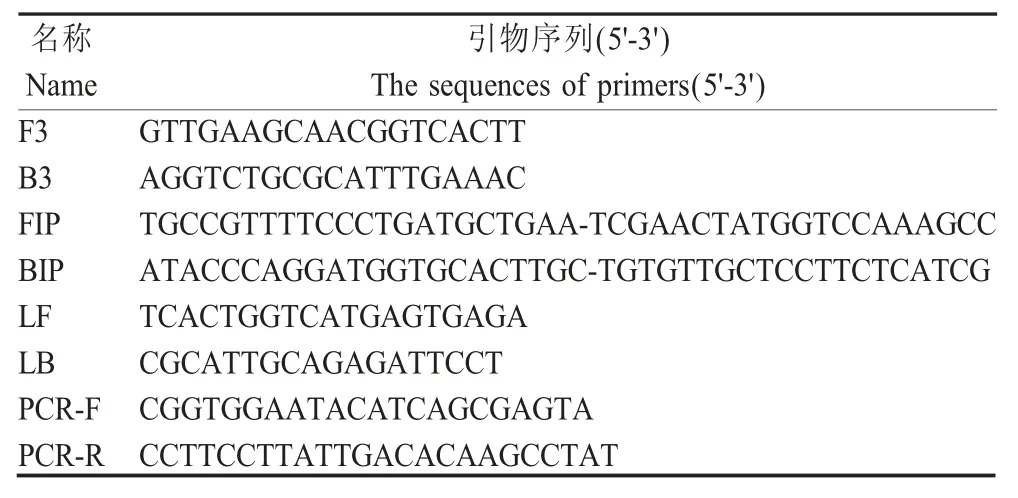
表1 LAMP 和PCR 扩增引物Table 1 The primers used for LAMP and PCR
1.3 LAMP 反应的优化与建立 利用RNA 提取试剂盒提取AstV SD17 株RNA,按照RT 试剂盒说明反转录获得cDNA,利用Nano Drop ND1000 检测其浓度后进行 LAMP 反应。LAMP 反应体系 25 μL 如下:2×buffer 12.5 μL、1.0 μL 酶混合物(EM)、FIP和 BIP 各 40 pmoL、F3 和 B3 各 10 pmoL、LB 和 LF各20 pmoL,cDNA 2 μL,余下为超纯水。设ddH2O为阴性对照。为摸索LAMP 最佳反应温度,根据引物TM 值,共设置了8 个温度梯度:60 ℃、61 ℃、62 ℃、63 ℃、64 ℃、65 ℃、66 ℃、67 ℃。反应时间设置30 min、40 min、50 min、60 min、90 min时间段。反应后基于TE 指示剂颜色的改变判断结果确定LAMP 的最佳反应条件,阳性时为亮蓝色,阴性时为无色。
1.4 特异性试验 采用病毒DNA/RNA 提取试剂盒提取鹅细小病毒的DNA 以及鹅AstV SD17 株、鹅副黏病毒、鸭坦布苏病毒和鹅H9N2 亚型禽流感病毒的RNA,RNA 反转录为cDNA 后作为模板,采用上述优化的LAMP 方法进行特异性检测。每个样品设3 个重复。
1.5 敏感性试验 将反转录得到的AstV cDNA (原液浓度为100 ng/μL) 10 倍倍比稀释,共设置6 个稀释梯度(包括原液在内),浓度依次为100 ng/μL~1 pg/μL,分别以各稀释度cDNA 为模板进行LAMP检测,验证该方法的敏感性。
1.6 临床样本检测 将来自不同养殖区域的38 份疑似发病鹅肝脏、肾脏病料样品剪碎后,按1∶3 体积加入无菌PBS,反复冻融3 次后,3 000 r/min 离心10 min,取上清备用。按照RNA 提取试剂盒说明书提取病毒RNA,反转录后以所得cDNA 为模板,按照建立的LAMP 进行检测。同时所有样品进行一步法RT-PCR 检测,25 μL 的反应体系包括:12.5 μL 2×buffer,PCR-F 和 PCR-R 各 20 pmoL、混合酶 1 μL、RNA 5 μL,余下为 ddH2O。反应过程为 RT:42 ℃ 30 min,94 ℃ 3 min;随后进行 PCR扩增 94 ℃ 20 s、50 ℃ 30 s、72 ℃ 30 s,35 个循环,最后72 ℃4 min。反应产物经0.8 %的琼脂糖凝胶电泳检测。
2 结 果
2.1 LAMP 反应优化结果 在LAMP 反应体系中,对最佳温度和作用时间进行筛选,确定最佳反应温度为64 ℃、最佳反应时间为60 min。
2.2 LAMP 特异性试验结果 利用建立的LAMP 方法分别检测AstV SD17、鹅细小病毒、鹅副黏病毒、鹅H9N2 亚型禽流感病毒和鸭坦布苏病毒,结果显示:仅AstV 样品显示为亮蓝色,判定为阳性,其它样品颜色未见变化,均判为阴性(图1)。表明建立的LAMP 方法能够特异性地检测鹅AstV。

图1 LAMP 方法特异性检测结果Fig.1 Specificity test of LAMP reaction
2.3 LAMP 灵敏性试验结果 将10 倍梯度稀释(包括原液在内,共6 个稀释度)的AstV cDNA 模板分别进行LAMP 检测。结果显示,建立的LAMP 方法能够检测至样本的102稀释度,即1 ng/μL 的cDNA(图2)。表明该方法的敏感性较高。
2.4 临床样品检测结果 对临床采集到的38 份疑似AstV 样品,同时应用本研究建立的LAMP 和RT-PCR 方法检测(部分样品检测结果见图3)。结果显示:对5 份肾脏病料样品,2 种检测方法的阳性率一致,均为3/5;对33 份肝脏样品,LAMP 方法检出20 份阳性样品,比RT-PCR 多检出1 份(表2),通过测序证实这份LAMP 检测阳性样品为AstV。两种方法的阳性符合率为95.65 %。综上表明,本研究建立的LAMP 检测方法更适用于临床Astv 的检测。

图2 LAMP 反应灵敏度检测结果Fig.2 Sensitivity test of LAMP reaction

表2 临床样品 LAMP 与RT-PCR 检测结果Table 2 Comparative evalution of LAMP assay with RT-PCR for clinical smples
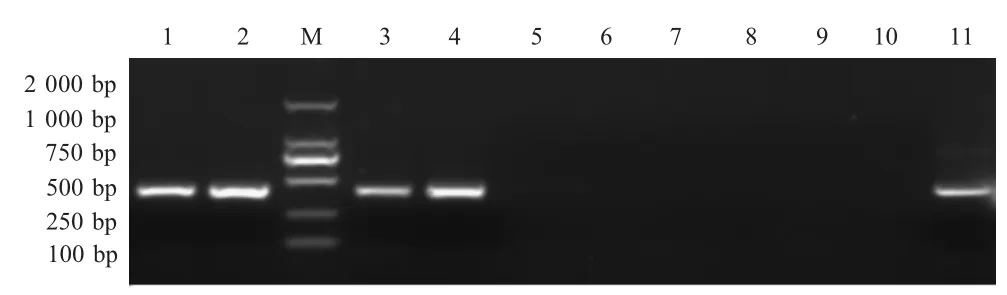
图3 部分临床样品RT-PCR 检测结果Fig.3 Results of RT-PCR assay of some clinical samples
3 讨 论
已有研究表明AstV 不仅在我国水禽群体中分布地区十分广泛,在环境中大量存在,而且具有宽广的宿主范围[9],能够引起鸡和火鸡的肠炎、鸡的肾炎、鸭的病毒性肝炎等,目前无可用的商业化疫苗防疫,导致AstV 难以控制和短期根除。本次疫情中患病雏鹅死淘率高达40 %以上,幸存下来的病鹅预后也较差,对疫区养鹅业造成了重大的经济损失,应对该病原引起足够的重视。因此寻找一种行之有效,简便、实用的检测方法对于该疫病的诊断和防治研究具有重要意义。
国内外对禽病常用的诊断技术诊断包括几个方面:临床诊断、病原检测、血清学诊断和分子生物学诊断等。由于目前禽病发病症状及剖检病变不典型性,仅根据临床症状已很难做到确诊;病原检测主要通过分离获得致病性病原证明病原存在,该方法确实可靠,是经典的确诊方法,但一般所需时间长、成本高,不利于疫情控制;血清学诊断方法主要根据高特异性的抗原抗体反应进行判断,对于新发病确诊难度较大;分子生物学是近年来常用的实验室诊断方法,主要通过检测病毒核酸存在证明病毒感染,包括PCR/RT-PCR、荧光定量PCR/ 荧光定量RT-PCR、LAMP、基因芯片等。本研究所用的LAMP 检测方法,是日本学者Notmomi 等最先公开报道的一种用于基因检测的恒温核酸扩增技术[10],与其他分子生物学检测方法相比,具有快速、敏感、操作简便等特点。本研究根据GenBank 中鹅AstV ORF1b 基因保守区域的6 个特异性部位设计引物,以经RT-PCR 和电镜双重鉴定的AstV SD17 株为阳性对照,利用聚合酶混合物在恒温64 ℃条件下反应60 min 即可完成扩增,在反应管内加入TE染料根据颜色变化直接判定结果,省去了RT-PCR方法的繁琐步骤和对贵重仪器的依赖。经检测该方法特异性强、敏感性与RT-PCR 方法相当。临床样品检测显示,建立的LAMP 方法与传统的RT-PCR方法有较高的符合率,这与其他学者报道的LAMP方法用于检测禽流感、新城疫等[11-12]病毒结果相符。
综上,本研究根据AstV 的保守序列,设计特异性引物并优化反应条件,建立了AstV 的LAMP 检测方法,该方法简便、快速、特异、高效,适用于基层检测部门与检疫机构。
