我国传染性法氏囊病病毒新型变异株分析研究
2020-01-17范林进王雨龙吴甜甜高玉龙刘长军崔红玉张艳萍刘玉凤孙先本刘俊启王笑梅祁小乐
范林进,王雨龙,吴甜甜,李 凯,姜 楠,高玉龙,高 立,刘长军,崔红玉,潘 青,张艳萍,刘玉凤,孙先本,刘俊启,王笑梅,4*,祁小乐*
(1.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/ 禽传染病研究室,黑龙江哈尔滨150069;2.世界动物卫生组织传染性法氏囊病参考实验室,黑龙江哈尔滨150069;3.法国诗华动物保健公司,北京100102;4.江苏高校动物重要疫病与人畜共患病协同创新中心,江苏扬州225009)
传染性法氏囊病(Infectious bursal disease,IBD)是鸡的一种重要免疫抑制病,严重威胁养禽业健康发展。其病原是IBD 病毒(IBDV),其属于双RNA病毒科禽双RNA 病毒属,基因组包括两条双链RNA,即A、B 节段[1]。A 节段编码4 个蛋白,包括结构蛋白VP2 和VP3,具有水解酶活性的VP4 以及非结构蛋白VP5,其中VP2 是IBDV 的衣壳蛋白和主要保护性抗原,与病毒的毒力、细胞嗜性和抗原变异有关[2-5]。VP2 的aa206~aa350 被称为高变区(Hypervariable region,HVR),常被用做 IBDV 的遗传演化分析[6]。
IBDV 有两个血清型,血清I 型主要引起鸡发病,血清II 型对鸡不致病。在过去的几十年里,血清I 型IBDV 主要发生过两次较大的变异,相继出现了经典株、变异株和超强株[1]。上世纪90 年代以来,以急性、高致死率为主要特征的IBDV 超强株(Very virulent IBDV,vvIBDV)席卷全球,给养禽业造成了严重损失[7-8]。经近30 年的努力,基于饲养管理水平的提高和疫苗的广泛使用等因素,vvIBDV感染逐渐被控制。然而近年来IBD 出现了新变化,非典型IBD 在我国部分鸡场相继被发现,感染鸡无明显外观症状,但其中枢免疫器官法氏囊却严重萎缩,导致其严重免疫抑制和生产性能下降,严重威胁养禽业健康发展。2017 年,本实验室率先鉴定了该疫情的病原是IBDV 新型变异株[9]。本研究初步监测了IBDV 新型变异株的流行情况,研究了其致病性,对IBD 的综合防控具有重要意义。
1 材料与方法
1.1 临床样品 临床样品采集于2018 年9 月至2019 年6 月,共251 份法氏囊样品,来自于黑龙江、辽宁、河北、山东、江苏、浙江、云南共7 个省份的48 个肉鸡群(表1)。发病鸡主要为3 周龄~6周龄的免疫鸡群,呈现亚临床感染,但法氏囊组织严重萎缩,鸡的免疫力和生产性能受到影响。采集的法氏囊组织用PBS 溶液制备成10 % (w/v)的混悬液,反复冻融3 次,于4 ℃、5 000 g 离心5 min,取上清进行后续检测。
1.2 主要实验材料 ExTaq酶、RNAiso Plus 均购自TaKaRa 公司;M-MLV 反转录试剂盒购自Invitrogen 公司。IBDV 新型变异株参考毒株SHG19 由中国农业科学院哈尔滨兽医研究所禽免疫抑制病团队(以下简称本实验室)分离、鉴定和保存[9]。SPF 鸡购自中国农业科学院哈尔滨兽医研究所实验动物中心,饲养于负压隔离器中。
1.3 IBDV VP2 基因高变区的扩增 根据GenBank中IBDV 参考序列设计VP2 基因代表区段通用引物,上游引物P1:5'-TCACCGTCCTCAGCTTAC-3'/下游引物 P2:5'-TCAGGATTTGGGATCAGC-3',由吉林省库美生物科技有限公司合成,预期扩增长度为643 bp。取 1.1 制备的200 μL 病料混悬液上清,根据RNAiso Plus 说明书提取总RNA,采用M-MLV反转录试剂盒反转录为cDNA,并以其为模板,PCR扩增VP2 基因片段,反应条件为:95 ℃5 min;95 ℃30 s、56 ℃ 30 s、72 ℃ 40 s,35 个循环;72 ℃ 10 min。经1 %琼脂糖凝胶电泳检测后,将同一鸡群阳性样品的RT-PCR 产物随机选择1~2 份由吉林省库美生物科技有限公司测序。最终将所有病毒株的有效序列确定为558 bp (VP2 基因的547 bp~1 104 bp,对应于aa183~aa368),并上传GenBank。该序列涵盖了VP2 基因的高变区(A 节段的746 bp~1 180 bp,对应于 VP2 基因的 616 bp~1 050 bp,VP2 蛋白氨基酸的aa206~aa350)。
1.4 序列分析 针对上述VP2 的558 bp 片段,利用软件 Clustal X program (version 2.0)[10]和 MEGA(version 3.1)[11]对本研究鉴定的IBDV 进行序列分析。本实验室 2017 年 9 月~2018 年 9 月鉴定的 50 株IBDV 新型变异株(表1)也基于该序列进行分析。所用的其它参考株如下:早期变异株:Variant E(USA)(AF133904)、Variant A (USA) (M64285)、GLS (USA)(AY368653)、E Del (USA) (DD187400)、9109 (USA)(AY462027); 超 强 毒 株 : BD399 (Bangladesh)(AF362776)、 02015.1 (France) (AJ879932)、 D6948(Netherlands) (AF240686)、 Gx (China) (AY444873)、Harbin-1 (China) (AF092171)、 HLJ0504 (China)(GQ451330)、 HK46 (China) (AF092943)、 OKYM(Japan) (D49706)、UK661 (UK) (NC-004178)、YS07(China) (FJ695138);弱毒株:CEF94 (Netherlands)(AF133904)、 CT (France) (AJ310185)、 CU-1 (Germany) (X16107)、 D78 (USA) (AF499929)、 Gt (China)(DQ403248)、HZ2 (China) (AF321054)、JD1 (China)(AF321055)、NB (China) (AY319768)、P2 (Germany)(X84034);经典株:IM (USA) (AY029166);中毒力疫苗株:W2512 (MN218126);血清 II 型病毒株:23/82(Germany)(AF362773)、OH(Canada)(U30818)。
1.5 IBDV 新型变异株动物感染试验
1.5.1 IBDV 致病性检测 选用IBDV 新型变异株SHG19 感染SPF 鸡,进行致病性试验。为了测定SHG19 的最小致病剂量,将28 日龄SPF 鸡随机分为4 组,每组10 只。将SHG19 原液10 倍倍比稀释(8×104~8×106)后分别感染第 1、2、3 组鸡,200 μL/只,感染途径为点眼滴鼻。第4 组鸡接种PBS(200 μL/只)作为空白对照。感染SPF 鸡后逐日观察鸡的临床症状。感染后第7 d 剖检所有实验鸡,观察法氏囊的病变情况。称量体重和法氏囊重量,计算囊重指数(bursa∶body-weight index,BBIX)。囊重比 =(法氏囊重/ 体重)×1 000;BBIX= 实验组鸡囊重比 / 空白对照组鸡平均囊重比;当BBIX<0.7 时,判为法氏囊萎缩[12]。每组随机选取3 只鸡的法氏囊组织样品浸泡在10 %福尔马林溶液中,经HE 染色后,观察其病理变化。
1.5.2 法氏囊半数萎缩量(50 % buysae atrophy dose,BAD50)的测定 在1.5.1 的试验中,统计感染后第7 d每个感染组的法氏囊萎缩的鸡数,采用Reed-Muench[13]法计算该病毒的BAD50。
2 结果与讨论
2.1 IBDV VP2 基因高变区扩增结果 本研究利用1.3 中RT-PCR 共检测了来自于7 个省的疑似非典型IBD 的251 份法氏囊病料,结果显示鸡群IBDV 阳性率为77.08%(37/48),病料IBDV 阳性率为68.53%(172/251)。最终经测序确定了32 株IBDV 株的VP2基因高变区序列,GenBank 登录号见表1。
2.2 序列分析结果 基于VP2 基因高变区的氨基酸序列进化树显示,血清I 型IBDV 明显分为经典株、超强株、减毒株和变异株4 个分支;本研究的32 株IBDV 处于变异株分支(图1)。基于VP2 基因高变区核苷酸序列的同源性分析显示,IBDV 新型变异株与美国早期变异株的同源率为91.4%~94.8%(除了GLS 株),而与经典株、超强株、减毒株的同源率分别为89.8%~91.9%、87.6%~91.0%、88.9 %~91.9 %。在VP2 高变区中,本研究的32 株IBDV具有变异株特征性氨基酸222T、249K、286I 和318D[14-15]。表明非典型IBD 的病原是IBDV 变异株。
在进化树中,IBDV 变异株分为两个明显的亚群,美国早期变异株为一个亚群,本研究的32 株IBDV 与本实验室之前报道的IBDV 新型变异株形成了另一个亚群(图1)。IBDV 新型变异株之间的VP2基因高变区核苷酸序列的同源率为95.1 %~100 %,而与美国早期变异株的同源率仅为91.4 %~94.8 %(除了 GLS 株)。另外,IBDV 新型变异株的 VP2 高变区存在3 个不同于美国早期变异株的独特氨基酸(221K、252I 和299S)。表明我国新流行的IBDV 变异株属于IBDV 新型变异株。
本研究的32 株IBDV 新型变异株涵盖了黑龙江、辽宁、河北、山东、江苏、浙江、云南全部7个被检测省份。结合本实验室的前期研究结果,已经在我国黑龙江、吉林、辽宁、河北、北京、山东、山西、福建、江苏、安徽、湖北、浙江、云南等至少13 个省(市)检测到了IBDV 新型变异株的流行,发病鸡主要是25 日龄以上的肉鸡。这提示IBDV 新型变异株正在我国不断蔓延。

表1 IBDV 新型变异株的背景信息Table 1 Background information of IBDV novel variant strains
IBDV 变异株最早于上世纪80 年代末出现于美国,随后其在美国流行的报道一直没有间断,而且成为威胁养禽业的优势IBDV 株,造成了严重的经济损失[16-17]。IBDV 变异株于上世纪90 年代初在包括中国在内的其它国家也有零星发现,但随后鲜见流行的报道。最近我国IBDV 新型变异株的鉴定是近30 年来亚太地区关于IBDV 变异株较大范围流行的首次报道[9]。IBDV 新型变异株的起源尚无定论。有人认为是源于免疫压力下的野毒株的突变或重组;有人认为类似病毒株早就存在,只是由于人们长期以来过度关注vvIBDV 而在监测上被“忽视”了[18]。具体原因尚待进一步研究。
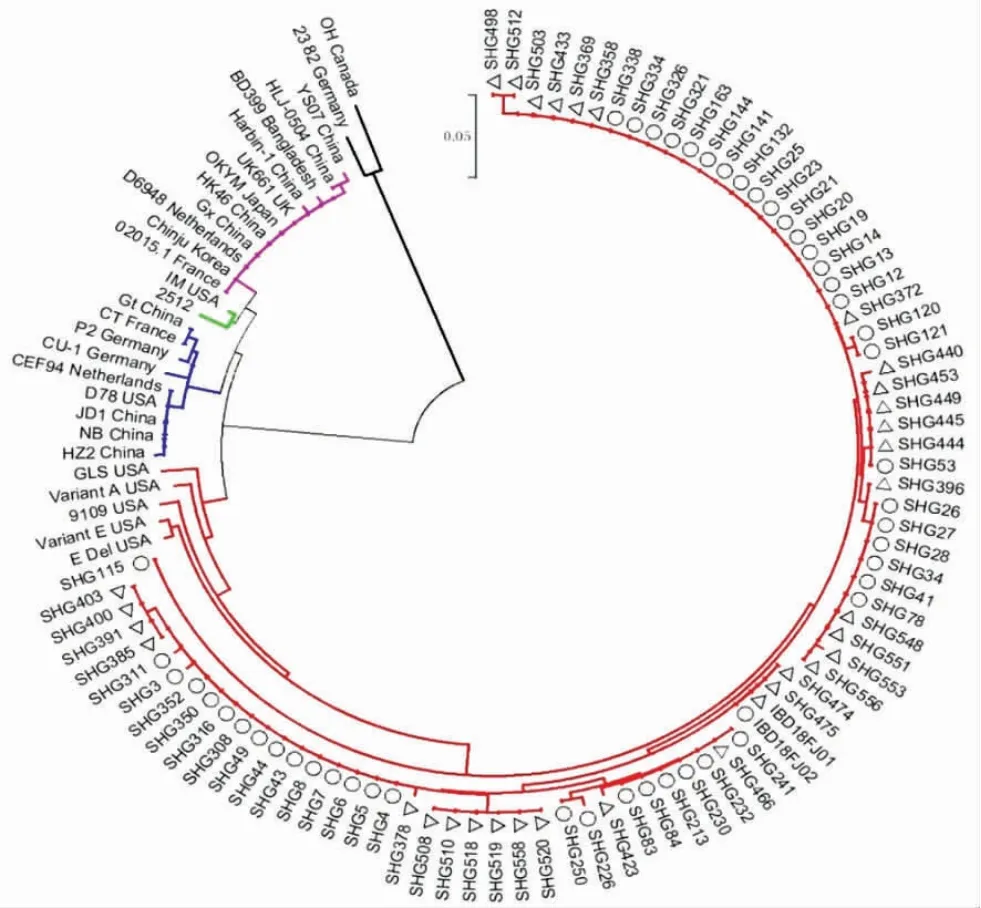
图1 IBDV VP2 高变区氨基酸序列进化树Fig.1 The phylogenetic tree of HVR amino acid sequence of IBDV VP2 gene
2.3 IBDV 新型变异株动物感染试验结果 和空白对照组一样,SHG19 不同剂量感染的3 个组SPF鸡,均未观察到明显外观症状。感染后第7 d 剖检发现,与空白对照组相比,8×104和8×105两个稀释剂量组SPF 鸡的法氏囊呈现明显萎缩,质地变硬,BBIX 分别为 0.322±0.045 和 0.342±0.070;8×106稀释剂量组SPF 鸡法氏囊大小正常,BBIX 为1.077±0.209 (图2A 和2B)。组织病理学切片显示,SHG19感染组萎缩的法氏囊中滤泡结构受到破坏,淋巴细胞显著减少,个别滤泡髓质可见少量异嗜细胞浸润,局部成纤维细胞增生,对照组无明显病理变化(图2C)。
IBDV 新型变异株引起的非典型IBD 的危害不容忽视。一方面,IBDV 新型变异株虽然不致死鸡,但却造成鸡中枢免疫器官法氏囊严重萎缩,导致机体免疫力降低,易继发和并发其它疫病。另一方面,IBDV 新型变异株会干扰其它重要疫病疫苗的免疫效果。前期研究数据显示,IBDV 新型变异株的感染严重干扰了禽流感H5/H7 二联疫苗的抗体产生[9]。再者,IBDV 新型变异株的感染严重影响增重等生产性能[9]。
前期研究显示,IBDV 新型变异株在CEF、DF1等细胞中不能产生细胞病变,对鸡胚的致病性也较弱,无法采用传统的TCID50(50 % tissue culture infective dose)或 ELD50(50 % embryo lethal dose)进行病毒效价的测定,这在一定程度上限制了对该病的进一步研究。系统的致病性研究发现,法氏囊萎缩是IBDV 新型变异株感染鸡的一个具有重要示病意义的症状,本研究首次提出了BAD50的概念,即能造成半数鸡的法氏囊萎缩的病毒感染剂量。用10 倍比稀释的IBDV 变异株感染28 日龄SPF 鸡,每个稀释度10 只鸡,感染后第7 d 剖检,依据BBIX 统计各组鸡的法氏囊萎缩数,采用Reed-Muench[13]法计算病毒的BAD50。本研究对IBDV 新型变异株SHG19的 BAD50测定结果显示,8×104和 8×105稀释剂量组的10 只鸡法氏囊全部萎缩,8×106稀释剂量组的10只鸡法氏囊均正常(图2A 和 2B),计算出本批SHG19 的效价为 1.26×106BAD50/100 μL。

图2 IBDV 新型变异株的动物感染实验Fig.2 Animal infection experiment of novel variant strains of IBDV
值得注意的是,本研究的IBDV 新型变异株均是在免疫鸡群中检测到的,这提示针对vvIBDV 的现有疫苗可能不能对IBDV 新型变异株提供完全保护。前期研究发现,与vvIBDV 及其减毒疫苗株相比,IBDV 新型变异株具有完全不同的单克隆抗体反应谱特征[9]。IBDV 新型变异株的分子流行病学、遗传变异机制、免疫抑制机制以及对疾病的有效防控措施亟需深入研究。
