鸡源致病性大肠杆菌地方流行株外膜蛋白的制备及其免疫原性研究
2020-01-17张艳英张召兴郭家媚李蕴玉李佩国
张艳英,张召兴,郭家媚,李蕴玉,李佩国*,索 勋
(1.中国农业大学动物医学学院,北京100094;2.河北科技师范学院河北省预防兽医学重点实验室,河北秦皇岛066004;3.河北旅游职业学院畜牧兽医系,河北承德067000)
鸡大肠杆菌病是临床常见的禽细菌性传染病之一,该病对雏鸡造成高发病率和死亡率,并导致产蛋鸡的生产性能下降,对养鸡业带来严重的经济损失[1]。大肠杆菌(Escherichia coli)是一种条件致病菌,具有血清型复杂、种类繁多等特点[2]。同时,人类食用被E.coli污染的食品,可引起食物中毒,是一种具有重要公共卫生意义的病原菌[3]。
大肠杆菌的膜系统由三层组成:细胞质膜、肽聚糖层和共价连接的外膜[3]。这种膜系统可以保护细菌免受环境应激、赋予其耐药性,并具有免疫防御功能[4]。国内外相关研究表明,外膜蛋白(Outer membrance protein,OMPs)具有免疫原性和免疫保护性,可作为潜在的评估中的候选疫苗之一[5-7]。为了探索致病性大肠杆菌OMPs 的组成结构及抗原性,本实验通过对不同血清型地方流行株的致病性大肠杆菌菌株进行OMPs 提取,电镜观察其结构,分析了其反应原性,并免疫小鼠和鸡,评价其免疫保护性,为致病性大肠杆菌的亚单位疫苗的研究提供参考。
1 材料与方法
1.1 菌株与实验动物 不同血清型的致病性大肠杆菌 :O157/O147/O142、 O107、 O91/O89、 O89/O48、O142、O18/O157、O59/O45、O18、O89/O78、O38,依次编号为EC-1~EC-10,均由河北省预防兽医学重点实验室鉴定保存;体质量约20 g 的清洁级昆明鼠及鸡购自中国医学科学院实验动物研究所,实验前在动物隔离器适应环境1 周。
1.2 主要试剂 ML1640 不完全培养基、ML1640完全培养基购自Gibco 公司;刀豆蛋白A、弗氏不完全佐剂、弗氏完全佐剂购自Sigma 公司;MTT、淋巴细胞分离液、兔抗鸡大肠杆菌阳性血清、山羊抗兔IgG-HRP 购自北京九州天瑞科技有限公司;四氨基联苯胺(TMB) 购自Amresco 公司;ECL 检测试剂盒购自上海贝博生物公司;通用显色粉、通用定影粉购自天津市世纪奥博商贸有限公司;鸡大肠杆菌蜂胶灭活疫苗购自山东华宏生物工程有限公司。
1.3 鸡致病性大肠杆菌OMPs 提取及超微结构观察 利用超声波破碎仪将10 株不同血清型的致病性大肠杆菌破碎后,采用Sarkosyl 法[8]进行OMPs 提取,经考马斯亮蓝染色后测定其浓度[9]。将提取的OMPs 经2 %醋酸铀染色2 min 后,去除多余染料,晾干后在透射电镜下观察。
1.4 OMPs SDS-PAGE 检测和 western blot 鉴定采用SDS-PAGE 分析提取的OMPs 分子量;同时以兔抗鸡大肠杆菌阳性血清(1∶300)为一抗,山羊抗兔HRP-IgG (1 ∶1 000)为 二 抗 , 采 用 western blot 鉴 定OMPs 的反应原性。
1.5 OMPs 对小鼠的免疫效果评价 参照文献[10],选取E.coliEC-9 菌株 OMPs 进行免疫试验。将105 只健康昆明系小鼠随机分成3 组,每组35只,设蛋白免疫组(OMP+ 弗氏佐剂)、疫苗组和空白对照组。蛋白免疫组首免以肌肉注射30 μg OMPs(弗氏完全佐剂乳化),间隔两周以同样方式和剂量二免(弗氏不完全佐剂乳化);疫苗组注射等体积鸡大肠杆菌蜂胶灭活疫苗,免疫程序同上;对照组以同样的免疫程序注射等体积PBS (对应弗氏佐剂乳化)。首免第48 d 后对3 组小鼠采用5 LD50(2×107cfu)E.coliEC-9 株攻毒,攻毒后观察记录每组小鼠死亡情况。
在小鼠初次免疫前及免疫后7 d、14 d、28 d、42 d 经眼球脉络丛采血,分离血清,于-20 ℃保存。以提取的E.coliOMPs 作为包被抗原,采用间接ELISA[11]检测免疫小鼠特异性抗体效价,免疫组的血清OD450nm与空白对照组的阴性血清OD450nm的比值(P/N 值)小于2.0 为阴性,反之为阳性;采用MTT法[12]检测免疫小鼠外周血T 淋巴细胞转化率;采用常规法[13]分析免疫器官脾脏指数。
1.6 OMPs 对鸡的免疫效果评价 参照文献[10],选择14 日龄海兰褐雏鸡105 只,随机分成3 组,每组35 只。第1 组为空白组;第2 组为鸡大肠杆菌蜂胶灭活疫苗,免疫剂量为0.2 mL/只(2.0×109cfu/mL);第3 组为OMPs+不完全弗氏佐剂,免疫剂量为0.2 mL/只(含OMP 30 μg);试验方案同方法1.5。同上,采用间接EILSA 法检测鸡特异性抗体效价、MTT 法检测鸡外周血T 淋巴细胞转化率,常规法分析免疫器官脾脏指数。
2 结 果
2.1 OMPs 浓度测定及超微结构观察结果 各菌株提取OMPs,经考马斯亮蓝染色后测定其浓度。结果显示,所测得的不同血清型的大肠杆菌地方流行株 OMPs 浓度在 1 026.632 μg/mL~1 715.589 μg/mL,这可能与大肠杆菌在LB 液体培养基生长快慢有关。将提取的OMPs 经透射电镜观察,可见大肠杆菌OMPs 基本上呈双层泡状的C 形结构,也有个别的呈双层泡状的O 形结构(图1)。大肠杆菌外膜之所以呈现多形性,可能是由于超声波破碎细菌时被裂解造成的。
2.2 OMPs SDS-PAGE 和 western blot 鉴定 利用 SDS-PAGE 分析10 个菌株的OMPs 分子量,结果显示,10 株菌的OMPs 在25 ku~55 ku 处有大小不等的条带,其中以位于55 ku 的OMPs 含量最高。Western blot 鉴定结果显示,10 个菌株的OMPs 均可与大肠杆菌阳性血清发生反应(图2),表明鸡致病性E.coli的OMPs 具有良好的反应原性。
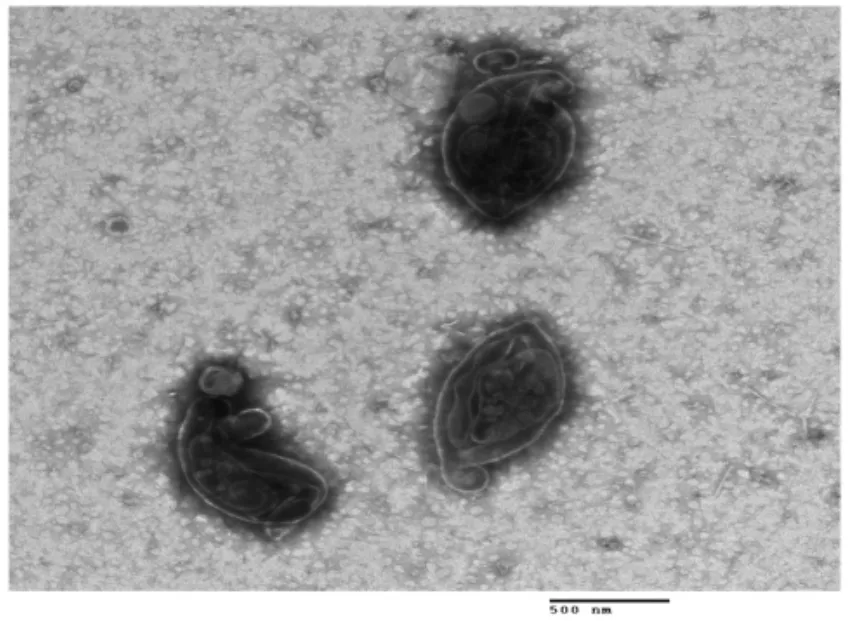
图1 鸡致病性大肠杆菌地方流行株OMPs 的超微结构Fig.1 Ultrastructure of Omps of endemic strains of avian pathogenic Escherichia coli
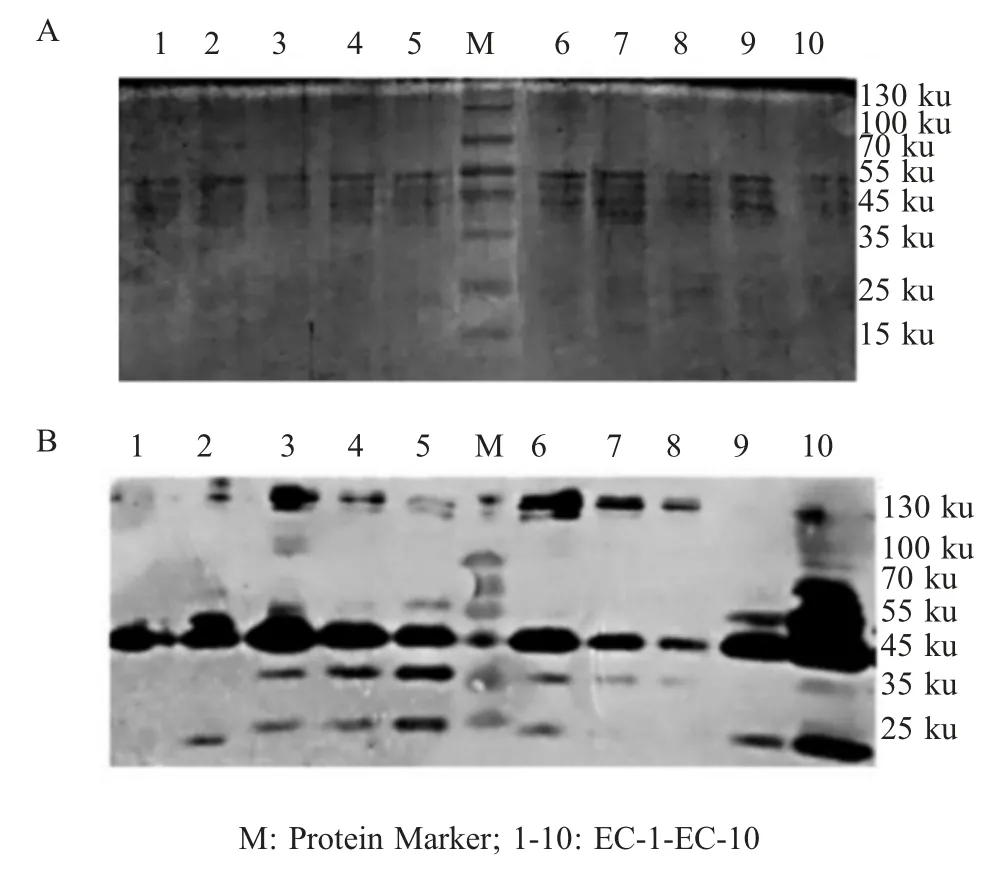
图2 10 株地方流行致病性大肠杆菌OMPs 的SDS-PAG 检测及western blot 分析Fig.2 Analysis of 10 endemic strains of pathogenic E.coli OMPs by SDS-PAGE (A) and western blot (B)
2.3 OMPs 免疫小鼠的效果评价 3 组小鼠省免疫48 d 后经腹腔感染E.coliEC-9,结果显示对照组小鼠全部死亡,蜂胶灭活疫苗组死亡4 只,OMPs 免疫组死亡2 只,其余小鼠经过7 d 精神沉郁、食欲不振后逐渐恢复健康;E.coli蜂胶灭活疫苗免疫组保护率为60 %,OMPs 免疫组攻毒保护率为70 %(图3A),表明OMPs 对小鼠具有一定的保护力,且免疫保护力略好于市售蜂胶疫苗。将5 次采集的免疫小鼠血清进行间接ELISA 检测,结果显示,两种疫苗免疫小鼠后血清中的抗体水平均高于空白组,表明OMPs 和蜂胶疫苗组均能诱导小鼠产生较强的体液免疫应答,OMPs 组抗体效价最高(1∶400) (图3B)。结果表明,OMPs 能够诱导小鼠产生较强的体液免疫应答。
OMPs 免疫小鼠后,MTT 试验结果显示,OMPs组小鼠的淋巴细胞转化率明显高于空白对照组与蜂胶疫苗免疫组,最高达1.582 (图3C)。通过测定其脾脏指数进一步评估细胞免疫水平,结果显示OMPs 免疫组小鼠的脾脏指数均高于蜂胶疫苗组,最高达5.334 (图3D)。上述结果表明OMPs 能诱导小鼠产生较强的细胞免疫应答。

图3 OMPs 免疫小鼠免疫保护效果(A)、血清中抗体(B)和T 淋巴细胞增值转化水平(C)变化及脾脏指数消长(D)检测结果Fig.3 Immunoprotective effects(A), Effect of spleen index (D) and changes of serum antibody levels(B) and T lymphocyte proliferation and transformation (C) in mice immunized with OMPs
2.4 OMPs 免疫雏鸡的效果评价 3 组雏鸡免疫后48 d 经肌肉感染E.coliEC-9 菌株,结果显示对照组雏鸡全部死亡,疫苗组雏鸡死亡8 只,OMPs 免疫组雏鸡死亡4 只,其余雏鸡经过精神沉郁、食欲不振后逐渐恢复健康;E.coli蜂胶灭活疫苗组免疫保护率为60%,OMPs 免疫组免疫保护率为80%(图4A)。结果表明OMPs 对雏鸡具有良好的保护力。利用ELISA 方法检测5 次采集的免疫雏鸡血清抗体滴度,结果显示两种疫苗免疫组抗体水平均高于空白组,OMPs 免疫组的抗体水平(最高为1∶800)高于蜂胶疫苗免疫组(最高为 1∶400) (图4B),表明 OMPs 能诱导雏鸡产生较强的体液免疫应答。
OMPs 免疫后进行MTT 试验,结果显示OMPs免疫组雏鸡的淋巴细胞转化率明显高于空白对照组与蜂胶疫苗免疫组,蜂胶组最高达1.693,OMPs 最高达2.215 (图4C),表明OMPs 能诱导雏鸡产生较强的细胞免疫应答。OMPs 和蜂胶疫苗免疫组的雏鸡脾脏指数均显著高于空白组,最高达3.981 和3.683 (图4D)。上述结果表明OMPs 能刺激诱导雏鸡较强的细胞免疫水平,且效果优于市售蜂胶疫苗组。
3 讨 论
鸡致病性E.coli拥有多种血清型,同一血清型中不同的菌株之间无交叉免疫保护性,尚无有效疫苗进行预防,成为鸡大肠杆菌病的广泛流行的主要原因之一[14-15]。相关研究表明大肠杆菌的OMPs 具有免疫原性,并具有一定的免疫保护效果,但不同地区大肠杆菌OMPs 差异明显,交叉保护效果较差,因此本研究选择地方流行株OMPs 进行侯选亚单位疫苗的研制[16]。
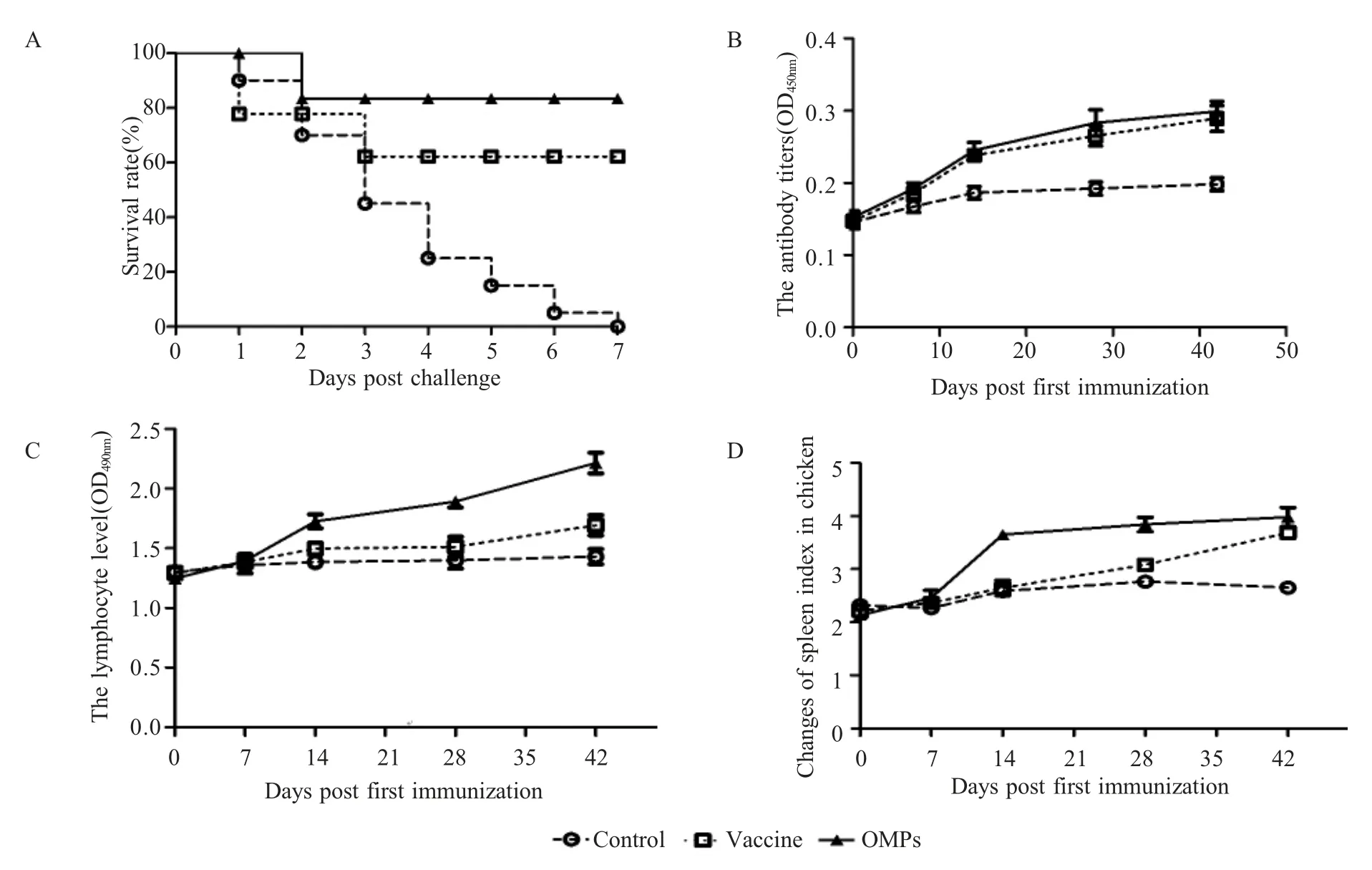
图4 OMPs 免疫雏鸡免疫保护效果(A)、血清中抗体(B)和T 淋巴细胞增值转化水平变化(C)及脾脏指数消长检测结果(D)Fig.4 Immunoprotective effects (A), Effect of Spleen Index (D) andchanges of serum antibody levels(B) and T lymphocyte proliferation and transformation (C) in chickens immunized with OMPs
国内相关研究发现革兰氏阴性菌OMPs 通过负染后,在电镜下观察其形态,基本上呈现双层泡状结构,大多数为O 形或C 形。程安春报道了伤寒杆菌的OMPs 负染后经电镜观察,其形态基本上都是双层泡状结构,多数为O 形或者C 形[16]。苏敬良等在透射电镜下观察到的鸭疫里默氏杆菌的OMPs 大多数是圆形的双层膜结构,少数为C 形[17]。本研究观察到的大肠杆菌OMPs 的形态结构主要为C 形的双层泡状结构,少数呈O 形,与之前报道的结果基本一致。
传统的大肠杆菌全菌体菌苗、单一蛋白抗原组成的亚单位疫苗的疫苗效力和保护能力有限,但OMPs 是多种具有免疫保护效果的蛋白混合体,可刺激免疫动物产生良好的免疫保护效果[18-19]。Udhayakumar 等报道从光滑(C5)和粗糙(Rb2)鼠伤寒沙门氏菌菌株中提取的OMPs 能够诱导对沙门氏菌病的保护性免疫,保护持续至少6 个月[20]。徐晶等发现坏死梭杆菌 OMPs 经 SDS-PAGE、western blot 和接种小鼠病理学检测分析表明其具有良好的免疫原性[8]。E.coliOMPs 的基因表达在调节E.coli的免疫机能和毒力岛致病性等方面起着关键性作用[21]。李晓霞等证实了肠致病性大肠杆菌OMPs 可以诱导兔对大肠杆菌的特异性体液免疫和细胞免疫应答,提高免疫血清中抗OMP 的抗体效价和体外脾淋巴细胞特异性增殖反应,且对大肠杆菌感染具有一定的抵抗力[13]。本研究也证实了鸡源E.coli地方流行株的OMPs 能刺激小鼠和雏鸡机体产生体液和细胞免疫,对小鼠和雏鸡产生良好的免疫保护,保护率明显高于蜂胶疫苗组。与张彦明等报道的用不同OMP型的大肠杆菌菌株制备融合菌株疫苗免疫雏鸡,对雏鸡保护率均高于O 血清型单价疫苗和双价疫苗一致[22]。由于E.coli具有多种O 血清型,O 血清型单价或者多价疫苗只对同种血清型亲本株具有保护作用,对其它血清型非亲本株无交叉保护性[22-24]。本实验选用的鸡大肠杆菌蜂胶灭活疫苗为多价疫苗(血清型O1、O2、O78),鸡大肠杆菌蜂胶灭活疫苗和OMPs 弗氏佐剂疫苗均能提高机体的免疫机能,从动物攻毒保护试验可知OMPs 弗氏佐剂疫苗保护率高于鸡大肠杆菌蜂胶灭活疫苗,可能由于攻毒的菌株血清型为O89/O78,而鸡大肠杆菌蜂胶灭活疫苗只对同种血清型亲本株具有能保护作用,对其它血清型非亲本株缺少交叉保护作用所致。王文豪等[25]发现猪致病性大肠杆菌OMPs 亚单位疫苗对不同菌株均具有交叉免疫保护力,这与本实验的结果基本一致。然而如何使OMPs 亚单位疫苗形成规模化生产,并充分发挥其良好的免疫效果,还有待进一步研究。
