耻垢分枝杆菌诱导中性粒细胞胞外诱捕网形成的研究
2020-01-17臧鑫鑫党光辉王忠星刘虹秀崔子寅崔莹莹宋宁宁刘思国
臧鑫鑫,党光辉,王忠星,刘虹秀,崔子寅,崔莹莹,宋宁宁,刘思国
(中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/ 动物细菌病创新团队,黑龙江哈尔滨150069)
中性粒细胞(Neutrophils)是血液中含量最丰富的一种白细胞,在抵抗病原微生物的侵入中发挥重要作用。在病原微生物感染期间,特别是感染的早期,能够迅速招募大量中性粒细胞到达感染部位并发挥作用[1]。中性粒细胞主要通过3 种防御机制杀灭病原微生物,包括吞噬、脱颗粒和形成中性粒细胞胞外诱捕网(Neutrophil extracellular traps,NETs)[2-3]。这种NETs 结构主要由解聚的染色体DNA 构成NETs 的基本骨架,上面附着有组蛋白、髓过氧化物酶、钙网蛋白及其它抗菌蛋白,在体内和体外条件下均能够捕获并杀灭病原微生物[4]。许多刺激因子和病原微生物如PMA、脂多糖、链球菌、白色念球菌、利什曼原虫等均能够诱导NETs 的形成[5-6]。
结核分枝杆菌(Mycobacterium tuberculosis,MTB)在体外也能够诱导NETs 的形成,但NETs 不能将其杀灭[7]。耻垢分枝杆菌(Mycobacterium smegmatis,MS)作为一种研究MTB 蛋白功能的重要模式菌[8-9],是否能够诱导中性粒细胞形成NETs 目前还不清楚。因此本研究通过分离牛的外周血中性粒细胞,体外研究MS 是否对中性粒细胞形成NETs,为后续利用MS 作为模式菌研究结MTB 的重要蛋白功能提供参考。
1 材料与方法
1.1 菌种和质粒 pMV361-mCherry 红色荧光重组质粒和MS MC2 155 菌株由本实验室保存。
1.2 主要试剂 牛外周血中性粒细胞分离液试剂盒和白细胞分类染色液购自天津灏洋生物制品科技有限公司;4 %组织细胞固定液购自索莱宝生物科技有限公司;Anti-DNA/histone H1 抗体(鼠源)购自美国Merck Millipore 公司;驴抗鼠 IgG(Alexa Fluor 488)购自美国 Abcam 公司;poly-L-lysine、PMA 和DAPI 购自美国Sigma 公司;Pi-coGreendsDNA 试剂盒购自美国ThermoFisher Scientifi 公司
1.3 重组红色荧光MS 的构建与鉴定 将MS 接种于7H9 (含0.2 %甘油和0.05 % Tween-80)液体培养基,37 ℃培养至其OD600nm为0.8~1.0,3 000 r/min离心10 min (4 ℃),收集菌体;用1 倍体积预冷的10 %无菌甘油重悬,离心去上清,重复此步骤5~7次;用0.1 倍体积预冷的10 %甘油重悬,分装,于-80 ℃保存备用。取 5 μL~10 μL 红色荧光重组质粒pMV361-mCherry 电转化入 100 μL MS 感受态细胞后,涂布于LB (含50 μg/mL 卡那霉素)固体培养基,37 ℃培养3 d。挑取多个单菌落于7H9(含50 μg/mL卡那霉素)液体培养基中培养至OD600nm到2.0 左右,于45 ℃培养30 min。各取100 μL 菌液于激光共聚焦小皿中,通过激光共聚焦显微镜观察菌液是否产生红色荧光。
1.4 牛外周血中性粒细胞的分离及鉴定 采集健康牛的抗凝血,使用牛外周血中性粒细胞分离液试剂盒分离中性粒细胞。具体方法参照说明书并作如下改动:于15 mL 离心管中依次加入4 mL 分离液1,2 mL分离液2,3 mL 抗凝血。700 r/min 离心45 min,取红色细胞层,加入红细胞裂解液,去除红细胞,得到牛外周血中性粒细胞后。利用白细胞分类染色液进行纯度鉴定。
1.5 MS 体外诱导NETs 形成的检测 将1 mL 牛外周血中性粒细胞(105个细胞/mL)铺在预先用poly-L-lysine 处理过的激光共聚焦小皿中,以MOI 0.1的感染率加入MS,同时分别在中性粒细胞中加入PMA (终浓度为 100 μg/mL)作为阳性对照,加入PBS 作为阴性对照。分别在感染2 h、4 h、6 h、8 h、10 h 时,依次用4%组织细胞固定液室温固定30 min,以10 %的山羊血清-5 %鱼明胶-1 % BSA 室温封闭2 h,鼠抗 DNA/Histone H1 抗体(1∶100)为一抗 4 ℃孵育过夜,驴抗鼠 IgG (Alexa Fluor 488) (1∶500)为二抗,室温孵育1 h,DAPI(5 μg/mL)室温染色10 min,50 %甘油封片,于激光共聚焦显微镜下观察结果。
1.6 胞外游离DNA 的定量 采用Pi-coGreends-DNA 试剂盒进行胞外游离DNA 的定量分析检测。参照1.5 的方法将100 μL 牛外周血中性粒细胞(105个细胞/mL)铺于96 孔细胞板中。分别用MS、PMA(阳性对照)、PBS(阴性对照)感染中性粒细胞,感染2 h、4 h、6 h、8 h、10 h 后,分别取 50 μL 培养上清到96 孔黑色细胞板中,再加入50 μL 稀释后的Pi-CoGreendsDNA 试剂,室温避光孵育5 min,用多功能酶标仪检测荧光密度。以PMA 阳性对照为标准,计算MS 实验组和PBS 阴性组中性粒细胞释放DNA 的百分比,最后用GraphPad 软件分析结果。
1.7 感染细胞后MS 存活率的检测 将280 μL 牛外周血中性粒细胞(105个细胞/mL)铺于48 孔细胞板中,加入MS (MOI 0.01)感染中性粒细胞,分别于感染 4 h、8 h、16 h、24 h、36 h 和 48 h 后,加入终浓度 100 U/mL 的 DNase I 和 3 %的 Trition X-100作用10 min,混匀,10 倍倍比稀释至106,每个稀释度的菌液均涂布于LB(含50 μg/mL 卡那霉素固体平板上,于37 ℃培养3 d,菌落计数后统计MS 的存活率。
2 结 果
2.1 重组红色荧光MS 的构建与鉴定结果 将整合型重组质粒pMV361-mCherry 电转化入MS 感受态细胞中,挑取多个单菌落接种于LB 液体培养液(含50 μg/mL 卡那霉素)中活化,活化的菌液通过激光共聚焦显微镜观察,结果显示,MS 发出红色荧光(图1)。表明,重组红色荧光MS 正确构建。
图1 重组红色荧光MS 的鉴定结果(630×)Fig.1 Identification of red fluorescent generated by recombinaht Mycobacterium smegmatis(630×)
2.2 牛外周血中性粒细胞的分离与鉴定结果 分离牛外周血得到的中性粒细胞用白细胞分类染色液染色后在显微镜下观察,结果显示,细胞核呈紫红色,形状为马蹄状或者2~5 个分叶,确定是中性粒细胞(图2),经检测纯度达到90 %以上。
2.3 MS 诱导NETs 的形成检测结果 将构建的红色荧光MS、PMA 和PBS 与中性粒细胞共孵育,结果显示,MS 与中性粒细胞共孵育2 h 后,开始出现网状结构,并且随着时间的延长,网状结构也逐渐增加。由于DAPI 可以将DNA 染成蓝色,驴抗鼠IgG (Alexa Fluor 488)将DNA/Histone 1 染成绿色。中性粒细胞胞外的网状结构由DNA、DNA/Histone 1共定位,证实为NETs。PMA 作为阳性对照,与中性粒细胞共孵育后形成大量的NETs,PBS 与中性粒细胞共孵育则不能形成网状结构(图3)。表明MS 能够诱导中性粒细胞形成NETs。

图2 牛外周血中性粒细胞的鉴定结果(400×)Fig.2 Identification of bovine peripheral blood neutrophils (400×)
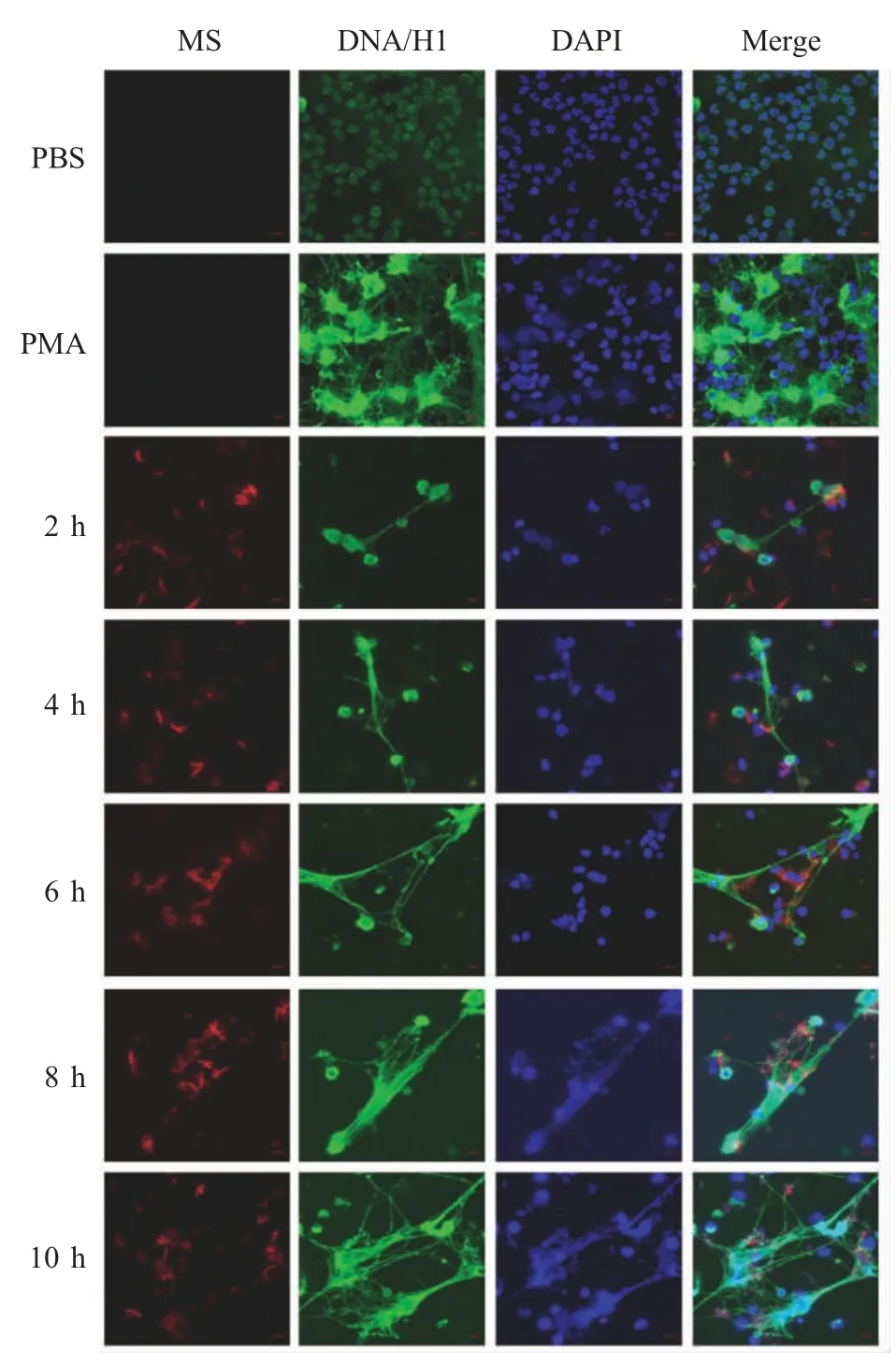
图3 MS 体外诱导NETs 形成的检测结果(630×)Fig.3 Detection of NETs formation in cluced by Mycobacterium smegmatis in vitro(630×)
2.4 胞外游离DNA 的定量结果 为了定量研究MS 诱导NETs 的形成,用Pi-coGreendsDNA 试剂盒测定胞外游离DNA 的含量,并计算各组释放DNA 的百分比。结果显示,MS 感染中性粒细胞后,胞外游离DNA 的释放量随着时间的延长而逐渐增加,与PBS 对照组相比差异极显著(p<0.01) (图4)。表明MS 感染中性粒细胞后,随着时间的延长,NETs 的释放量逐渐增加。

图4 不同时间点MS 诱导NETs 的定量检测结果Fig.4 The quantitative detection of NETs induced by Mycobacterium smegmatis at different time points
2.5 感染中性粒细胞后MS 存活率的检测结果 将MS 与中性粒细胞共孵育不同时间后经菌落计数检测NETs 杀伤MS 的能力。结果显示,MS 感染中性粒细胞后,随着时间的延长,MS 活菌数逐渐减少(图5)。表明NETs 具有杀灭MS 的能力。
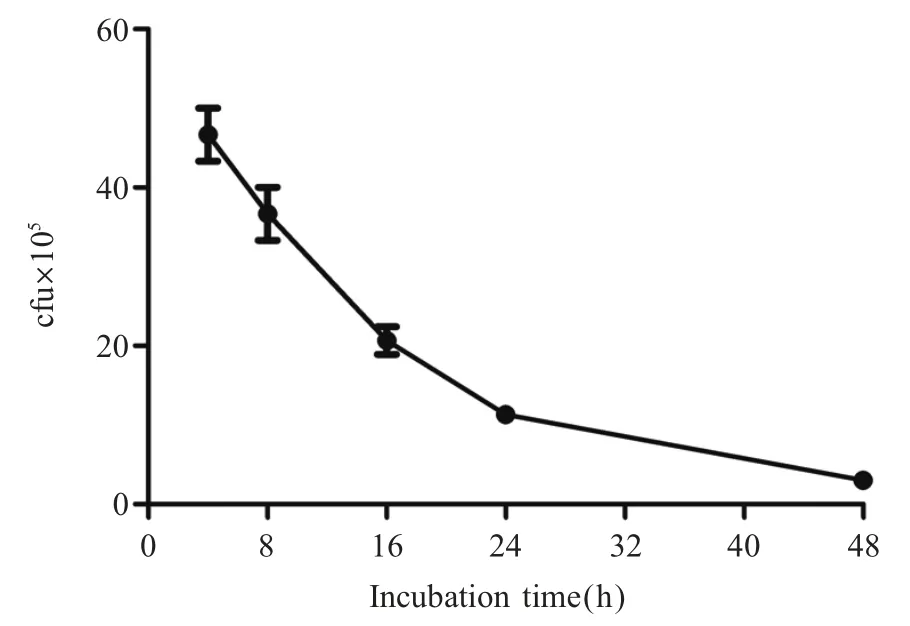
图5 MS 感染中性粒细胞后的存活情况检测结果Fig.5 Survival of Mycobacterium smegmatis in neutrophil
3 讨 论
中性粒细胞是血液中含量最丰富的一种白细胞,病原微生物(如细菌、真菌、病毒)感染的早期其能够被迅速招募到感染部位发挥杀菌作用[10]。当机体受到刺激发生炎症反应时,中性粒细胞通过表达大量的模式识别受体识别病原体释放的病原体相关分子模式(PAMPs),从而得以激活,最终通过吞噬、脱颗粒和形成NETs 而清除病原体[11]。MS 没有致病性,且生长迅速,是一种非常好的模式菌,在体外和体内常用来研究具有致病性的、生长缓慢的分枝杆菌(例如MTB 和副结核分枝杆菌)重要蛋白的功能[8]。
本实验在构建荧光MS 时选择了带红色荧光基因的重组质粒pMV361-mCherry,原因是其属于整合型质粒,可以将克隆基因整合到基因组染色体中,有效地克服了游离型荧光质粒不稳定的特性,可以用于后续MS 的定位实验。在分离牛外周血中性粒细胞时,由于牛的外周血相对于人的外周血而言较粘稠且成分比较复杂,按照试剂盒说明书操作得到的中性粒细胞纯度太低且细胞含量较少,不能用于后续试验。本研究以中性粒细胞分离液试剂盒为基础,通过优化分离条件,得到了高纯度的牛外周血中性粒细胞。为了检测MS 是否能够诱导NETs 的形成,本研究通过定性和定量相结合的方法,确定了NETs 的产生及释放量。在定性试验中,通过激光共聚焦显微镜准确观察到了NETs 的结构;在定量试验中,通过Pi-coGreendsDNA 试剂盒定量中性粒细胞胞外游离DNA 的释放量,二者共同证明MS 可以诱导NETs 的形成。
有研究报道显示,MTB 能够诱导NETs 的形成,但该NETs 不能杀灭MTB[7]。本实验室之前的研究结果显示,MS 感染小鼠后,在小鼠肺中7 d左右就能够被完全清除,而构建的MTB 鞘磷脂酶重组MS 则能够在小鼠肺内存活21 d 以上[12],MS被快速清除的机制就可能有NETs 参与其中。
综上所述,无致病力的MS 能够在体外诱导中性粒细胞形成NETs,且形成的NETs 能够杀灭MS。本实验为研究分枝杆菌的致病机制提供了重要的实验依据,但是关于具体是MS 中哪些蛋白诱导形成的NETs 还需要进一步研究。
